16.9:
معايرة حمض بوليبروتيك
16.9:
معايرة حمض بوليبروتيك
يحتوي حمض البوليبروتيك على أكثر من هيدروجين مؤين ويخضع لعملية تأين متدرجة. إذا كانت ثوابت التفكك الحمضي للبروتونات المؤينة تختلف بشكل كافٍ عن بعضها البعض، فإن منحنى المعايرة لهذا الحمض متعدد البروتينات يولد نقطة التكافؤ لكل من الهيدروجين المؤين الخاص به. لذلك، ينتج عن معايرة الحمض ثنائي البروتونات تكوين نقطتي تكافؤ، بينما ينتج عن معايرة حمض التريبروتيك تكوين ثلاث نقاط تكافؤ على منحنى المعايرة.
حمض الكربونيك، H2CO3، هو مثال على حمض ثنائي البروتيك ضعيف. ينتج عن التأين الأول لحمض الكربونيك أيونات الهيدرونيوم وأيونات البيكربونات بكميات صغيرة.
التأين الأول:
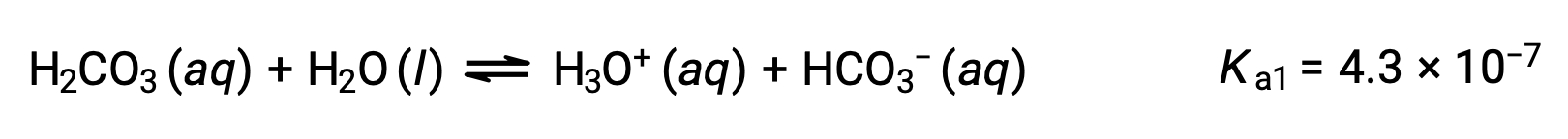
يمكن أن يعمل أيون البيكربونات أيضًا كحمض. يؤين ويشكل أيونات الهيدرونيوم وأيونات الكربونات بكميات أقل.
التأين الثاني:
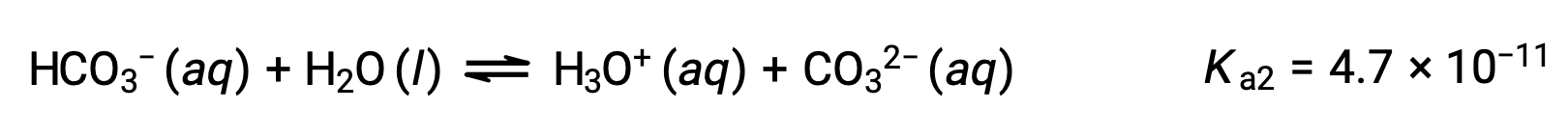
يتأين حمض الفوسفوريك، وهو حمض ثلاثي البروتيك، في ثلاث خطوات:
التأين الأول:
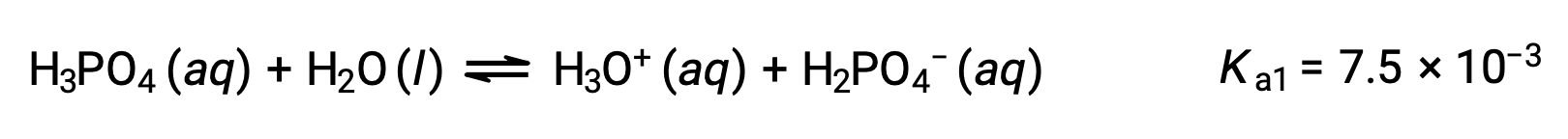
التأين الثاني:
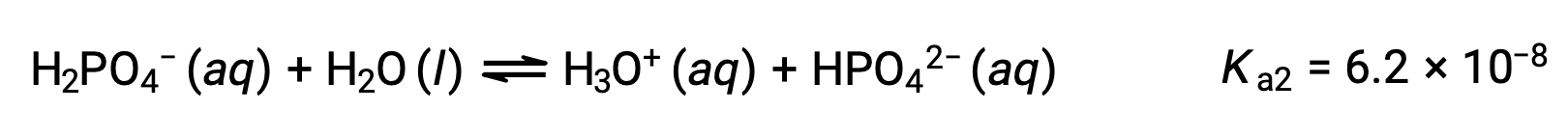
التأين الثالث:
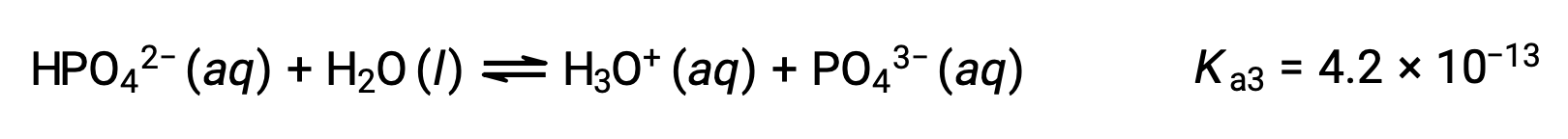
عندما تتم معايرة H3PO4 بقاعدة قوية مثل KOH، فإنها تنتج ثلاث نقاط تكافؤ لكل هيدروجين مؤين. ومع ذلك، نظراً لأن HPO42− هو حمض ضعيف جداً، فإن نقطة التكافؤ الثالثة لا يمكن تمييزها بسهولة على منحنى المعايرة.
تم اقتباس هذا النص من Openstax, Chemistry 2e, Section 14.5: Polyprotic Acids.
