17.6:
Energia libera di Gibbs
17.6:
Energia libera di Gibbs
Una delle sfide dell’uso della seconda legge della termodinamica per determinare se un processo è spontaneo è che richiede misurazioni del cambiamento di entropia per il sistema e del cambiamento di entropia per l’ambiente circostante. Un approccio alternativo che coinvolge una nuova proprietà termodinamica definita solo in termini di proprietà di sistema fu introdotto alla fine del XIX secolo dal matematico americano Josiah Willard Gibbs. Questa nuova proprietà è chiamata energia libera di Gibbs (G) (o semplicemente energia libera), ed è definita in termini di entalpia ed entropia di un sistema come le seguenti:
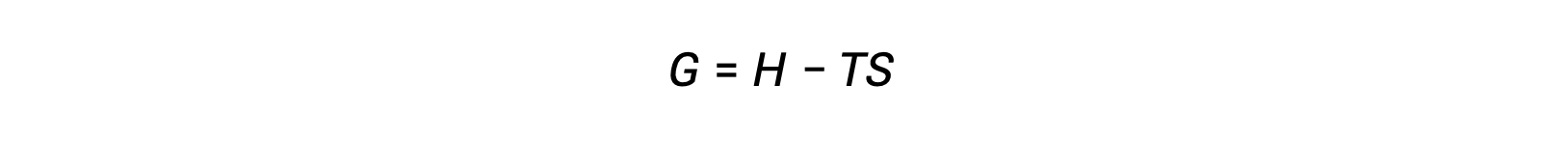
L’energia libera è una funzione di stato, e a temperatura e pressione costanti, il cambiamento di energia libera (ΔG) può essere espresso come segue:

La relazione tra questa proprietà di sistema e la spontaneità di un processo può essere compresa richiamando l’espressione della seconda legge precedentemente derivata:
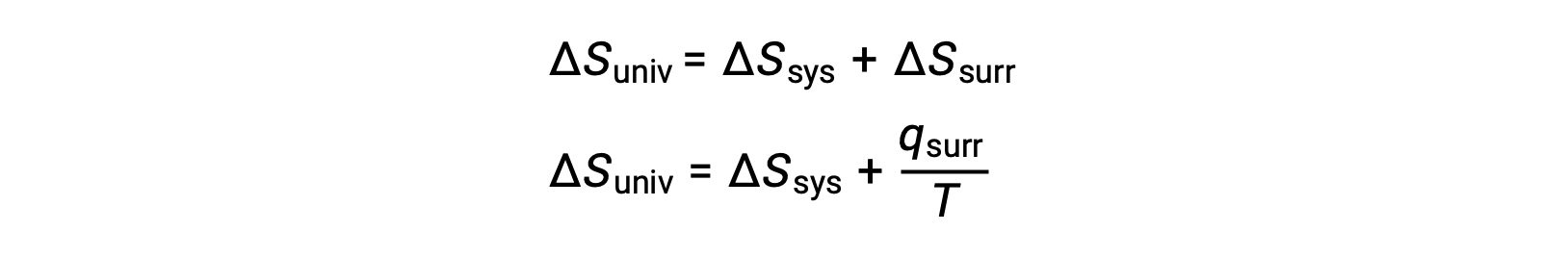
La prima legge richiede che qsurr = −qsyse a pressione costante qsys = ΔH, quindi questa espressione può essere riscritta come:
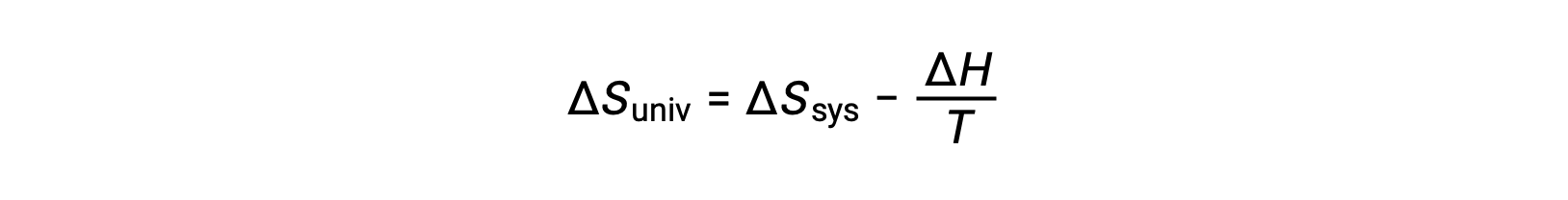
Moltiplicando entrambi i lati di questa equazione per −T e riorganizzando si ottiene quanto segue:
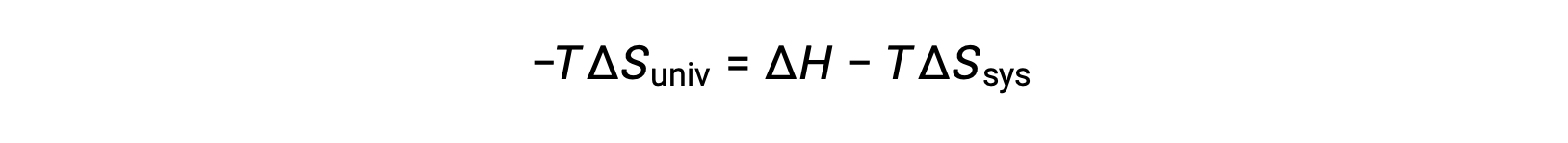
Per semplicità, il pedice “sys” può essere omesso e l’espressione diventa
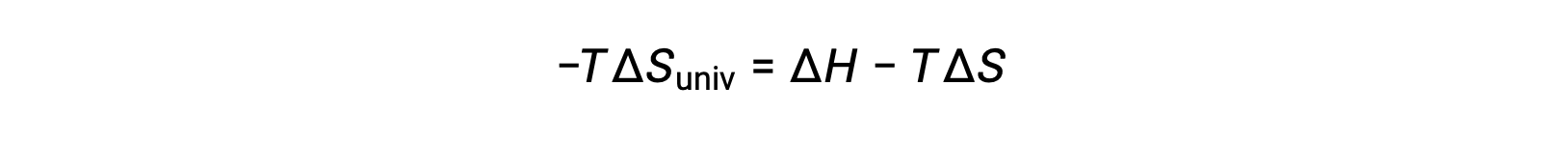
Confrontando questa equazione con la precedente per il cambiamento di energia libera mostra la seguente relazione:
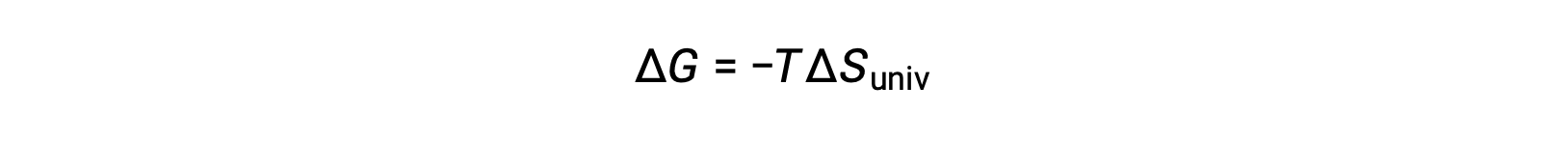
Il cambiamento di energia libera è, quindi, un indicatore affidabile della spontaneità di un processo, in quanto è direttamente correlato all’indicatore di spontaneità precedentemente identificato, ΔSuniv.
Se ΔSuniv > 0, ΔG < 0 e la reazione è spontanea.
Se ΔSuniv < 0, ΔG > 0 e la reazione non èpontanea.
Se ΔSuniv = 0, ΔG = 0 e la reazione è in equilibrio.
Questo testo è adattato da Openstax, Chimica 2e, Capitolo 16.4: Energia Libera.
