11.21:
Centratura e coordinamento reticolare
11.21:
Centratura e coordinamento reticolare
La struttura di un solido cristallino, che sia un metallo o meno, è meglio descritta considerando la sua unità ripetuta più semplice, che viene definita la sua cella unitaria. La cella unitaria è costituita da punti del reticolo che rappresentano le posizioni di atomi o ioni. L’intera struttura è quindi costituita da questa cella unitaria che si ripete in tre dimensioni. I tre diversi tipi di cellule unitarie presenti nel reticolo cubico sono illustrati nella figura 1.
Tipi di celle unitarie
Immagina di prendere un gran numero di sfere identiche e di sistemarle uniformemente in un contenitore in modo tale che uno strato sia direttamente sopra le sfere nello strato sottostante. Questa disposizione è chiamata struttura cubica semplice, e la cella unitaria è chiamata semplice cella unitaria cubica o cella unitaria cubica primitiva. In una semplice struttura cubica, le sfere non sono imballate il più vicino possibile e “riempiono” solo circa il 52% del volume del contenitore.
Un atomo in questo tipo di disposizione contatta solo i quattro vicini più vicini nel suo strato; un atomo direttamente sopra di esso nello strato sopra; e un atomo direttamente sotto di esso nello strato sottostante. Il numero di altre particelle che ogni particella in un contatto solido cristallino è noto come il suo numero di coordinazione. Per un atomo di polonio in un semplice array cubico, il numero di coordinazione è, quindi, sei.
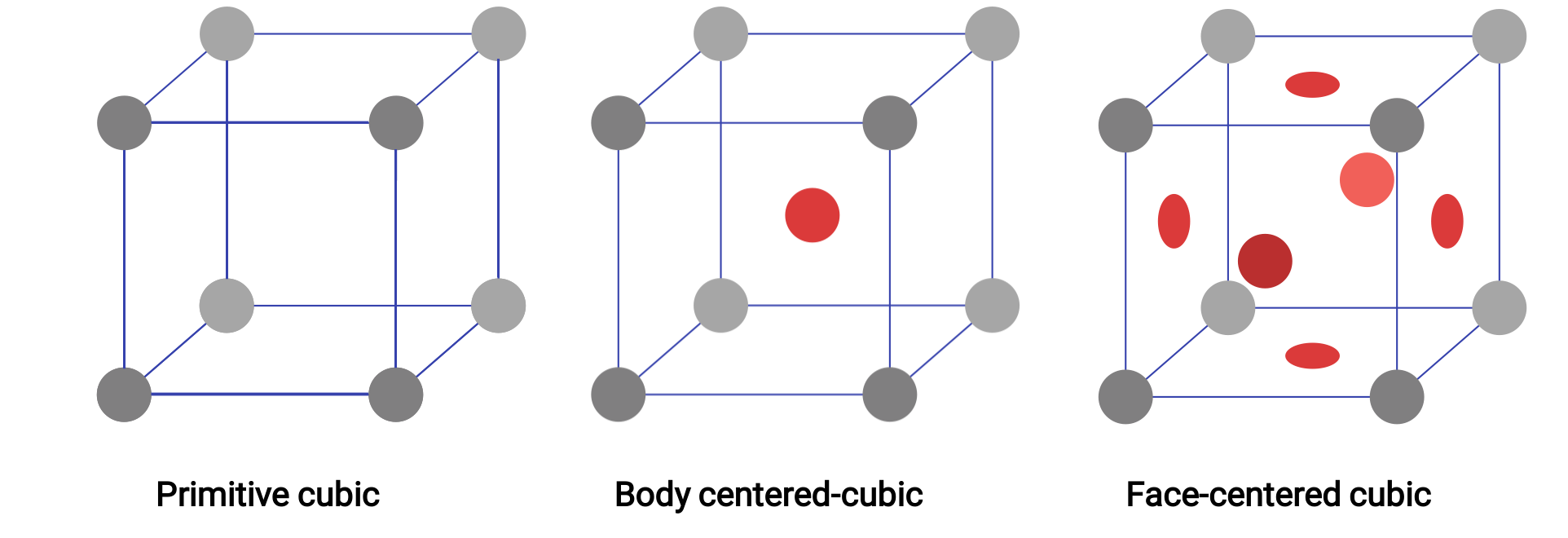
Figura 1. Tre diverse strutture reticolari cristalline esposte dai sistemi a reticolo cubico.
In un reticolo cubico primitivo, la cella unitaria che si ripete in tutte le direzioni è un cubo definito dai centri di otto atomi. Gli atomi agli angoli adiacenti di questa cella unitaria si contattano a vicenda, quindi una cella unitaria cubica contiene solo le parti di questi atomi che sono al suo interno. Poiché un atomo in un angolo di una semplice cella unitaria cubica è contenuto da un totale di otto celle unitarie, solo un ottavo di quell’atomo si trova all’interno di una specifica cella unitaria. E poiché ogni semplice cella unitaria cubica ha un atomo in ciascuno dei suoi otto “angoli”, c’è 8 × 1/8= 1 atomo all’interno di una semplice cella unitaria cubica.
Alcuni metalli cristallizzano in una disposizione che ha una cella unitaria cubica con atomi in tutti gli angoli e un atomo al centro. Questo è chiamato solido cubico centrato sul corpo (BCC). Gli atomi negli angoli di una cella unitaria BCC non si contattano a vicenda ma contattano l’atomo al centro. Una cella unitaria BCC contiene due atomi: un ottavo di atomo in ciascuno degli otto angoli (8 × 1/8= 1 atomo dagli angoli) più un atomo dal centro. Ogni atomo in questa struttura tocca quattro atomi nello strato sopra di esso e quattro atomi nello strato sottostante. Quindi, un atomo in una struttura BCC ha un numero di coordinazione di otto. Gli atomi negli arrangiamenti BCC sono imballati in modo molto più efficiente rispetto a una semplice struttura cubica, occupando circa il 68% del volume totale.
Molti altri metalli cristallizzano in una disposizione che ha una cella unitaria cubica con atomi in tutti gli angoli e al centro di ogni faccia. Questa disposizione è chiamata solido cubico centrato sulla faccia (FCC). Una cella unitaria FCC contiene quattro atomi: un ottavo di atomo in ciascuno degli otto angoli (8 × 1/8= 1 atomo dagli angoli) e una metà di atomo su ciascuna delle sei facce (6 × 1/2= 3 atomi dalle facce). Gli atomi agli angoli toccano gli atomi al centro delle facce adiacenti lungo le diagonali facciali del cubo. Poiché gli atomi si trovano su punti reticolari identici, hanno ambienti identici. Gli atomi in una disposizione FCC sono imballati il più strettamente possibile, con atomi che occupano il 74% del volume. Ogni atomo contatta sei atomi nel proprio strato, tre nello strato sopra, e tre nello strato sottostante. In questa disposizione, ogni atomo tocca 12 vicino ai vicini e quindi ha un numero di coordinazione di 12.
Questo testo è stato adattato da Openstax, Chemistry 2e, Sections 10.5 The Solid State of Mattere 10.6 Lattice Structures in Crystalline Solids.
