20.10:
색과 자성
20.10:
색과 자성
코디네이터 콤플렉스의 색상
원자 나 분자가 적절한 주파수에서 빛을 흡수할 때, 그들의 전자는 고에너지 궤도에 흥분됩니다. 많은 주요 그룹 원자 및 분자의 경우 흡수된 광자는 전자기 스펙트럼의 자외선 범위에 있으며, 이는 인간의 눈에 의해 검출될 수 없다. 조정 화합물의 경우, d 궤도 사이의 에너지 차이는 종종 눈에 의해 색상으로 볼 수있는 가시 범위의 광자를 흡수하고 방출 할 수 있습니다.
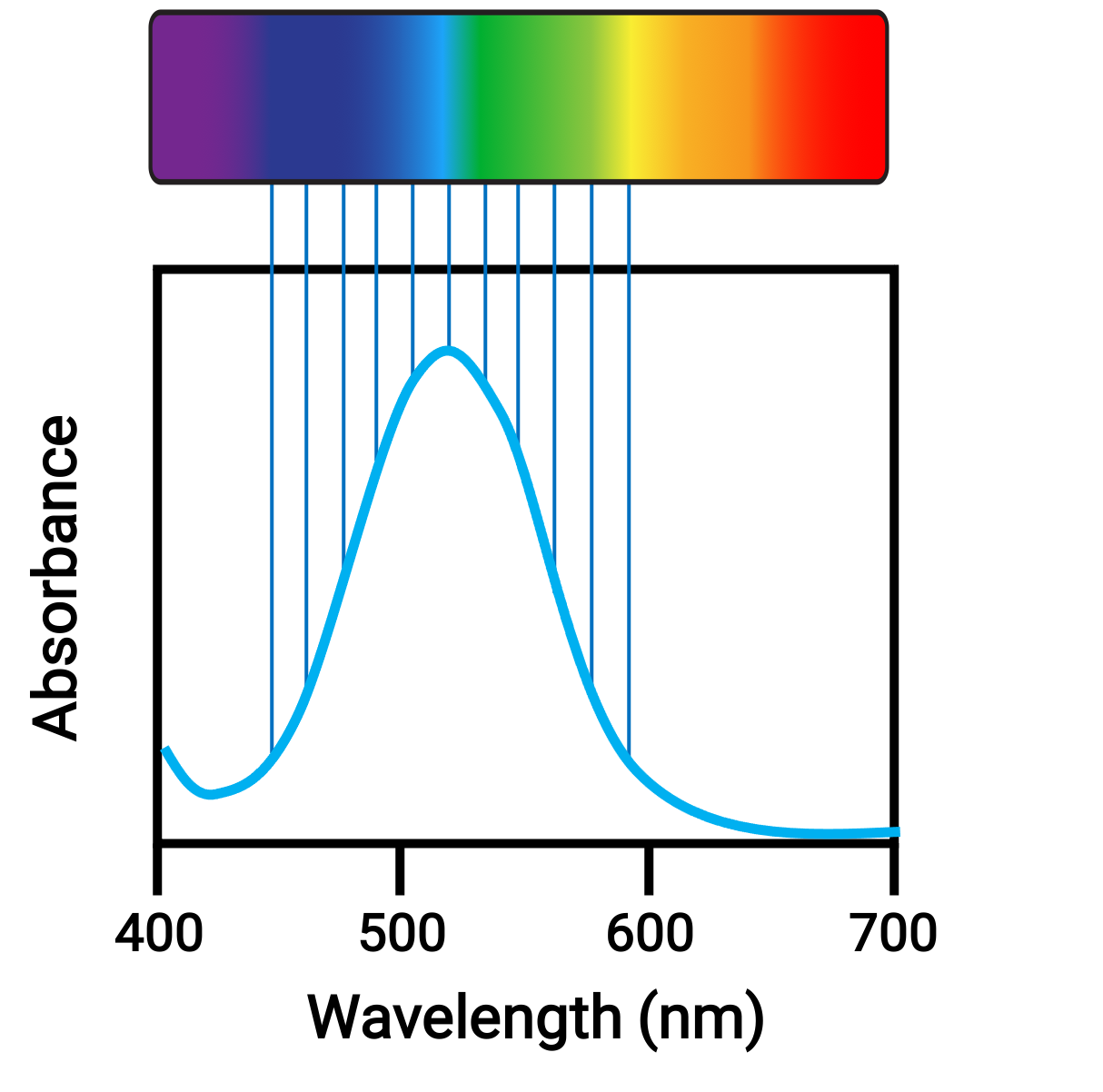
그림 1. 가시광선과 흡광도의 전자기 스펙트럼.
전자가 사이로 전환되는 궤도의 상대적 에너지의 작은 변화는 흡수된 빛의 색의 급격한 변화로 이어질 수 있다. 따라서 조정 화합물의 색상은 다음과 같은 여러 가지 요인에 따라 달라집니다.
• 다른 수성 금속 이온은 다른 색상을 가질 수 있습니다.
• 한 금속의 다른 산화 상태는 다른 색상을 생성 할 수 있습니다.
• 금속 센터에 조정된 특정 리간드는 조정 복합체의 색상에 영향을 미칩니다. 예를 들어, 철(II) 복합체 [Fe(H2O)6]SO4는 고스핀 복합체가 붉은 파장에서 광자를 흡수하기 때문에 청록색으로 나타납니다. 대조적으로, 저스핀 아이언(II) 복합체 K4[Fe(CN)6]은고에너지 바이올렛 광자를 흡수하기 때문에 옅은 노란색으로 나타납니다.
일반적으로, 강한 필드 리간드는 중앙 금속 원자(대형 Δ)의 d 궤도 에너지에서 큰 분열을 일으킨다. 이 리간드를 가진 전이 금속 조정 화합물은 고에너지 바이올렛 또는 청색광을 흡수하기 때문에 노란색, 주황색 또는 빨간색입니다.
반면에, 약한 필드 리간드가 있는 전이 금속의 협응 화합물은 종종 낮은 에너지노란색, 주황색 또는 붉은 빛을 흡수하기 때문에 청록색, 파란색 또는 인디고입니다. d 궤도를 분할하는 리간드의 강도는 분광화학 시리즈에나열됩니다. 여기서 리간드는 결정필드 분할 에너지(Δ)의 증가값으로 기록된다.

그림 2. 분광화학 시리즈.
예를 들어, Cu+ 이온의 조정 화합물은 d10 구성을 가지며 모든 eg궤도가 채워집니다. 전자를4p 궤도와 같은 더 높은 수준으로 자극하려면 매우 높은 에너지의 광자가 필요합니다. 이 에너지는 스펙트럼의 자외선 영역에서 매우 짧은 파장에 해당합니다. 눈에 보이는 빛이 흡수되지 않으므로 눈은 변하지 않으며 화합물은 흰색 또는 무색으로 나타납니다. [Cu(CN)2]–예를 들어 무색을 함유하는 솔루션입니다. 한편, 옥타히드랄 Cu2+ 복합체는 eg 궤도에 공석이 있으며 전자는 이 수준으로 흥분될 수 있다. 흡수된 빛의 파장(energy)은 스펙트럼의 눈에 보이는 부분에 해당하며 Cu2+ 복합체는 거의 항상 파란색, 파란색-녹색 바이올렛 또는 노란색으로 지정됩니다.
조정 단지의 자성
자기 측정의 실험 증거는 고스핀 및 저스핀 복합체의 이론을 뒷받침합니다. 짝을 이루지 않은 전자를 포함하는 O2와 같은 분자는 파라자성입니다. 파라마그네틱 물질은 자기장에 끌린다. 많은 전이 금속 복합체는 페어링되지 않은 전자를 가지고 있으며, 따라서 파라자성입니다. N2와 Na+ 및 [Fe (CN)6]4−와 같은 분자는 짝을 이루지 않은 전자를 포함하지 않는 자가성입니다. 다이자기 물질은 자기장에 의해 격퇴되는 약간의 경향이 있다.
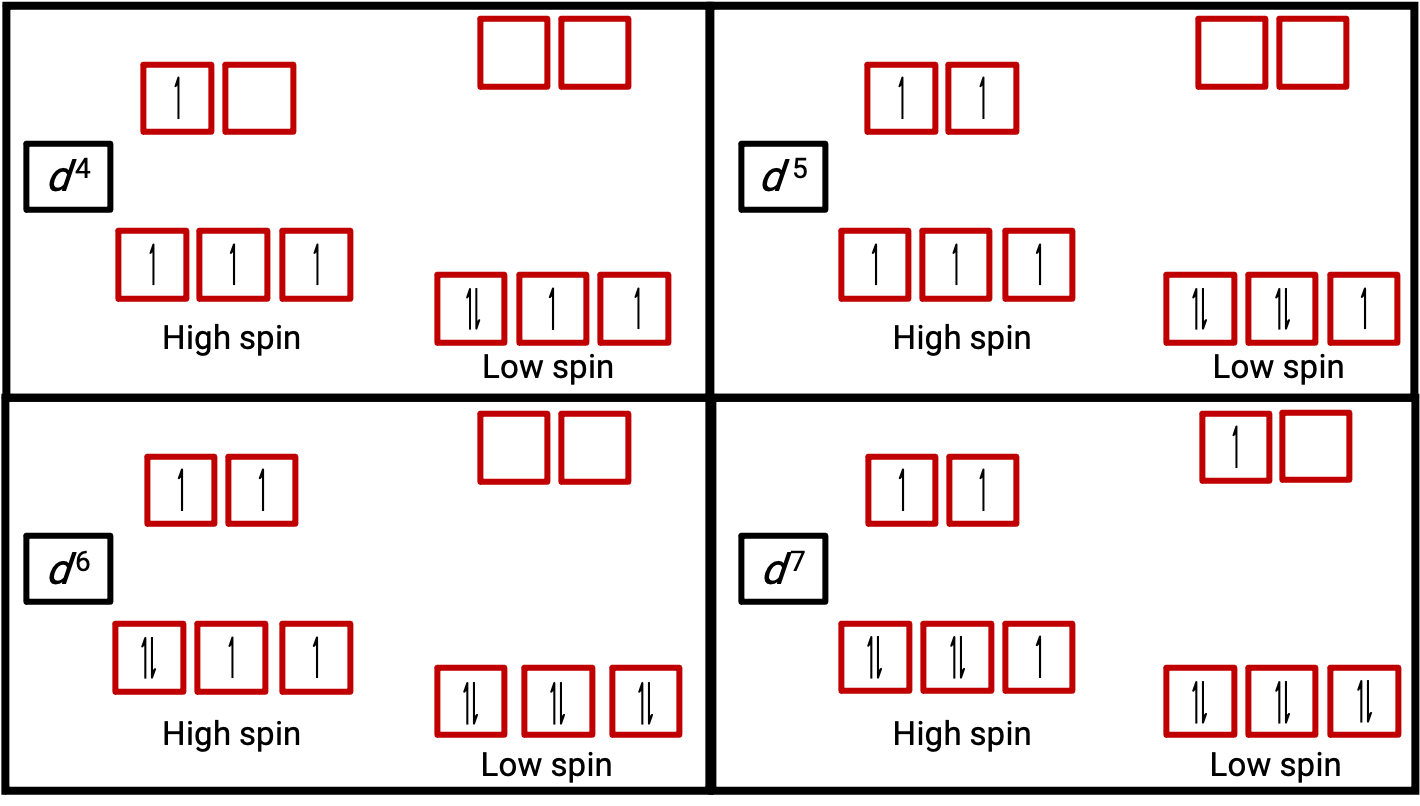
그림 3. d4,d5, d6 및 d 7 시스템에 대한 높고 낮은 스핀 상태에서 옥타히드랄 복합체의 궤도 다이어그램. 이 구별은 d 1, d2, d3, d5, d8,d9 및 d10 시스템에 대해 만들 수 없습니다.
원자 또는 이온의 전자가 페어링되지 않은 경우 스핀으로 인한 자기 모멘트로 전체 원자 또는 이온 파라자기가 됩니다. 페어링되지 않은 전자를 포함하는 시스템의 자기 모멘트 크기는 이러한 전자의 수와 직접적으로 관련이 있습니다: 페어링되지 않은 전자의 수가 클수록 자기 모멘이 커진다. 따라서 관찰된 자기 모멘트에서는 페어링되지 않은 전자의 수를 결정하는 데 사용된다. 저스핀 d6 [Fe(CN)6]4−의 측정 된 자기 모멘트는 철이 diamagnetic임을 확인하는 반면, 하이 스핀 d6 [Fe (H2O)6]2 +는이 배열을 확인하는 자기 모멘트로 4 개의 미페어링 전자를 가지고 있습니다 (그림 2).
