4.4:
ثابت الاتزان و قوة الترابط
4.4:
ثابت الاتزان و قوة الترابط
يحدد ثابت ربط التوازن (Kb) قوة تفاعل البروتين الرابط. Kb يمكن حسابه على النحو التالي عندما يكون التفاعل في حالة توازن:
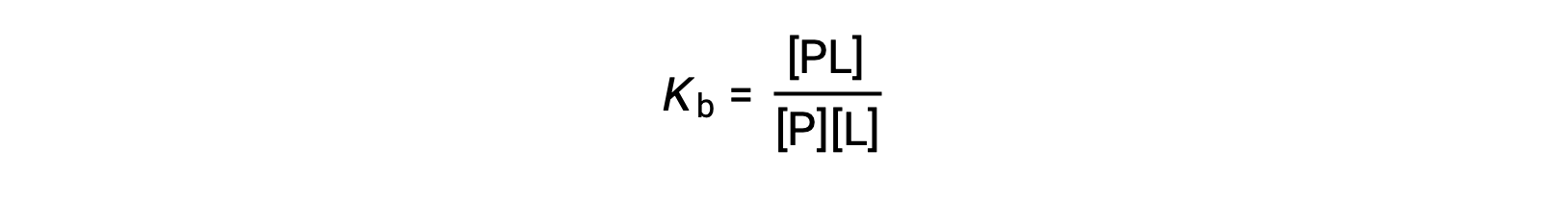
حيث أن P و L هما البروتين غير المرتبط و الرابطة، على التوالي، و PL هو مركب بروتين-رابطة.
نظراً لأن كمية الترابط المرتبط أيضاً مرتبطة بمعدل الارتباط بالرابط، يمكن للتجارب أيضاً تحديد Kb من خلال فحص معدلات ارتباط البروتين الرابط (kon) والتفكك (koff) باستخدام النسبة التالية:
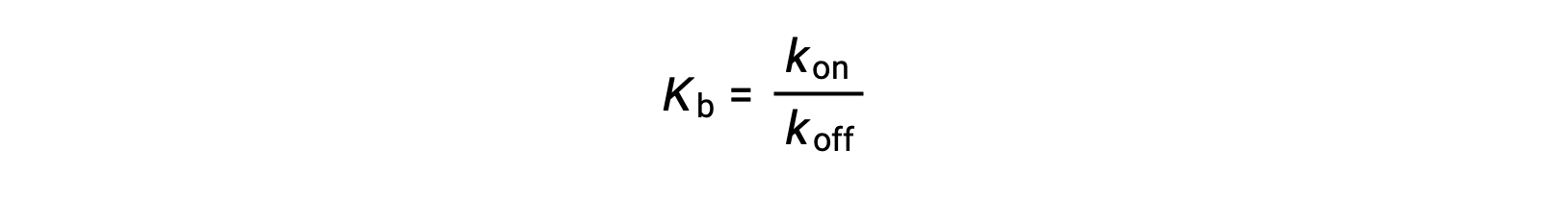
وهكذا، فئتان من  ؛ تُستخدم فحوصات الربط لتحديد ثابت ربط التوازن –؛ تلك التي تقيس تركيزات التوازن وتلك التي تقيس حركية التفاعل. في حالة ما، يجب أن يكون التفاعل في حالة توازن في وقت القياس.
تعتمد طريقة تحديد تركيزات التوازن على الحساسية المرغوبة وسهولة اكتشاف الإشارة. لهذه الأسباب، يتم استخدام المقايسات الطيفية على نطاق واسع. في هذه التجارب، ينتج التفاعل تغيرًا في امتصاص مادة متفاعلة أو منتج عند طول موجة معين، يمكن اكتشافه بواسطة مقياس الطيف الضوئي بالأشعة المرئية وفوق البنفسجية. وبدلاً من ذلك، يمكن وسم المادة المتفاعلة أو المنتج بمسبار فلوري أو قد يحتوي على حامل فلور جوهري. بعد ذلك، يمكن قياس تقدم التفاعل من التغير في التألق. يتم إجراء هذه الاختبارات عن طريق تغيير تركيزات متفاعل واحد بينما تبقى بقية التجربة ثابتة. يمكن بعد ذلك رسم النتائج وتحليلها باستخدام طرق مختلفة لتناسب المنحنيات.
تتم أيضاً دراسة التفاعلات بين البروتينات والروابط باستخدام مجموعة متنوعة من التقنيات البيوكيميائية والطيفية. يساعد التحليل الهيكلي، باستخدام علم البلورات بالأشعة السينية والتحليل الطيفي للرنين المغناطيسي النووي، في التنبؤ بتفاعلات البروتين – الرابطة من خلال المحاكاة الجزيئية. تُستخدم المناهج النظرية والحاسوبية، مثل دراسات الالتحام بالبروتين، على نطاق واسع لتوصيف موضع وتفاعلات روابط الجزيئات الصغيرة، بما في ذلك الأدوية المرشحة. يُعد تصميم الأدوية بمساعدة الكمبيوتر بديلاً سريعاً ومنخفض التكلفة لتسريع وتيرة التجارب التقليدية واختبار العقاقير الخاطئة.
Suggested Reading
- Pollard, Thomas D. "A guide to simple and informative binding assays." Molecular biology of the cell 21, no. 23 (2010): 4061-4067.
- Hulme, Edward C., and Mike A. Trevethick. "Ligand binding assays at equilibrium: validation and interpretation." British journal of pharmacology 161, no. 6 (2010): 1219-1237.
- Medina-Franco, José L., Oscar Méndez-Lucio, and Karina Martinez-Mayorga. "The interplay between molecular modeling and chemoinformatics to characterize protein–ligand and protein–protein interactions landscapes for drug discovery." In Advances in protein chemistry and structural biology, vol. 96, pp. 1-37. Academic Press, 2014.
