تقنيات التصوير كاليفورنيا 2 + في اشارة الى الحيوانات المنوية البشرية
Summary
التحفيز أثار [CA<sup> 2 +</sup> يتم تقييم] ط اشارات الحيوانات المنوية الإنسان الفردية. يتم تحميل خلايا متحركة مع CA<sup> 2 +</sup> حساسة صبغة الفلورسنت (AM – استر الأسلوب) وثبتوا في غرفة perfusable. يتم تصوير الخلايا الوقت الفاصل بين المجهري مضان وحفزت عبر المتوسط perfusing. ويتم تحليل استجابات الخلايا واحد (أو مناطق) حاليا باستخدام اكسل.
Abstract
مضان المجهري للخلايا محملة الفلورسنت ، كاليفورنيا<sup> 2 +</supيستخدم> الأصباغ حساسة لقياس الجوانب المكانية والزمانية للكا<sup> 2 +</sup> الإشارات في الخلايا الحية. نحن هنا وصف الطريقة المستخدمة في مختبراتنا لتحميل تعليق الحيوانات المنوية البشرية مع CA<sup> 2 +</sup> الإبلاغ عن الأصباغ وقياس إشارة مضان خلال التحفيز الفسيولوجية. يتم عزل الخلايا متحركة بنسبة تصل السباحة مباشرة والمحتضنة في ظل ظروف لتقوية قدرات 0-24 ساعة ، وهذا يتوقف على التجربة. الخلوي نفيذ AM النموذج استر (acetoxy الميثيل استر) من كاليفورنيا<sup> 2 +</supثم يضاف> الإبلاغ عن صبغ لقسامة الخلية وفترة من 1 ح يسمح للتحميل من صبغة في السيتوبلازم. نستخدم الأصباغ مرئية الطول الموجي للتقليل من الصور الأضرار التي لحقت الخلايا ، ولكن هذا يعني أن تسجيل ratiometric غير ممكن. وتناقش مزايا وعيوب هذا النهج. خلال فترة التحميل الخلايا يتم تقديمها الى غرفة التصوير ، وسمح للانضمام إلى ساترة بولي – D – يسين المغلفة. في نهاية الفترة الصبغة الفائضة التحميل وفضفاضة تتم إزالة الخلايا عن طريق الاتصال من الغرفة إلى جهاز نضح. هو perfused الغرفة باستمرار ، ثم تضاف محفزات وملاحات المعدلة إلى رأس الارواء. التجارب التي تسجل مرور الزمن اقتناء الصور وتحليلها في مضان حاليا من التفصيل ، عن طريق رسم يدويا مناطق الفائدة. تم تطبيع البيانات إلى ما قبل مستويات التحفيز مثل ذلك ، كل خلية (أو جزء من خلية) ، رسم بياني يبين كاليفورنيا<sup> 2 +</supيتم الحصول على> ردا على نسبة التغير في مضان.
Protocol
Discussion
عندما نفذت بنجاح ، وهذا الأسلوب يسمح بتسجيل توزيع وحركية والعفوية التي يسببها الاشارات + كا 2 في الحيوانات المنوية البشرية. ويمكن الحصول على ردود من عدد كبير من الخلايا (حتى 200) وهو أمر مهم لأن الحيوانات المنوية البشرية يمكن أن تظهر الكثير من التباين في إشاراتها العفوية وحفز + كا 2. العلامات الناجحة وبقاء خلايا أثناء التسجيل تعتمد اعتمادا كبيرا على نوعية العينة. عينات الفقراء تعطي العلامات الفقراء ، والاستجابات الفقراء والخلايا قد يموت أثناء التسجيل.
الحيوانات المنوية البشرية حساسة جدا للضرر الصورة ونحن بالتالي استخدام الحد الأدنى من الإضاءة اللازمة (حيث شدتها وزمن التعرض) من أجل تعظيم بقاء الخلية وتقليل الآثار بسبب وفاة الخلية. كاميرا عالية الحساسية (السماح باستخدام الإضاءة المنخفضة الحدة) هو مكسب كبير منذ سوف تلتقط الكاميرا مضان ضعيفة. الخلفية المضاءة ، EM – CCD الكاميرات بشكل خاص مناسبة تماما ، وإن كان مكلفا للغاية. إنارة LED (بدلا من استخدام الزئبق مصباح زينون أو مع مرشح الإثارة يحسن أيضا بقاء الخلية (Nishigaki وآخرون ، 2006).
نحن لا نستخدم Fura – 2 ، على الرغم من مزايا واضحة لنسبة متري ، والتصوير ، ولأن Fura يتطلب إثارة للأشعة فوق البنفسجية ، ولأنه من الضروري اتخاذ صورتين لكل نسبة. بالنسبة للبيانات التي تم الحصول عليها مع طول موجي واحد ، والأصباغ الضوء المرئي ، وتطبيع كثافة مضان يعوض إلى حد كبير عن الفرق في تحميل صبغ بين الخلايا ، ولكن ليس للتوزيع الصبغة داخل خلية واحدة ، ويجب أن يؤخذ هذا في الاعتبار. وإن كان يمكن ، والأصباغ الطول الموجي واحد من حيث المبدأ ، يجب معايرة ، ودقة الأسلوب ونحن الفقراء لا تحاول القيام بذلك.
في حين أن البيانات التي تم الحصول عليها مع نسبة Fura – 2 (أو انبعاث نسبة الصبغة الهندية) ، حتى من دون المعايرة ، وإعطاء تمثيل المؤمنين مقبول من التغيرات النسبية في [كا 2 +] ط ، كثافة مضان من الأصباغ طول موجي واحد بعيد عن خطي المتصلة [كا 2 +] ط على الجزء الأكثر فائدة من منحنى العلاقة لتشبع الأصباغ طول موجي واحد يقترب عادة لوغاريتمي. نستخدم حاليا أوريغون الخضراء BAPTA – 1 (الشكل 4) لأنها حساسة للتغيرات صغيرة في [كا 2 +] ط قريبة من مستوى الراحة ليالي (50-100 نانومتر). عندما [كا 2 +] يرتفع فوق ط 1 ميكرومتر الردود ستكون ممثلة تمثيلا ناقصا من حيث التغير مضان وصبغ قد تشبع. خيار لتحسين هذه التقنية دون اللجوء إلى الإثارة الأشعة فوق البنفسجية هو مضاعفة الخلايا مع صبغة تحميل مثل Fluo – 3 و الحمراء Fura. يمكن متحمس سواء في 488 نانومتر ولكن في نفس الوقت من ردود مختلفة جدا. تسجيل الانبعاثات في 540 و 650 نانومتر يوفر النسبة التي يمكن أن توفر أفضل طريقة لمراقبة دقيقة من [كا 2 +] ط (Haughland ، 2002) ويمكن أن تنطبق على الحيوانات المنوية (Nisigaki وآخرون ، 2006).
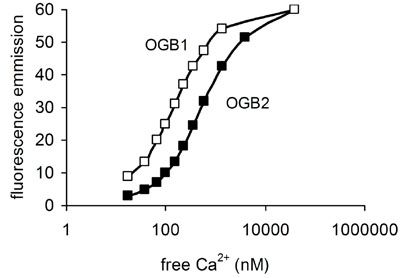
الشكل 4. العلاقة بين حرة [كا 2 +] (نانومتر) وانبعاث مضان في ذروة الموجة (حوالي 525 نانومتر) لجرين ولاية أوريغون BAPTA – 1 وأوريغون الخضراء BAPTA – 2. OGB1 يعطي أعلى مضان يستريح في [كا 2 +] ولكن التشبع في المستويات الأدنى ، وبالتالي لديه مجموعة صغيرة صالحة للاستخدام. تم الحصول على بيانات عن هذه المؤامرات من كتيب المسابر الجزيئية (Haughland ، 2002).
Disclosures
The authors have nothing to disclose.
Acknowledgements
ويتم تمويل هذا العمل من قبل ويلكوم ترست ، ومجلس البحوث الطبية ، والجمعية الملكية ، وبرمنغهام سيتي والعلوم والبحوث الاستئماني العقم. نود أن نعترف مساعدة الخبراء للبحوث العلامة في بناء وتكامل وحدات التصوير.
Materials
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Low light level Camera | QImaging | Rolera XR | ||
| Oregon Green BAPTA-1 | Invitrogen | 06807 | ||
| Imaging Software | Andor | IQ | ||
| Imaging Software | National Institues of Health | Image J | Public domain software | |
| LED illumination system | Cairn Research | Opto LED | ||
| Pluronic F-127 (20% solution in DMSO) | Invitrogen | P3000MP |
References
- Haughland, R. P. . Handbook of Fluorescent Probes and Research Products. , (2002).
- Nishigaki, T., Wood, C. D., Shiba, K., Baba, S. A., Darszon, A. Stroboscopic illumination using light-emitting diodes reduces phototoxicity in fluorescence cell imaging. Biotechniques. 41, 191-197 (2006).

