Bio-energetische Profiel Experiment met behulp van C2C12 myoblast Cellen
Summary
Een beschrijving van een methode voor het profileren van mitochondriale functie in cellen wordt verzorgd. De gegenereerde mitochondriale profiel biedt vier parameters van mitochondriële functie die kan worden gemeten in een experiment: basale ademhaling, ATP-linked ademhaling, proton lek, en reservecapaciteit.
Abstract
De mogelijkheid om cellulaire stofwisseling te meten en te begrijpen mitochondriale dysfunctie, heeft het mogelijk gemaakt wetenschappers wereldwijd om hun onderzoek te bevorderen in het begrijpen van de rol van de mitochondriale functie in obesitas, diabetes, veroudering, kanker, cardiovasculaire functie en veiligheid van toxiciteit.
Cellulair metabolisme is het proces van het substraat opname, zoals zuurstof, glucose, vetzuren en glutamine, en de daaropvolgende omzetting van energie door middel van een serie van enzymatisch gecontroleerde oxidatie en reductie reacties. Deze intracellulaire biochemische reacties resulteren in de productie van ATP, de vrijlating van warmte-en chemische bijproducten, zoals lactaat en CO 2 in het extracellulaire milieu.
Waardevol inzicht in de fysiologische toestand van de cellen, en de wijziging van de toestand van die cellen, kan worden verkregen door middel van het meten van de snelheid van zuurstof wordt verbruikt door de cellen, een indicator van de mitochondriale ademhaling – het zuurstofverbruik Rate – of OCR. Cellen ook het genereren van ATP via glycolyse, dat wil zeggen: de omzetting van glucose naar lactaat, onafhankelijk van zuurstof. In gekweekte putten, lactaat is de primaire bron van protonen. Het meten van de melkzuur indirect geproduceerd via protonen vrijkomen in het extracellulaire medium rondom de cellen, waardoor verzuring van het medium zorgt voor de extra-cellulaire Verzuring Rate – of ECAR.
In dit experiment worden C2C12 myoblast cellen gezaaid bij een bepaalde dichtheid in Seahorse celkweek platen. De basale zuurstofverbruik (OCR) en extracellulaire verzuring (ECAR) tarieven zijn gemeten met de uitgangswaarde tarieven vast te stellen. De cellen worden vervolgens metabolisch verstoord door drie toevoegingen van verschillende verbindingen (achter elkaar) dat de bio-energetische profiel van de cel shift.
Deze test is afgeleid van een klassiek experiment om te beoordelen mitochondriën en fungeert als een raamwerk waarmee meer complexe experimenten gericht op het begrijpen zowel fysiologische en pathofysiologische functie van de mitochondriën te bouwen en het vermogen van cellen om te reageren op stress en / of beledigingen voorspellen.
Protocol
Discussion
Deze test is afgeleid van de klassieke experiment om mitochondriale functie sonde en dient als een raamwerk waarmee meer complexe experimenten gericht op het begrijpen diverse veranderingen in het celmetabolisme, de mitochondriale functie, en de algehele bio-energetica te bouwen.
Alle verbindingen die in dit experiment moet worden geoptimaliseerd voor de concentratie die het maximale effect geeft. Dat wil zeggen, men moet apart titratie-experimenten uit te voeren om deze waarden vast te stellen. Dit is vooral belangrijk met FCCP, zoals de titratiecurve de neiging om heel scherp, en te veel FCCP daadwerkelijk kan de reacties verminderen in OCR. Typische reeksen (eindconcentraties) om te testen zou zijn:
- 0,1 tot 1,0 ug / ml Oligomycin
- 0,1 tot 5,0 uM FCCP
- 0,1 tot 1,0 uM Rotenon
Merk op dat de antwoorden op elke verbinding hierboven (in het bijzonder FCCP) zal worden beïnvloed door de test media samenstelling (basistype, [glucose], [pyruvaat], de aanwezigheid / afwezigheid van BSA, enz.). Verder, als de XF test media samenstelling is veranderd, zal optimalisatie moeten opnieuw worden uitgevoerd. De aanwezigheid en concentratie van pyruvaat is vooral van belang bij het verkrijgen van de maximale respiratoire capaciteit als gevolg van FCCP. Zeepaardje Bioscience heeft waargenomen in een aantal cellen lijnen die omissie van pyruvaat het vermogen van cellen om maximaal te reageren (zie boven baseline) te FCCP schaft. Normaal gesproken, moet de concentratie van 1-10 mM pyruvaat worden getest om de optimale concentratie van pyruvaat te begrijpen maximale ademhaling te verkrijgen. Merk op dat [pyruvaat] EN [glucose] moet mogelijk worden "cross-getitreerd" om de optimale media voorwaarden voor het experiment te verkrijgen.
Typische resultaten van dit experiment worden hieronder weergegeven in een grafiek met OCR versus tijd en een ander laten zien ECAR vs tijd:
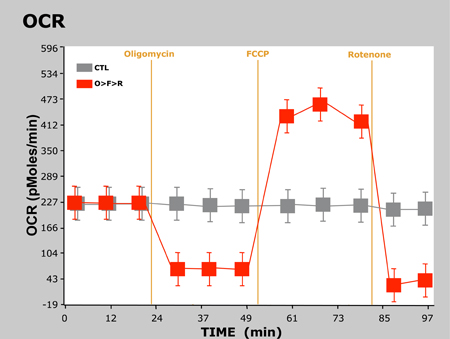
Figuur 2. OCR vs Time
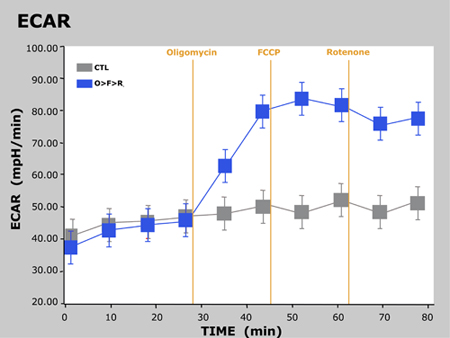
Figuur 3. ECAR vs Time
Hier hebben we de verwachte responsen waargenomen in OCR en ECAR als de cellen worden behandeld met elke opeenvolgende verbinding. Voor oligomycin, OCR afneemt als gevolg van het blokkeren van ATP-synthese op mitochondriale Complex V. Sinds de cellen niet in staat om ATP te synthetiseren via OXPHOS, ze terug te keren naar glycolyse om hun vraag naar ATP te voldoen, dus zien we een toename van de ECAR. Zoals eerder aangegeven, FCCP fungeert als een ontkoppeling agent. Omdat de cellen moet nu overwinnen van de proton lek over het binnenste mitochondriale membraan, OCR aanzienlijk toeneemt naarmate er meer O2 wordt geconsumeerd om terug te pompen het overtollige protonen over het mitochondriale membraan. Tot slot, rotenon remt mitochondriaal Complex I en Complex III, respectievelijk, waardoor de stroom van elektronen te staken in de elektronen transportketen, en daarmee de consumptie van O2 is drastisch verminderd.
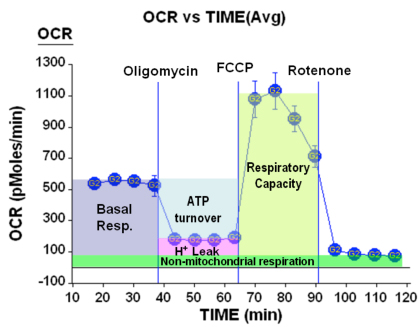
Figuur 4. Ademhaling parameters
Verder dan de verwachte veranderingen in ademhaling en ECAR, kan een aantal respiratoire parameters worden verkregen van deze gegevens. Dit is samengevat in de figuur hierboven:
Hier zien we dat we informatie over de basale ademhaling van de cellen, het percentage van de O2-consumptie gewijd aan de ATP productie evenals het bedrag voor het handhaven van de proton gradiënt (ten gevolge van H + lekken) te verkrijgen. Verder kunnen we de maximale ademhaling te verkrijgen onder de voorwaarden van het afgekoppelde ademhaling (soms aangeduid als reserve-respiratoire capaciteit) en tot slot, kunnen we de hoeveelheid O2-verbruik niet te wijten aan mitochondriale processen bepalen.
Een snel groeiend aantal studies zijn dienst dit mitochondriale profiel om cellulaire bio-energetica beoordelen, mitochondriale disfunctie te identificeren en om het vermogen van cellen om te reageren op stress en / of beledigingen voorspellen. Voor meer informatie en details over deze experimentele methode en het idee van de vrije ademhaling capaciteit, zie verwezen naar de volgende publicaties 1-8.
Disclosures
The authors have nothing to disclose.
Materials
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Oligomycin, FCCP, Rotenone and Antimycin A Solutions | Seahorse Bioscience | Seahorse Mito Stress Test Kit | ||
| DMEM Running Media | Seahorse Bioscience | 100965-000 | ||
| DMSO | Sigma | D8418 | ||
| Distilled Water | Gibco | 15230-170 | ||
| Calibration buffer | Seahorse Bioscience |
References
- Choi, W. S., Gerencser, A. A., Nicholls, D. G. Bioenergetic analysis of isolated cerebrocortical nerve terminals on a microgram scale: spare respiratory capacity and stochastic mitochondrial failure. J Neurochem. 109, 1179-1191 (2009).
- Hill, B. G., Dranka, B. P., Zou, L., Chatham, J. C., Darley-Usmar, V. Importance of the bioenergetic reserve capacity in response to cardiomyocyte stress induced by 4-hydroxynonenal. Biochem J. 424, 99-107 (2009).
- Liu, J., Cao, L., Chen, J., Song, S., Lee, I. H., Quijano, C., Liu, H., Keyvanfar, K., Chen, H. Bmi1 regulates mitochondrial function and the DNA damage response pathway. Nature. , 459-7245 (2009).
- Malmgren, S., Nicholls, D. G., Taneera, J., Bacos, K., Koeck, T., Tamaddon, A., Wibom, R., Groop, L., Ling, C., Mulder, H., Sharoyko, V. V. Tight coupling between glucose and mitochondrial metabolism in clonal beta-cells is required for robust insulin secretion. J Biol Chem. 284, 32395-32404 (2009).
- Dranka, B. P., Hill, B. G., Darley-Usmar, V. M. Mitochondrial reserve capacity in endothelial cells: The impact of nitric oxide and reactive oxygen species. Free Radic Biol Med. 48, 905-914 (2010).
- Perez, J., Hill, B. G., Benavides, G. A., Dranka, B. P., Darley-Usmar, V. M. Role of cellular bioenergetics in smooth muscle cell proliferation induced by platelet-derived growth factor. Biochem J. 428, 255-267 (2010).
- Morán, M., Rivera, H., Sánchez-Aragó, M., Blázquez, A., Merinero, B., Ugalde, C., Arenas, J., Cuezva, J. M., Martín, M. A. Mitochondrial bioenergetics and dynamics interplay in complex I-deficient fibroblasts. Biochim Biophys Acta. , 1802-185 (2010).
- Cárdenas, C., Miller, R. A., Smith, I., Bui, T., Molgó, J. Essential regulation of cell bioenergetics by constitutive InsP3 receptor Ca2+ transfer to mitochondria. Cell. , 142-142 (2010).

