Bioenergetiska Profil experiment med C2C12 Myoblast celler
Summary
En beskrivning av en metod för profilering mitokondriernas funktion i cellerna finns. Den mitokondriella profil genereras innehåller fyra parametrar av mitokondriell funktion som kan mätas i ett experiment: basal andningsfrekvens, ATP-linked andning, proton läcka, och reservkapacitet.
Abstract
Förmågan att mäta cellulär metabolism och förstå mitokondriell dysfunktion, har gjort det möjligt forskare över hela världen att avancera sin forskning för att förstå rollen av mitokondriell funktion i fetma, diabetes, åldrande, cancer, hjärt-funktion och säkerhet toxicitet.
Cellulär metabolism är den process av substrat upptag, såsom syre, glukos, fettsyror och glutamin, och efterföljande energiomvandling genom en serie av enzymatiskt kontrollerad oxidation och reaktioner minskning. Dessa intracellulära biokemiska reaktioner leder till produktionen av ATP, frigörande av värme och kemiska biprodukter, som t.ex. laktat och CO 2 i den extracellulära miljön.
Värdefull inblick i fysiologiska tillstånd av celler, och ändring av tillståndet för dessa celler, kan uppnås genom att mäta graden av syre som förbrukas av celler, en indikator på mitokondrie-andning – syreförbrukningen Rate – eller OCR. Celler genererar också ATP via glykolysen, dvs omvandlingen av glukos till laktat, oberoende av syre. I odlade brunnar är laktat den primära källan för protoner. Mätning av mjölksyra produceras indirekt via protoner ut i den extracellulära mediet som omger cellerna, som orsakar försurning av mediet ger den extracellulära Försurning Rate – eller ECAR.
I detta experiment är C2C12 myoblast celler seedade vid en viss täthet i kultur Seahorse plattorna. Den basala syreupptagningsförmågan (OCR) och extracellulära försurning (ECAR) räntorna mäts för att fastställa baslinjen priser. Cellerna är sedan metaboliskt oroas av tre tillsatser av olika föreningar (i följd) att flytta bioenergetiska profil cellen.
Denna analys kommer från ett klassiskt experiment för att bedöma mitokondrierna och fungerar som en ram som man kan bygga mer komplexa experiment syftar till att förstå både fysiologiska och patofysiologiska mitokondriernas funktion och att förutsäga cellernas förmåga att reagera på stress och / eller förolämpningar.
Protocol
Discussion
Denna analys kommer från det klassiskt experiment för att undersöka mitokondriell funktion och fungerar som en ram som man kan bygga mer komplexa experiment syftar till att förstå olika förändringar i cellernas ämnesomsättning, mitokondriell funktion och övergripande bioenergetik.
Alla föreningar som används i detta experiment bör vara optimerad för den koncentration som ger maximal effekt. Det är, man måste utföra separata titrering experiment för att fastställa dessa värden. Detta är särskilt viktigt med FCCP eftersom titrerkurvan brukar vara ganska vass, och för mycket FCCP kan faktiskt minska reaktioner i OCR. Typiska intervall (slutkoncentrationer) för att testa skulle vara:
- Från 0,1 till 1,0 ug / mL oligomycinkänslig
- Från 0,1 till 5,0 um FCCP
- Från 0,1 till 1,0 um Rotenon
Observera att svar på varje förening ovan (speciellt FCCP) kommer att påverkas av analysen media sammansättning (bas typ, [glukos], [pyruvat], närvaro / frånvaro av BSA, etc). Vidare, om den XF-analysen media sammansättning ändras, kommer optimeringen måste åter utföras. Närvaron och koncentrationen av pyruvat är särskilt viktigt att få maximal andnings kapacitet på grund av FCCP. Seahorse Bioscience har observerats i ett antal celler linjer som utelämnandet av pyruvat upphäver cellernas förmåga att reagera maximalt (utgångsläget) till FCCP. Normalt bör koncentrationer av 1-10 mm pyruvat testas för att förstå den optimala koncentrationen av pyruvat att få maximal andning. Observera att [pyruvat] OCH [glukos] kan behöva "cross-titreras" för att få den optimala media förutsättningarna för experimentet.
Typiska resultat av detta experiment presenteras nedan i ett diagram som visar OCR-tid och en annan visar ECAR vs tid:
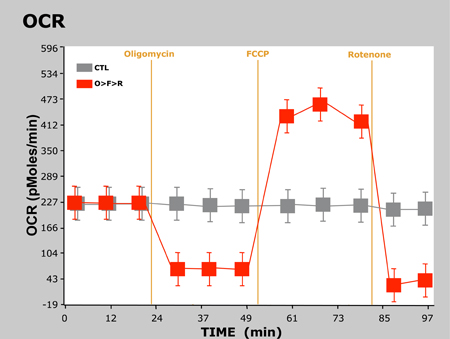
Figur 2. OCR-tid-
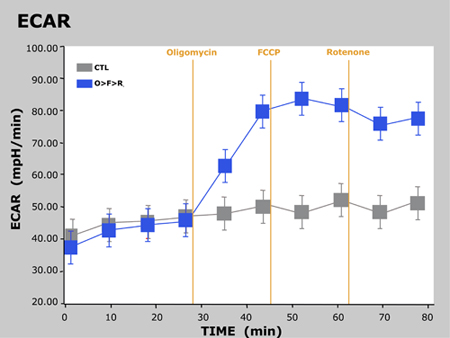
Figur 3. ECAR vs tid
Här har vi observerade den förväntade svar i OCR och ECAR eftersom celler behandlas med varje förening. För oligomycinkänslig minskar OCR som en följd av att blockera syntes av ATP i mitokondrie-Complex V. Eftersom cellerna inte kan syntetisera ATP via OXPHOS, de återgå till glykolys att möta deras krav på ATP, vilket vi ser en ökning av ECAR. Som framgår tidigare, fungerar FCCP som en avkoppling agent. Eftersom cellerna måste nu övervinna proton läcka över det inre mitokondrie membranet ökar OCR avsevärt mer O2 går åt att pumpa överskottet protonerna tillbaka över mitokondriens membran. Slutligen hämmar rotenon mitokondrie Complex I och Complex III, respektive, vilket gör att flödet av elektroner att upphöra i elektron transportkedjan och därmed konsumtionen av O2 minskar drastiskt.
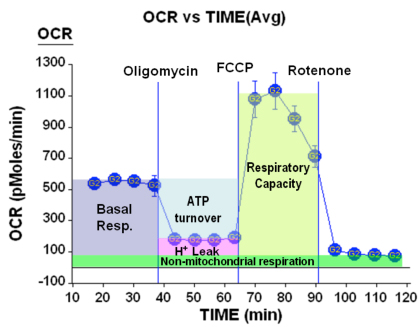
Figur 4. Respiration parametrar
Bortom förväntade förändringar i andning och ECAR, kan ett antal respiratoriska parametrar erhållas från dessa data. Detta sammanfattas i figuren ovan:
Här ser vi att vi kan få information om de basala respiration av celler, procent av O2-förbrukning ägnas till ATP produktion samt anslag till underhåll av proton gradient (på grund av H + läcka). Dessutom kan vi få den maximala andningsfrekvensen under förhållanden med okopplade andning (ibland kallad reserv respiratorisk kapacitet) och slutligen kan vi bestämma mängden O2 konsumtionen inte beror på mitokondriella processer.
En snabbt växande antal studier anställer denna mitokondriella profil för att bedöma cellulära bioenergetik, identifiera mitokondriell dysfunktion och att förutsäga cellernas förmåga att reagera på stress och / eller förolämpningar. För mer information och detaljer om detta experimentella metoden och idén om lediga lungkapacitet, se se följande publikationer 1-8.
Disclosures
The authors have nothing to disclose.
Materials
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Oligomycin, FCCP, Rotenone and Antimycin A Solutions | Seahorse Bioscience | Seahorse Mito Stress Test Kit | ||
| DMEM Running Media | Seahorse Bioscience | 100965-000 | ||
| DMSO | Sigma | D8418 | ||
| Distilled Water | Gibco | 15230-170 | ||
| Calibration buffer | Seahorse Bioscience |
References
- Choi, W. S., Gerencser, A. A., Nicholls, D. G. Bioenergetic analysis of isolated cerebrocortical nerve terminals on a microgram scale: spare respiratory capacity and stochastic mitochondrial failure. J Neurochem. 109, 1179-1191 (2009).
- Hill, B. G., Dranka, B. P., Zou, L., Chatham, J. C., Darley-Usmar, V. Importance of the bioenergetic reserve capacity in response to cardiomyocyte stress induced by 4-hydroxynonenal. Biochem J. 424, 99-107 (2009).
- Liu, J., Cao, L., Chen, J., Song, S., Lee, I. H., Quijano, C., Liu, H., Keyvanfar, K., Chen, H. Bmi1 regulates mitochondrial function and the DNA damage response pathway. Nature. , 459-7245 (2009).
- Malmgren, S., Nicholls, D. G., Taneera, J., Bacos, K., Koeck, T., Tamaddon, A., Wibom, R., Groop, L., Ling, C., Mulder, H., Sharoyko, V. V. Tight coupling between glucose and mitochondrial metabolism in clonal beta-cells is required for robust insulin secretion. J Biol Chem. 284, 32395-32404 (2009).
- Dranka, B. P., Hill, B. G., Darley-Usmar, V. M. Mitochondrial reserve capacity in endothelial cells: The impact of nitric oxide and reactive oxygen species. Free Radic Biol Med. 48, 905-914 (2010).
- Perez, J., Hill, B. G., Benavides, G. A., Dranka, B. P., Darley-Usmar, V. M. Role of cellular bioenergetics in smooth muscle cell proliferation induced by platelet-derived growth factor. Biochem J. 428, 255-267 (2010).
- Morán, M., Rivera, H., Sánchez-Aragó, M., Blázquez, A., Merinero, B., Ugalde, C., Arenas, J., Cuezva, J. M., Martín, M. A. Mitochondrial bioenergetics and dynamics interplay in complex I-deficient fibroblasts. Biochim Biophys Acta. , 1802-185 (2010).
- Cárdenas, C., Miller, R. A., Smith, I., Bui, T., Molgó, J. Essential regulation of cell bioenergetics by constitutive InsP3 receptor Ca2+ transfer to mitochondria. Cell. , 142-142 (2010).

