Produção de Coelhos Knockout apolipoproteína C-III, utilizando zinco Nucleases dedo
Summary
Desenvolvimento recente no gene ferramentas que visam torna a produção de knockout (KO) coelhos possível. No presente trabalho, geramos cinco coelhos apolipoproteína (Apo) C-III KO usando Nucleases dedo de zinco (ZFN). Este trabalho demonstrou que ZFN é um método altamente eficiente para a produção de coelhos KO.
Abstract
A apolipoproteína (apo) C-III (APOCIII) reside na superfície de quilomicron no plasma (CM), lipoproteínas de muito baixa densidade (VLDL) e as lipoproteínas de alta densidade (HDL). Tem sido reconhecido que os elevados níveis de plasma APOCIII factor de risco constitutea para doenças cardiovasculares (DCV). Nível APOCIII plasmáticos elevados, muitas vezes se correlaciona com a resistência à insulina, obesidade e hipertrigliceridemia. Valiosos conhecimentos sobre os papéis de ApoCIIIin metabolismo de lípidos e doenças cardiovasculares tem sido obtido a partir de modelos de ratinhos transgénicos, incluindo knockout (KO) APOCIII, no entanto, é de notar que o metabolismo das lipoproteínas em ratinhos é diferente daquela dos seres humanos em muitos aspectos. Não se sabe até agora se plasma elevado APOCIII é diretamente aterogênica. Nós trabalhamos para desenvolver coelhos APOCIII KO no presente estudo com base na hipótese de que os coelhos podem servir como um reasonablemodelfor estudar o metabolismo lipídico humano e aterosclerose. Coelho dedo de zinco nuclease (ZFN) conjuntos visando ApoCIIIgene foram submetidos a validação in vitro antes da microinjecção de embriões. O mRNA foi injectada para o citoplasma de 35 embriões de coelho fase pronuclear, e avaliadas as taxas de mutação no estado de blastocisto. Dos dezasseis blastocistos que foram testadas, uma taxa satisfatória de 50% mutação (8/16) no sítio de direccionamento foi alcançado, suportando a utilização de um Conjunto para experiências in vivo. Em seguida, microinjeção 145 embriões com Set 1 mRNA, e transferiu esses embriões de coelhos 7 receptores. Depois de 30 dias de gestação, 21 kits nasceram, dos quais cinco foram confirmados como coelhos APOCIII KO após PCR ensaios de sequenciamento. A taxa de animais KO (# kits KO / total de nascidos) foi de 23,8%. A eficiência global de produção é de 3,4% (5 kits/145 embriões transferidos). O presente trabalho demonstrou que ZFN é um método altamente eficiente para a produção de coelhos KO. Estes coelhos APOCIII KO são novos recursos para estudar os papéis de APOCIII no metabolismo de lipídios.
Introduction
A apolipoproteína (apo) C-III (APOCIII) é uma pequena proteína de secreção-O glicosilada que é sintetizada principalmente no fígado e no intestino. Reside na superfície de quilomicron no plasma (CM), lipoproteínas de muito baixa densidade (VLDL) e as lipoproteínas de alta densidade (HDL). APOCIII tem sido reconhecida como um fator de risco para a doença cardiovascular 1. Os pacientes com deficiência hereditária de APOCIII têm baixa de triglicérides plasmáticos (TG) e reduziu aterosclerose coronariana subclínica 2,3. Nível APOCIII elevada no plasma, por outro lado, muitas vezes, se correlaciona com a resistência à insulina, obesidade, hipertrigliceridemia e (HTG) 4,5.
Gene nocaute (KO) é um meio poderoso para estudar a função de um gene. De acordo com as observações em populações mutantes humanos, nocaute do gene APOCIII em camundongos levou a uma redução de plasma TG e proteção contra HTG pós-prandial 6. Esse papel positivo de APOCIII apareceupara ser independente de apolipoproteína E (ApoE), como ratinhos deficientes de ApoE e ambos APOCIII também são protegidos de hiperlipidemia pós-prandial 7. Embora estes modelos APOCIII KO rato forneceram informação valiosa sobre as possíveis funções de APOCIII em seres humanos, é de notar que o metabolismo de colesterol de lipoproteína de ratinhos é diferente daquela dos seres humanos em muitos aspectos. Por exemplo, rato carece de colesterol de proteínas de plasma de transferência de éster (CETP), uma enzima importante envolvida no transporte de VLDL, LDL, HDL e 8. Por conseguinte, é necessário o desenvolvimento de um modelo animal apropriado para entender melhor o papel fisiológico de APOCIII in vivo.
O coelho é um modelo clássico espécies animais 9-11. Ele tem um período de gestação de curta duração (30-31 dias), grande tamanho de leitegada (4-12/litter) e podem ser alojados convenientemente em uma instalação interior. Em comparação com ratos, coelhos são filogeneticamente mais estreita 10 para os seres humanos. Importante, como huhomem, mas ao contrário de ratos, coelhos são mamíferos ricos em LDL e têm níveis substanciais de CETP 10,12. Além disso, eles são susceptíveis a aterosclerose induzida por dieta rica em colesterol com as lesões semelhantes aos observados na aterosclerose humana 13. Por estas razões, temos a hipótese de que os coelhos APOCIII KO pode servir como um modelo melhor do que suas contrapartes do rato para investigar os papéis de ApoCIIIplay no metabolismo lipídico e aterosclerose em humanos.
Produção de gene transgênico alvo (GTT) coelhos tem sido um desafio. Isto é principalmente devido à falta de transmissão da linha germinativa de células-tronco embrionárias (ESC) ea baixíssima eficiência da transferência nuclear de células somáticas (TNCS) em coelhos. ESC é a principal ferramenta para gerar camundongos GTT, enquanto e TNCS tem sido aplicado com sucesso para gerar animais KO em espécies falta CES transmissão germinativas, incluindo suínos, ovinos e bovinos, mas não coelhos. Recentemente Zinc Finger Nuclease (ZFN), Trancrição Activator-Like Effector Nuclease (TALEN) 14, e RNA Endonuclease Guiada (RGEN) 15 surgiu como meios poderosos para edição genoma. Estas nucleases, assim chamados de "tesoura molecular", são eficazes na geração de quebras de cadeia dupla (DSB) no genoma que pode levar a um KO funcional do gene alvo ou utilizadas para integrar uma sequência de ADN num local específico no genoma de um número de espécies de 16. Em 2011, entre os primeiros a adaptação da tecnologia ZFN, geramos peroxisome receptor gama ativado por proliferador (PPAR), as células de suíno KO através desta abordagem e porcos PPAR KO gerados com sucesso depois de usar estas células para TNCS 17. No mesmo ano, a interrupção do gene da imunoglobulina eficiente e substituição alvo em coelhos também usando ZFN foi relatada 18.
No presente estudo, cinco coelhos APOCIII KO foram gerados como foi confirmado por PCR seqüenciamento, utilizando ZFN Set 1 (veja a Figura 1 </strong>. fluxograma para a ilustração). Estes animais são novos recursos para estudar os papéis de APOCIII no metabolismo de lipídios.
Protocol
Representative Results
Discussion
No presente trabalho, cinco coelhos APOCIII KO foram gerados utilizando a tecnologia ZFN. Anteriormente, o único relato de produção de coelhos GTT também usou a tecnologia ZFN 18. O presente trabalho confirmou que ZFN é útil para direcionar efetivamente genes em coelhos.
No presente estudo, a taxa de ratinhos transgénicos (kits positivo / total de nascidos) is23.8% (5/21), o que é comparável ao do relatório anterior ZFN em coelhos (30,8%, 16/52) 18, e os relatados de usar ZFN em outras espécies animais, incluindo peixe zebra 19, 20 camundongos, ratos e porcos 21 17. Esta taxa é de facto mais elevada do que as taxas de produção de muitos estudos coelho transgénico convencionais, que normalmente caem na gama de 5-20%. Por exemplo, num esforço para o produto APOCIII coelhos transgénicos através de microinjecção de ADN convencional, Ding et al. Obtido 3 fundadores positivos de 54 crias recém-nascidas (5,6%) 22.
Consistente com os resultados anteriores, as mutações nos locais alvo são variáveis, incluindo deleções ou inserções consistem número diferente de bases (desde 1-21 em cinco coelhos KO). Com base na informação da sequência específica dos animais fundadores, prevê-se que pelo menos quatro (isto é. Aqueles contendo Δ1, 1, 1, ou Δ20 mutações) que tem perda de função de APOCIII. Animais R-16 com Δ21 poderá não apresentar perda funcional, já que esta mutação está previsto para apenas causar perda de sete aminoácidos, mas não uma mudança de quadro de leitura. Em última análise, ensaios fenótipo são necessários para determinar se esses animais fundadores realmente mostrar a perda de funções APOCIII.
Nenhum dos cinco coelhos KO gerados no presente estudo contêm modificações bialélicos. Curiosamente, este é também o caso no relatório anterior coelho ZFN. Em contraste, quando ZFNs segmentação α1 ,3-galactosiltransferase foram aplicados ao porcoAs células, a frequência de direcionamento de um único alelo variou 7-46%, com cerca de um terço de mutações de um só passo, criando bialélico perfurações 23. Consistente com isto, quando TALEN foi aplicado a células de fibroblastos de porco, as modificações bialélicos foram encontrados em cerca de 15-40% do total de 14 clones positivos. É possível que o fracasso em gerar coelhos KO bialélicos no presente estudo pode indicar uma diferença de espécies (ou seja coelhos contra os porcos) para tal capacidade de gene nuclease baseada segmentação. É, no entanto, mais provável que este é simplesmente porque o número de coelhos KO gerados neste projecto é relativamente pequena. Acreditamos que ZFN é capaz de gerar mutações bialleic em coelhos, que devem ser considerados como uma outra vantagem potencial de produção de coelhos GTT baseado ZFN. São necessários mais estudos para confirmar essa capacidade de ZFN em coelhos.
Em conclusão, o presente trabalho demonstra que a ZGene baseado FN visando abordagem é eficaz na produção de coelhos KO. Em particular, foram geradas cinco coelhos APOCIII KO com uma taxa satisfatória transgénico de 23,8%. Estes animais são acreditados para fornecer informações mais significativas sobre o papel desta proteína no metabolismo lipídico em humanos do que os modelos correspondentes do mouse. Prevemos direccionamento de genes com base ZFN, bem como outras tecnologias de base, tais como nucleases TALEN e RGEN, em animais nonmurine facilitará significativamente o desenvolvimento de novos modelos animais para o estudo de várias doenças humanas.
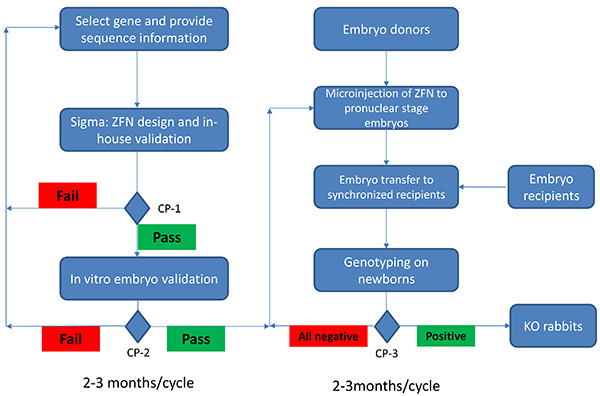
Figura 1. Fluxograma da produção de coelhos knockout utilizando a tecnologia ZFN. A produção de coelhos KO utilizando tecnologia ZFN começa com a selecção do gene de interesse. A informação é fornecida seqüência, conjuntos ZFN são projetados e subjected a levedura baseado validação interna. No ponto de verificação (CP) 1 (CP-1), apenas os conjuntos passaram na casa de validação (50% ou mais do controle interno positivo) será fornecido aos usuários para a seleção. Se nenhum conjunto de passar CP-1, sequência adicional pode ser necessária para a concepção de conjuntos ZFN eficazes. Uma validação embrião in vitro é seguido para assegurar o conjunto ZFN selecionado pode induzir mutações em locais selecionados (CP-2). ZFN conjunto (s) só será utilizado se passa CP-2 (> = 10% de taxas de mutação em embriões in vitro). Falha no CP-2 exigirá um redesenho dos conjuntos ZFN. Doadoras de embriões serão preparados e embriões em estágio pronuclear será microinjeção com os conjuntos ZFN validadas. Estes embriões microinjectados serão transferidos para receptoras sincronizadas. Após o período de um mês de gestação, os recém-nascidos serão genotipados (CP-3). Se nenhum dos recém-nascidos são positivos, microinjecção adicional vai ser efectuada. Demora 2-3 meses do início do projeto para CP-2, assumindo que nfalha o durante o processo. Leva adicionais 2-3 meses de CP-2 a CP-3. Por isso, é possível gerar um coelho nocaute em um mês 4-6 período de tempo usando a tecnologia ZFN. Clique aqui para ver a imagem ampliada .
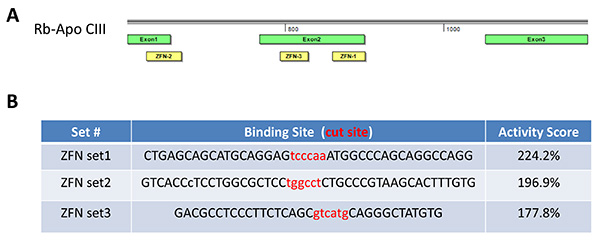
Figura 2. Projeto ZFN. Três conjuntos ZFN (ajuste 1, 2 e 3) foram projetados visando diferentes seqüências em Exon 1 ou Exon 2 de coelho APOCIII (A). Todos os três conjuntos foram sujeitos a MEL-1 de ensaio repórter de levedura para determinar as actividades de ZFN. De acordo com os protocolos do fabricante, que mostram actividades ZFNs> 50% da do controlo positivo interno do fabrico, são considerados úteis para o in vitro e em experiências in vivo edição genoma.As atividades ZFN foram 224,2% para o conjunto 1, 196,9% para o Conjunto 2 e 177,8% para o conjunto de 3 (B), portanto, Conjunto 1 foi selecionado no presente estudo. Clique aqui para ver a imagem ampliada .
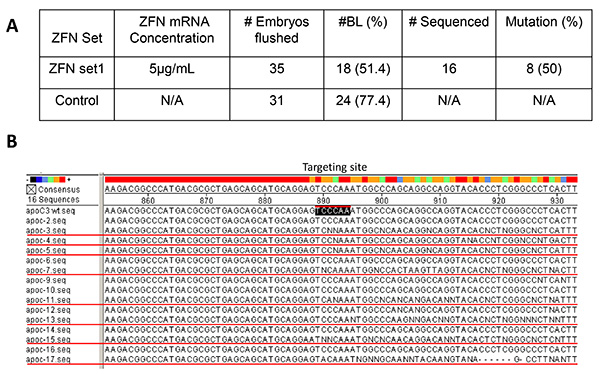
Figura 3. Validação in vitro de embriões de ZFN. O ARNm (5 ug / ml) do Conjunto 1 foi microinjectada no citoplasma de embriões de coelho 35 pronuclear fase (A). Embriões eliminado sem tratamento microinjeção (n = 31) foram utilizados como grupo controle. A taxa de desenvolvimento BL foi de 77,4% no grupo controle. No grupo de micro-injectados, a taxa de BL foi de 51,4%. Das 16 BLs submetidos a PCR de seqüenciamento, 8 (50%) foram consideradas positivas, indicando Set 1 é um conjunto ZFN eficaz para induzir mutações no targelocal ting (B, apoc3wt.seq, black-box) de APOCIII em coelhos. Os LB contendo mutações são BL # apoc-3, 4, 5, 7, 11, 13, 15, e (sublinhado B, vermelho) 17. Os restantes BLs (# apoc-2, 6, 9, 10, 12, 14 e 16) não possuem mutações no local segmentação. Clique aqui para ver a imagem ampliada .

Figura 4. Produção de coelhos APOCIII KO. Cento e quarenta e cinco embriões microinjetados com ZFN grupo 1 mRNAs foram transferidos para receptoras 7 coelhos pseudo-grávida (A). Embriões recém-liberadas (n = 75) sem ZFN microinjeção foram transferidos para receptoras (n = 6), como o grupo de controle. A taxa de prazo calculado como kits prazo total / total de embriões no grupo experimental é de 140,5% (21/145), enquanto que a taxa é de 29,3% (22/75) no grupo de controle (A). Dos 21 kits nascidos no grupo microinjectado, cinco (R1, R9, R11, R12 e R16) foram identificados como positivos kits KO após sequenciação de PCR (B). Os indels no local segmentação incluem duas inserções (+1 para ambos R9 e R11) e três deleções (Δ1, Δ 20 Δ 21 para R1, R12 e R16, respectivamente). Clique aqui para ver a imagem ampliada .
Disclosures
The authors have nothing to disclose.
Acknowledgements
Este trabalho foi parcialmente financiado por subvenções dos Institutos Nacionais de Saúde (HL105114, HL088391, NS066652 e HL068878 para YEC), a American Heart Association (National Scientist Desenvolvimento 0835237N para JZ). YEC é apoiado financeiramente como dotado Frederick Huetwell Professor de Medicina Cardiovascular da Universidade de Michigan Medical Center (UMMC). Este trabalho utilizou Core Services suportados pelo Centro de Modelos Avançados para Ciências de translação e Terapêutica (CAMTraST) em UMMC.
Materials
| APOC3-ZFN | Sigma Aldrich | CSTZFNY-1KT | Target Gene: APOC3, Lot Number: 12201118MN |
| mMESSAGE kit | Invitrogen | AM1344M | mRNA synthesis |
| MEGAclear Kit | Invitrogen | AM1908M | mRNA purification |
| Follicle-stimulating hormone | Bioniche Life Sciences | Folltropin-V | Treating embryo donor rabbits |
| Human chorionic gonadotropin | Intervet | Chorulon | Treating embryo donor rabbits |
| Gonadotropin-releasing hormone | Prospecbio | HOR-255 | Treating embryo recipient rabbits |
| Earle's Balanced Salt Solution (EBSS) | Thermo Fisher Scientific | SH30029.02 | Embryo culture, base medium |
| MEM (nonessential amino acid) | Sigma Aldrich | M7145 | Embryo culture, supplements |
| BME AMINO ACIDS solution | Sigma Aldrich | B6766 | Embryo culture, supplements |
| Glutamine | Gibco | 25030-149 | Embryo culture, supplements |
| Sodium pyruvate | Gibco | 11360-070 | Embryo culture, supplements |
| Fetal bovine serum | Sigma Aldrich | 12003C | Embryo culture, supplements |
| HEPES buffered TCM 199 | Gibco | 12350039 | Embryo manipulation medium |
| Incubator | Eppendorf | Galaxy 170 | Embryo culture equipment |
| Micromanipulator | Eppendorf | TransferMan NK 2 | Embryo manipulation equipment |
| Micropipette puller | Sutter Instruments Inc. | P-1000 | Embryo manipulation equipment |
| Microinjector | Tritech Research | MINJ-D | Embryo manipulation equipment |
| Borosilicate glass capillary tubes | World Precision Instruments, Inc. | TW100F-6 | Embryo manipulation supply |
| Euthasol (pentobarbitol sodium) | Virbac AH, Inc. | ANADA#200-071 | Euthanization of embryo donor rabbits |
References
- Ooi, E. M., Barrett, P. H., Chan, D. C., Watts, G. F. Apolipoprotein C-III: understanding an emerging cardiovascular risk factor. Clinical Science. 114, 611-624 (2008).
- Pollin, T. I., et al. A null mutation in human APOC3 confers a favorable plasma lipid profile and apparent cardioprotection. Science. 322, 1702-1705 (2008).
- Ginsberg, H. N., et al. Apolipoprotein B metabolism in subjects with deficiency of apolipoproteins CIII and AI. Evidence that apolipoprotein CIII inhibits catabolism of triglyceride-rich lipoproteins by lipoprotein lipase in vivo. The Journal of Clinical Investigation. 78, 1287-1295 (1986).
- Cohn, J. S., et al. Increased apoC-III production is a characteristic feature of patients with hypertriglyceridemia. Atherosclerosis. 177, 137-145 (2004).
- Cohn, J. S., Patterson, B. W., Uffelman, K. D., Davignon, J., Steiner, G. Rate of production of plasma and very-low-density lipoprotein (VLDL) apolipoprotein C-III is strongly related to the concentration and level of production of VLDL triglyceride in male subjects with different body weights and levels of insulin sensitivity. The Journal of Clinical Endocrinology and Metabolism. 89, 3949-3955 (2004).
- Maeda, N., et al. Targeted disruption of the apolipoprotein C-III gene in mice results in hypotriglyceridemia and protection from postprandial hypertriglyceridemia. The Journal of Biological Chemistry. 269, 23610-23616 (1994).
- Jong, M. C., et al. Apolipoprotein C-III deficiency accelerates triglyceride hydrolysis by lipoprotein lipase in wild-type and apoE knockout mice. Journal of Lipid Research. 42, 1578-1585 (2001).
- James, J. F., Hewett, T. E., Robbins, J. Cardiac physiology in transgenic mice. Circ. Res. 82, 407-415 (1998).
- Duranthon, V., et al. On the emerging role of rabbit as human disease model and the instrumental role of novel transgenic tools. Transgenic Research. 21, 699-713 (2012).
- Fan, J., Watanabe, T. Transgenic rabbits as therapeutic protein bioreactors and human disease models. Pharmacol. Ther. 99, 261-282 (2003).
- Shiomi, M., Ito, T. The Watanabe heritable hyperlipidemic (WHHL) rabbit, its characteristics and history of development: a tribute to the late Dr. Yoshio Watanabe. Atherosclerosis. 207, 1-7 (2009).
- Morehouse, L. A., et al. Inhibition of CETP activity by torcetrapib reduces susceptibility to diet-induced atherosclerosis in New Zealand White rabbits. Journal of Lipid Research. 48, 1263-1272 (2007).
- Getz, G. S., Reardon, C. A. Animal models of atherosclerosis. Arteriosclerosis, Thrombosis, and Vascular Biology. 32, 1104-1115 (2012).
- Carlson, D. F., et al. Efficient TALEN-mediated gene knockout in livestock. Proceedings of the National Academy of Sciences of the United States of America. , (2012).
- Jiang, W., Bikard, D., Cox, D., Zhang, F., Marraffini, L. A. RNA-guided editing of bacterial genomes using CRISPR-Cas systems. Nature Biotechnology. 31, 233-239 (2013).
- Petersen, B. Update on ‘molecular scissors’ for transgenic farm animal production. Reproduction, Fertility, and Development. 25, 317-318 (2012).
- Yang, D., et al. Generation of PPARgamma mono-allelic knockout pigs via zinc-finger nucleases and nuclear transfer cloning. Cell Research. 21, 979-982 (1038).
- Flisikowska, T., et al. Efficient immunoglobulin gene disruption and targeted replacement in rabbit using zinc finger nucleases. PLoS ONE. 6, e21045 (2011).
- Foley, J. E., et al. Targeted mutagenesis in zebrafish using customized zinc-finger nucleases. Nature Protocols. 4, 1855-1867 (2009).
- Carbery, I. D., et al. Targeted genome modification in mice using zinc-finger nucleases. Genetics. 186, 451-459 (2010).
- Mashimo, T., et al. Generation of knockout rats with X-linked severe combined immunodeficiency (X-SCID) using zinc-finger nucleases. PLoS ONE. 5, e8870 (2010).
- Ding, Y., et al. Hypertriglyceridemia and delayed clearance of fat load in transgenic rabbits expressing human apolipoprotein CIII. Transgenic Research. 20, 867-875 (2011).
- Hauschild, J., et al. Efficient generation of a biallelic knockout in pigs using zinc-finger nucleases. Proceedings of the National Academy of Sciences of the United States of America. 108, 12013-12017 (2011).

