烟草中瞬时表达的蛋白作为一个案例研究:复杂系统采用的实验方法设计的表征
Summary
我们描述的实验方法设计,可以被用来确定与模型的转基因的调控元件,植物生长和发育参数和培养条件对植物中的单克隆抗体和报告蛋白的瞬时表达的影响。
Abstract
工厂提供用于生产生物制药,包括成本低,可扩展性和安全性的多重效益。瞬时表达提供短期开发和生产时间的额外优势,但表达水平可以分批从而在良好生产规范的背景下监管问题引起的显著差异。我们使用的试验设计(DOE)的方式设计确定的主要因素,如表达过程中的表达构建体的调节元件,植物生长和发育的参数,并在培养条件下,在表达的批次之间的变异性的影响。我们测试了植物表达模型的抗HIV单克隆抗体(2G12)和荧光标记蛋白(红色荧光蛋白)。我们讨论的理由来选择模型的某些性质,并确定其潜在的局限性。一般的处理方法可以很容易地转移到其他问题,因为该模型的原理再广泛适用:基于知识的参数选择,降低复杂性通过把最初的问题分成更小的模块,优化实验组合软件引导安装程序和阶梯式设计增强。因此,该方法不仅用于表征植物蛋白的表达也为其他复杂系统缺乏一种机械描述的调查有用的。预测方程描述参数之间的互连性可用于建立机理模型用于其它复杂的系统。
Introduction
生物的蛋白质在植物中的产量是有益的,因为植物是便宜的增长,该平台可以扩大刚刚通过生长得更植物和人类病原体无法复制1,2。例如基于与叶根癌农杆菌浸润瞬时表达策略提供了额外的好处,因为DNA传递和净化产品的交付点之间的时间减少从几年到不到2个月3。瞬时表达也可用于功能分析, 例如来测试基因的互补功能丧失的突变体或以调查蛋白质相互作用4-6能力。然而,瞬时表达水平往往表现出更大的批与批之间的变化比在转基因植物中7-9的表达水平。这减少了基于瞬时表达的Wi生物制药生产过程的可能性会批准在良好生产规范(GMP)的情况下,因为再现性是一个关键质量属性,并受风险评估10。这种变化也可以掩盖,研究人员打算调查的任何相互作用。因此,我们开始着手找出影响植物中瞬时表达水平,打造一支高素质的定量预测模型的主要因素。
一个因子在每次一个(OFAT)方法经常用于表征某些参数( 系数 )的对结果的实验11的影响( 效应 )( 响应 )。但是,这是不理想的,因为单独的测试( 运行 )的调查( 实验 )期间将通过被测试( 设计空间 )的因素跨越的潜力区对齐像一串珍珠。设计空间和信息,因此从实验中得出的程度的覆盖范围是低, 如图1A 12。此外,不同的因素( 因子相互作用 )之间的相互依赖关系可以保持隐蔽导致差的模型和/或假最优的预测, 如图1B 13。
上述缺点,可避免使用试验设计(DOE)的方法,其中一个实验的运行被整个设计空间散布更加均匀地设计,这意味着多于一个因素是两个运行14之间变化。有专门设计的混合物,筛选因子( 因子设计 )和对反应的影响因素的定量( 响应面方法,RSM次)15。此外,的RSM可被实现为中央复合设计,但也可以通过使用能够对运行中的选择应用不同的标准专门的软件有效地实现。例如,所谓的D-optimalitŸ标准将选择运行,以便在生成的模型的系数,以尽量减少误差,而IV-最优标准选择运行的实现整个设计空间15,16最低的预测方差。我们在这里描述的RSM允许在植物中瞬时表达的精确定量,但是它可以很容易地转移到涉及多个(〜5-8)的任何系统的数值的因素( 如温度,时间,浓度)和几个(〜2 – 4) 明确的因素( 如启动子,颜色),其中一种机械的描述不可用或过于复杂的模型。
能源部的方法起源于农业科学,但已经扩散到其它区域,因为它是可转移到任何情况下它减少必要获得可靠的数据运行的次数,并生成描述性模型为复杂的过程是有用的。这反过来又导致了“指引纳入能源部的业,Q8(R2)医药发展“通过对技术要求国际协调会议公布了注册人用药品(ICH)17。能源部目前广泛应用于科研和工业18。然而,护理过程中必须采取规划和执行实验,因为选择不当的多项式程度的多重线性回归模型( 基本型号 )可以引入一个需要额外的运行,以正确模拟所有因素的影响。此外,损坏或丢失的数据产生不正确的型号和有缺陷预测,甚至可能防止在协议和讨论第18条所述的任何模型建立的尝试。在协议中,我们将首先列出最重要的规划步骤为RSM为基础的实验,然后解释根据能源部的设计软件DesignExpert V8.1,但类似的设计可以与其他软件includi建吴JMP,Modde和STATISTICA。实验步骤之后是对数据进行分析和评价的指示。
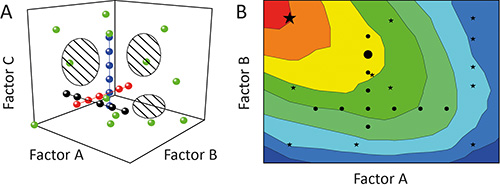
图1。 OFAT和能源部,一个比较 。的一个因素在一个实验(黑,红和蓝色圆圈)连续变化的时间(OFAT)实现了设计空间(斜线区域)的低覆盖率。与此相反,一个以上的因素在一个时间使用的试验设计(DOE)的策略(绿色圆圈)的设计的变化提高了覆盖率,将所得模型。 乙因而精度。偏置设计空间覆盖意味着OFAT实验(黑圈)也可能失败,找出最佳的操作区域(红色)和预测次优的解决方案(大黑圆),而能源部将军会ES(黑星)更容易找出最好的条件(大黑星)。
Protocol
Representative Results
Discussion
每个实验需要仔细的规划,因为资源通常是稀缺和昂贵。这是能源部战略尤其如此,因为在规划阶段( 如选择基本模型,它并不包括所有显著因素相互作用)的错误可以大大减少所产生的模型的预测能力,从而贬低了整个实验。然而,可以很容易地通过以下方式避免基本程序这些错误。
在能源部的规划注意事项
首先,要选择一个响应,适合于评估结…
Disclosures
The authors have nothing to disclose.
Acknowledgements
作者感谢托马斯博士拉特马赫提供的PPAM植物表达载体和易卜拉欣Amedi培养在这项研究中所使用的烟草植株。我们要感谢理查德·泰曼博士的协助编辑稿件。这项工作是部分资金由欧洲研究理事会高级格兰特“未来医药”,提案编号269110和Fraunhofer Zukunftsstiftung(弗劳恩霍夫未来基金会)。
Materials
| Design-Expert(R) 8 | Stat-Ease, Inc. | n.a. | DoE software |
| Tryptone | Carl Roth GmbH | 8952.2 | Media component |
| Yeast extract | Carl Roth GmbH | 2363.2 | Media component |
| Sodium chloride | Carl Roth GmbH | P029.2 | Media component |
| Ampicillin | Carl Roth GmbH | K029.2 | Antibiotic |
| Agar-Agar | Carl Roth GmbH | 5210.2 | Media component |
| Escherichia coli K12 DH5a | Life technologies | 18263-012 | Microorganism |
| pPAM | GenBank | AY027531 | Cloning/expression vector; |
| NucleoSpin Plasmid | MACHEREY-NAGEL GmbH | 740588.250 | Plasmid DNA isolation kit |
| NucleoSpin Gel and PCR Clean-up | MACHEREY-NAGEL GmbH | 740609.250 | Plasmid DNA purification kit |
| NanoDrop 2000 | Thermo Scientific | n.a. | Spectrophotometer |
| NcoI | New England Biolabs Inc. | R3193L | Restrictionendonuclease |
| EcoRI | New England Biolabs Inc. | R3101L | Restrictionendonuclease |
| AscI | New England Biolabs Inc. | R0558L | Restrictionendonuclease |
| NEB 4 | New England Biolabs Inc. | B7004S | Restrictionendonuclease buffer |
| TRIS | Carl Roth GmbH | 4855.3 | Media component |
| Disodium tetraborate | Carl Roth GmbH | 4403.3 | Media component |
| EDTA | Carl Roth GmbH | 8040.2 | Media component |
| Agarose | Carl Roth GmbH | 6352.4 | Media component |
| Bromophenol blue | Carl Roth GmbH | A512.1 | Color indicator |
| Xylene cyanol | Carl Roth GmbH | A513.1 | Color indicator |
| Glycerol | Carl Roth GmbH | 7530.2 | Media component |
| Mini-Sub Cell GT Cell | BioRad | 170-4406 | Gel electrophoresis chamber |
| Agrobacterium tumefaciens strain GV3101:pMP90RK | DSMZ | 12365 | Microorganism |
| Electroporator 2510 | Eppendorf | 4307000.658 | Electroporator |
| Beef extract | Carl Roth GmbH | X975.2 | Media component |
| Peptone | Carl Roth GmbH | 2365.2 | Media component |
| Sucrose | Carl Roth GmbH | 4621.2 | Media component |
| Magnesium sulfate | Carl Roth GmbH | 0261.3 | Media component |
| Carbenicillin | Carl Roth GmbH | 6344.2 | Antibiotic |
| Kanamycin | Carl Roth GmbH | T832.3 | Antibiotic |
| Rifampicin | Carl Roth GmbH | 4163.2 | Antibiotic |
| FWD primer | Eurofins MWG Operon | n.a. | CCT CAG GAA GAG CAA TAC |
| REV primer | Eurofins MWG Operon | n.a. | CCA AAG CGA GTA CAC AAC |
| 2720 Thermal cycler | Applied Biosystems | 4359659 | Thermocycler |
| RNAfold webserver | University of Vienna | n.a. | Software |
| Ferty 2 Mega | Kammlott | 5.220072 | Fertilizer |
| Grodan Rockwool Cubes 10x10cm | Grodan | n.a. | Rockwool block |
| Greenhouse | n.a. | n.a. | For plant cultivation |
| Phytotron | Ilka Zell | n.a. | For plant cultivation |
| Omnifix-F Solo | B. Braun | 6064204 | Syringe |
| Murashige and Skoog salts | Duchefa | M 0222.0010 | Media component |
| Glucose | Carl Roth GmbH | 6780.2 | Media component |
| Acetosyringone | Sigma-Aldrich | D134406-5G | Phytohormon analogon |
| BioPhotometer plus | Eppendorf | 6132 000.008 | Photometer |
| Osram cool white 36 W | Osram | 4930440 | Light source |
| Disodium phosphate | Carl Roth GmbH | 4984.3 | Media component |
| Centrifuge 5415D | Eppendorf | 5424 000.410 | Centrifuge |
| Forma -86C ULT freezer | ThermoFisher | 88400 | Freezer |
| Synergy HT | BioTek | SIAFRT | Fluorescence plate reader |
| Biacore T200 | GE Healthcare | n.a. | SPR device |
| Protein A | Life technologies | 10-1006 | Antibody binding protein |
| HEPES | Carl Roth GmbH | 9105.3 | Media component |
| Tween-20 | Carl Roth GmbH | 9127.3 | Media component |
| 2G12 antibody | Polymun | AB002 | Reference antibody |
References
- Fischer, R., Emans, N. Molecular farming of pharmaceutical proteins. Transgenic research. 9, 277-299 (2000).
- Commandeur, U., Twyman, R. M., Fischer, R. The biosafety of molecular farming in plants. AgBiotechNet. 5, 9 (2003).
- Shoji, Y., et al. A plant-based system for rapid production of influenza vaccine antigens. Influenza Other Resp. 6, 204-210 (2012).
- Goodin, M. M., Zaitlin, D., Naidu, R. A., Lommel, S. A. Nicotiana benthamiana: Its history and future as a model for plant-pathogen interactions. Mol Plant Microbe In. 21, 1015-1026 (2008).
- Berg, R. H., Beachy, R. N. Fluorescent protein applications in plants. Method Cell Biol. 85, 153 (2008).
- Chung, S. M., Vaidya, M., Tzfira, T. Agrobacterium is not alone: gene transfer to plants by viruses and other bacteria. Trends in plant science. 11, 1-4 (2006).
- Sheludko, Y. V., Sindarovska, Y. R., Gerasymenko, I. M., Bannikova, M. A., Kuchuk, N. V. Comparison of several Nicotiana species as hosts for high-scale Agrobacterium-mediated transient expression. Biotechnology and Bioengineering. 96, 608-614 (2007).
- Wydro, M., Kozubek, E., Lehmann, P. Optimization of transient Agrobacterium-mediated gene expression system in leaves of Nicotiana benthamiana. Acta Biochimica Polonica. 53, 289-298 (2006).
- Buyel, J. F., Fischer, R. Processing heterogeneous biomass: Overcoming the hurdles in model building. Bioengineered. 4, (2013).
- Fischer, R., Schillberg, S., Hellwig, S., Twyman, R. M., Drossard, J. GMP issues for recombinant plant-derived pharmaceutical proteins. Biotechnol Adv. 30, 434-439 (2012).
- Daniel, C. One-at-a-time plans. Journal of the American Statistical Association. 68, 353-360 (1973).
- Czitrom, V. One-Factor-at-a-Time versus Designed Experiments The American Statistician. 53, 6 (1999).
- Anderson, M. J., Kraber, S. L. Keys to successful designed experiments. ASQ – The global voice of quality. 6, 6 (1999).
- Montgomery, D. C. . Design and Analysis of Experiments. , (2007).
- Myers, R. H., Montgomery, D. C., Anderson-Cook, C. M. . Response Surface Methodology: Process and Product Optimization Using Designed Experiments. , (2009).
- Piepel, G. F. Programs for generating extreme vertices and centroids of linearly constrained experimental regions. J Qual Technol. 20, 15 (1988).
- . . FDA. , (2009).
- Shivhare, M., McCreath, G. Practical Considerations for DoE Implementation in Quality By Design. BioProcess International. 8, 9 (2010).
- Buyel, J. F., Fischer, R. Predictive models for transient protein expression in tobacco (Nicotiana tabacum L.) can optimize process time, yield, and downstream costs. Biotechnology and bioengineering. 109, 2575-2588 (2012).
- Buyel, J. F., Kaever, T., Buyel, J. J., Fischer, R. Predictive models for the accumulation of a fluorescent marker protein in tobacco leaves according to the promoter/5’UTR combination. Biotechnology and bioengineering. 110, 471-482 (2013).
- Anderson, M. J., Whitcomb, P. J. . DOE Simplified: Practical Tools for Effective Experimentation. , (2000).
- Anderson, M. J., Whitcomb, P. J. . Response Surface Methods Simplified. , (2005).
- De Gryze, S., Langhans, I., Vandebroek, M. Using the correct intervals for prediction: A tutorial on tolerance intervals for ordinary least-squares regression. Chemometr Intell Lab. 87, 147-154 (2007).
- . . Plasmid DNA purification User manual. , (2012).
- . . PCR clean-up Gel extraction User manual. , (2012).
- . . Quick Ligation Protocol. 4, (2009).
- Inoue, H., Nojima, H., Okayama, H. High-Efficiency Transformation of Escherichia-Coli with Plasmids. Gene. 96, 23-28 (1990).
- Main, G. D., Reynolds, S., Gartland, J. S. Electroporation protocols for Agrobacterium. Methods in Molecular Biology. 44, 405-412 (1995).
- Gruber, A. R., Lorenz, R., Bernhart, S. H., Neubock, R., Hofacker, I. L. The Vienna RNA websuite. Nucleic acids research. 36, 70-74 (2008).
- Howell, S., Kenmore, M., Kirkland, M., Badley, R. A. High-density immobilization of an antibody fragment to a carboxymethylated dextran-linked biosensor surface. J Mol Recognit. 11, 200-203 (1998).
- Newcombe, A. R., et al. Evaluation of a biosensor assay to quantify polyclonal IgG in ovine serum used for the production of biotherapeutic antibody fragments. Process Biochem. 41, 842-847 (2006).
- Peixoto, J. L. Hierarchical Variable Selection in Polynomial Regression-Models. Am Stat. 41, 311-313 (1987).
- Peixoto, J. L. A Property of Well-Formulated Polynomial Regression-Models. Am Stat. 44, 26-30 (1990).
- Sanders, P. R., Winter, J. A., Barnason, A. R., Rogers, S. G., Fraley, R. T. Comparison of cauliflower mosaic virus 35S and nopaline synthase promoters in transgenic plants. Nucleic acids research. 15, 1543-1558 (1987).
- Ma, J. K. C., et al. Generation and Assembly of Secretory Antibodies in Plants. Science. 268, 716-719 (1995).
- Wycoff, K. L. Secretory IgA antibodies from plants. Curr Pharm Design. 11, 2429-2437 (2005).
- Pace, C. N., Vajdos, F., Fee, L., Grimsley, G., Gray, T. How to measure and predict the molar absorption coefficient of a protein. Protein Sci. 4, 2411-2423 (1995).

