Dinámica electroquímico Medición de cloruro de iones
Summary
Dynamic measurement of chloride ions is presented. Transition time of an Ag/AgCl electrode, during a chronopotentiometric technique, can give the concentration of chloride ions in electrolyte. This method does not require a stable conventional reference electrode.
Abstract
This protocol describes the dynamic measurement of chloride ions using the transition time of a silver silver chloride (Ag/AgCl) electrode. Silver silver chloride electrode is used extensively for potentiometric measurement of chloride ions concentration in electrolyte. In this measurement, long-term and continuous monitoring is limited due to the inherent drift and the requirement of a stable reference electrode. We utilized the chronopotentiometric approach to minimize drift and avoid the use of a conventional reference electrode. A galvanostatic pulse is applied to an Ag/AgCl electrode which initiates a faradic reaction depleting the Clˉ ions near the electrode surface. The transition time, which is the time to completely deplete the ions near the electrode surface, is a function of the ion concentration, given by the Nernst equation. The square root of the transition time is in linear relation to the chloride ion concentration. Drift of the response over two weeks is negligible (59 µM/day) when measuring 1 mM [Clˉ]using a current pulse of 10 Am-2. This is a dynamic measurement where the moment of transition time determines the response and thus is independent of the absolute potential. Any metal wire can be used as a pseudo-reference electrode, making this approach feasible for long-term measurement inside concrete structures.
Introduction
Se presenta un sensor de iones de cloruro basado en la medición del tiempo de transición de un electrodo Ag / AgCl. El objetivo es evitar las derivas inherentes durante el seguimiento a largo plazo continuo de los iones cloruro en el electrolito. medición Chronopotentiometric, que es un método de medición dinámica, de un electrodo de Ag / AgCl se utiliza para este propósito. Aquí una tasa de cambio de potencial de un electrodo de Ag / AgCl se mide durante un estímulo (pulso galvanostático). La ventaja de este enfoque se demuestra por eludir el electrodo de referencia de unión líquida y en lugar de usar cualquier alambre de metal como un electrodo de pseudo-referencia, por lo tanto permitiendo la detección de Cl concentración iones de largo plazo (años) y en aplicaciones in situ, tales como medición en el interior de estructuras de hormigón.
Los iones cloruro en las estructuras de hormigón es una de las principales causas de la degradación de 1,2. Inicia la corrosión por picadura en el refuerzo de acero de unaResultados de ND en el fracaso final de la estructura 3. Por lo tanto, la medición de iones de Cl en concreto es inevitable para predecir el ciclo de vida de servicio y mantenimiento de un 4,5 estructura. Diferentes principios de detección han sido reportados para la medición de iones cloruro en el hormigón como electroquímica 6,7, 8,9 y óptica electromagnética 10,11. Sin embargo, los métodos ópticos y electromagnéticos tienen configuraciones voluminosos, son difíciles de integrar como un sistema autónomo y tienen problemas con la selectividad 12. En técnica electroquímica, la medición potenciométrica de un electrodo Ag / AgCl es el estado de la 6,7,13 enfoque de la técnica. A pesar de los resultados prometedores, este enfoque se limita a la medición a escala de laboratorio desde las derivas en el potencial de referencia y los resultados de caída de potencial de difusión en datos defectuosos 14,15. Un enfoque tiempo de transición basado en la medición electroquímica dinámico (DEM) podría aliviar el problema debido al potencial16 la deriva.
En el DEM, la respuesta de un sistema a un estímulo aplicado se mide 17-19. El ejemplo de tal sistema es cronopotenciometría. Aquí un impulso de corriente aplicada se utiliza como un estímulo ozono iones cerca de la superficie del electrodo y se mide la respuesta de potencial correspondiente. Una corriente anódica en un electrodo de Ag / AgCl inicia una reacción farádica (Ag + Cl 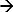 AgCl + e) lo que resulta en un agotamiento de los iones Cl cerca de la superficie del electrodo. El cambio de potencial es una función de la corriente aplicada y la concentración de los iones (selectivos) en el 12,20 electrolito. En el momento en que estos iones se agotan por completo cerca de la superficie del electrodo de la tasa de cambio de los potenciales aumentos rápidamente, dando un punto de inflexión 21. El punto de inflexión en la curva de respuesta en tiempo potencial (chronopotentiogram) muestra el tiempo de transición y puede determinarse a partir delmáximo de la primera derivada de la respuesta de potencial 22. El tiempo de transición es una característica de la concentración de iones. Este enfoque ha sido utilizado para determinar diferentes iones concentración 17 y el pH de electrolitos 23,24. En el caso de un electrodo de Ag / AgCl como un electrodo de trabajo (a la que se aplica corriente) los iones agotan serán iones cloruro 17. Por lo tanto, la medición de su tiempo de transición va a determinar su concentración.
AgCl + e) lo que resulta en un agotamiento de los iones Cl cerca de la superficie del electrodo. El cambio de potencial es una función de la corriente aplicada y la concentración de los iones (selectivos) en el 12,20 electrolito. En el momento en que estos iones se agotan por completo cerca de la superficie del electrodo de la tasa de cambio de los potenciales aumentos rápidamente, dando un punto de inflexión 21. El punto de inflexión en la curva de respuesta en tiempo potencial (chronopotentiogram) muestra el tiempo de transición y puede determinarse a partir delmáximo de la primera derivada de la respuesta de potencial 22. El tiempo de transición es una característica de la concentración de iones. Este enfoque ha sido utilizado para determinar diferentes iones concentración 17 y el pH de electrolitos 23,24. En el caso de un electrodo de Ag / AgCl como un electrodo de trabajo (a la que se aplica corriente) los iones agotan serán iones cloruro 17. Por lo tanto, la medición de su tiempo de transición va a determinar su concentración.
Protocol
Representative Results
Discussion
El tiempo de transición es el momento de inflexión; teóricamente es independiente del potencial de referencia, es decir, el electrodo de referencia. Por tanto, cualquier alambre de metal se puede utilizar como un electrodo de pseudo-referencia para mediciones de tiempo de transición. En contraste con la medición potenciométrica existente de iones cloruro en el hormigón este método permite a un largo plazo y la calibración de medición libre. Además, la sensibilidad y el rango de detección de la conce…
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work is a part of the STW project “Integral solution for sustainable construction (IS2C, Fleur van Rossem for her support during the chip fabrication, Justyna Wiedemair for the chip design and Allison Bidulock for her support during the manuscript preparation.
Materials
| Platinum wire (≥99.99% trace metals) | Sigma Aldrich, the Netherlands | EP1330-1EA | |
| Potassium chloride (BioXtra, ≥99.0%) | Sigma Aldrich, the Netherlands | P9333-500G | |
| Potassium hydroxide (90% pure reagent grade) | Sigma Aldrich, the Netherlands | 484016-1KG | |
| Ferric chloride | Sigma Aldrich, the Netherlands | 451649-1G | |
| potassium nitrate (> 99% reagent grade) | Sigma Aldrich, the Netherlands | P6083-500G | |
| Ag/AgCl liquid junction reference electrode | BASi, USA | model MF-2079 | |
| VSP potentiostat | Biologic Science Instruments, France | VSP 300 | |
| Steel wire | Microlab TU Delft | ||
| Silver wire | Sigma Aldrich, the Netherlands |
References
- Page, C., Treadaway, K. Aspects of the electrochemistry of steel in concrete. Nature. 297, 109-115 (1982).
- Koleva, D. A., Hu, J., van Breugel, K., Boshkov, N., de Wit, H. Conventional and pulse cathodic protection of reinforced concrete: electrochemical approach and microstructural investigations. ECS Transactions. 1, 287-298 (2006).
- Montemor, M., Simoes, A., Ferreira, M. Chloride-induced corrosion on reinforcing steel: from the fundamentals to the monitoring techniques. Cement and Concrete Composites. 25, 491-502 (2003).
- Wegen, G., Polder, R. B., Breugel, K. V. Guideline for service life design of structural concrete: A performance based approach with regard to chloride induced corrosion. Heron. 57 (3), (2012).
- Yoon, I., Koenders, E. Theoretical time evolution of critical chloride content in concrete. Structural Durability & Health Monitoring. 5, 275-294 (2010).
- Du, R. G., Hu, R. G., Huang, R. S., Lin, C. J. In situ measurement of Cl-concentrations and pH at the reinforcing steel/concrete interface by combination sensors. Analytical Chemistry. 78, 3179-3185 (2006).
- Angst, U., Elsener, B., Larsen, C. K., Vennesland, &. #. 2. 1. 6. ;. Potentiometric determination of the chloride ion activity in cement based materials. Journal of Applied Electrochemistry. 40, 561-573 (2010).
- Laferrière, F., Inaudi, D., Kronenberg, P., Smith, I. F. A new system for early chloride detection in concrete. Smart Materials and Structures. 17, 045017 (2008).
- Tang, J. L., Wang, J. N. Measurement of chloride-ion concentration with long-period grating technology. Smart Materials and Structures. 16, 665 (2007).
- Kohri, M., Ueda, T., Mizuguchi, H. Application of a near-infrared spectroscopic technique to estimate the chloride ion content in mortar deteriorated by chloride attack and carbonation. Journal of Advanced Concrete Technology. 8, 15-25 (2010).
- Tripathi, S. R., Inoue, H., Hasegawa, T., Kawase, K. Non-destructive Inspection of Chloride Ion in Concrete Structures Using Attenuated Total Reflection of Millimeter Waves. Journal of Infrared, Millimeter, and Terahertz Waves. 34, 181-186 (2013).
- Abbas, Y., Olthuis, W., van den Berg, A. A chronopotentiometric approach for measuring chloride ion concentration. Sensors and Actuators B: Chemical. 188, 433-439 (2013).
- Climent-Llorca, M. A., Viqueira-Pérez, E., Lòpez-Atalaya, M. M. Embeddable Ag/AgCl sensors for in-situ monitoring chloride contents in concrete. Cement and Concrete Research. 26, 1157-1161 (1996).
- Myrdal, R. . The electrochemistry and characteristics of embeddable reference electrodes for concrete. , (2014).
- Angst, U., Vennesland, &. #. 2. 1. 6. ;., Myrdal, R. Diffusion potentials as source of error in electrochemical measurements in concrete. Materials and Structures. 42, 365-375 (2009).
- Abbas, Y., de Graaf, D. B., Olthuis, W., van den Berg, A. No more conventional reference electrode: Transition time for determining chloride ion concentration. Analytica Chimica Acta. 821, 81-88 (2014).
- Meyer, R. E., Posey, F. A., Lantz, P. M. Chronopotentiometry of the Ag− AgCl system and analysis for the chloride ion. Journal of Electroanalytical Chemistry and Interfacial Electrochemistry. 19, 99-109 (1968).
- Olthuis, W., Langereis, G., Bergveld, P. The metrits of differential measuring in time and space. Biocybernetics and Biomedical Engineering. 21, 5-26 (2001).
- Bakker, E., Bhakthavatsalam, V., Gemene, K. L. Beyond potentiometry: robust electrochemical ion sensor concepts in view of remote chemical sensing. Talanta. 75, 629-635 (2008).
- Olthuis, W., Bomer, J., Bergveld, P., Bos, M., Van der Linden, W. Iridium oxide as actuator material for the ISFET-based sensor-actuator system. Sensors and Actuators B: Chemical. 5, 47-52 (1991).
- Bergveld, P., Eijkel, J., Olthuis, W. Detection of protein concentrations with chronopotentiometry. Biosensors and Bioelectronics. 12, 905-916 (1997).
- Iwamoto, R. Derivative chronopotentiometry. Analytical Chemistry. 31, 1062-1065 (1959).
- Olthuis, W., Bergveld, P. Simplified design of the coulometric sensor-actuator system by the application of a time-dependent actuator current. Sensors and Actuators B: Chemical. 7, 479-483 (1992).
- Olthuis, W., Bergveld, P. Integrated coulometric sensor-actuator devices. Microchimica Acta. 121, 191-223 (1995).
- Bard, A. J., Faulkner, L. R. . Electrochemical methods: fundamentals and applications. , (2001).
- Bakker, E., Bühlmann, P., Pretsch, E. Polymer Membrane Ion-Selective Electrodes-What are the Limits? . Electroanalysis. 11, 915-933 (1999).

