Nicht-invasive Stimulation des Gehirns Montagen für die Modulation der Menschen Motor Function
Summary
Nicht-invasive Stimulation des Gehirns kann kortikalen Funktion und Verhalten, sowohl für die Forschung und klinische Zwecke modulieren. Dieses Protokoll beschreibt verschiedene Hirnstimulation Ansätze zur Modulation der menschlichen motorischen Systems.
Abstract
Nicht-invasive Stimulation des Gehirns (NEBS) wird verwendet, Gehirnfunktion und Verhalten zu modulieren, sowohl für die Forschung und klinische Zwecke. Insbesondere kann NEBS transkraniell entweder als Gleichstromstimulation (tDCS) oder Wechselstrom-Stimulation (TAC) angewendet werden. Diese Stimulation Arten ausüben zeit-, dosis und im Falle der tDCS Polarität spezifische Effekte auf die motorischen Funktionen und Fähigkeiten bei gesunden Probanden zu lernen. In letzter Zeit hat tDCS verwendet, um die Therapie der motorischen Behinderungen bei Patienten mit Schlaganfall oder Bewegungsstörungen zu erhöhen. Dieser Artikel enthält eine Schritt-für-Schritt-Protokoll des primären motorischen Kortex mit tDCS und transkranielle Rauschen Stimulation (tRNS) für die Ausrichtung, eine spezifische Form der TAC einen elektrischen Strom statistisch innerhalb eines vordefinierten Frequenzbereich angewendet werden. Das Setup von zwei verschiedenen Stimulations Montagen erläutert. In beiden Montagen die emittierende Elektrode (Anode für tDCS) auf dem primären motorischen Kortex des Interesses gestellt. Füreinseitige motorischen Cortex Stimulation wird die Empfangselektrode auf der Gegen Stirn gelegt, während für die bilaterale Stimulation motorischen Kortex die Empfangselektrode auf der gegenüberliegenden primären motorischen Kortex platziert wird. Die Vor- und Nachteile der einzelnen Montage für die Modulation der kortikalen Erregbarkeit und Motorik einschließlich Lernen diskutiert werden, sowie Sicherheit, Verträglichkeit und blendende Aspekte.
Introduction
3 – Nicht-invasive Stimulation des Gehirns (NEBS) kann die Verabreichung von elektrischen Strömen in das Gehirn durch den intakten Schädel, Gehirnfunktion und des Verhaltens 1 ändern. das therapeutische Potenzial von NEBS Strategien Verständnis der zugrunde liegenden Mechanismen, die zu neurophysiologischen und Verhaltenseffekte zu optimieren wird noch benötigt. Die Standardisierung der Anwendung in verschiedenen Labors und vollständige Transparenz der Stimulation Verfahren bildet die Grundlage für die Vergleichbarkeit von Daten, die von Ergebnissen und der Evaluierung der vorgeschlagenen Wirkmechanismen zuverlässige Interpretation unterstützt. Transkranielle Gleichstromstimulation (tDCS) oder die transkranielle Wechselstrom-Stimulation (TAC) unterscheiden sich durch die Parameter des angelegten elektrischen Strom: tDCS besteht aus einer unidirektionalen konstanter Stromfluss zwischen zwei Elektroden (Anode und Kathode) 2 – 6, während tACS verwendet einen Wechselstrom angewandt bei aspezifische Frequenz 7. Transkranielle Rauschen Stimulation (tRNS) ist eine spezielle Form der TAC, die einen Wechselstrom zufällig Frequenzen angewendet verwendet (z. B. 100 bis 640 Hz), die sich in schnell wechselnden Stimulationsintensität und Entfernen Polarität bedingten Effekte 4,6,7. Die Polarität ist nur von Bedeutung, wenn die Stimulation Einstellung eine Stimulation Offset umfasst beispielsweise Rauschspektrum zu ändern um zufällig einen 1 mA Ausgangswert Intensität (in der Regel nicht verwendet). Für die Zwecke dieses Artikels, werden wir auf die Arbeit konzentrieren tDCS und tRNS Auswirkungen auf den Motor-System, genau nach einer jüngsten Veröffentlichung von unserem Labor 6.
Die zugrunde liegenden Mechanismen der Wirkung von tRNS sind noch weniger verstanden als der tDCS aber wahrscheinlich verschieden ist. Theoretisch führt in der konzeptionellen Rahmen der stochastischen Resonanz tRNS Stimulation induzierte Lärm auf ein neuronales System, das durch Veränderung th eine Signalverarbeitungs Nutzen bieten kanne Signal-Rausch-Verhältnis 4,8,9. SENDER kann überwiegend schwächere Signale verstärken und damit aufgabenspezifische Aktivität des Gehirns (endogene Lärm 9) optimieren können. Anodal tDCS erhöht Erregbarkeit kortikaler durch Veränderung der spontanen neuronalen Feuerrate angegeben 10 oder erhöhte Motor evozierte Potentiale (MEP) Amplituden 2 mit den Auswirkungen der Stimulationsdauer für Minuten bis Stunden überdauern. Lang anhaltende Anstieg der synaptischen Wirksamkeit bekannt als Langzeit-Potenzierung gedacht werden, um Lernen und Gedächtnis beitragen. Tatsächlich verbessert die anodische tDCS synaptischen Wirksamkeit von Motor kortikalen Synapsen wiederholt durch eine schwache synaptischen Eingang aktiviert 11. Entsprechend wird verbessert Motorik / Erwerb von Fähigkeiten offenbart oft nur, wenn die Stimulation mit Krafttraining zusammen aufgebracht ist 11 bis 13, auch synaptischen Co-Aktivierung als Voraussetzung dieser leistungsabhängigen Prozess hindeutet. Dennoch Kausalität zwischen den Erhöhungen in cortical Erregbarkeit (Erhöhung der Feuerrate oder MEP Amplitude) einerseits und verbesserte synaptische Wirksamkeit (LTP oder Verhaltensfunktionen wie das motorische Lernen) auf der anderen Seite, nicht nachgewiesen wurde.
NEBS angewandt auf die primären motorischen Kortex (M1) hat zunehmendes Interesse als sichere und effektive Methode angezogen 1 menschlichen Motorik zu modulieren. Neurophysiologische Effekte und Verhaltens Ergebnis kann auf der Stimulationsstrategie abhängen (zB tDCS Polarität oder tRNS), Elektrodengröße und Montage 4 – 6,14,15. Neben fachimmanente anatomischen und physiologischen Faktoren die Elektrode Montage wesentlich beeinflusst elektrische Feldverteilung und kann Auswirkungen auf die Muster der Strom innerhalb des Kortex Verbreitung 16-18. Zusätzlich zu der Intensität des angelegten Stroms der Größe der Elektroden bestimmt die Stromdichte 3 geliefert. Die gemeinsame Elektrode Montagenin der menschlichen motorischen Systems Studien umfassen (Abbildung 1): 1) die anodische tDCS als einseitige M1 Stimulation mit der Anode auf der M1 von Interesse und der Kathode auf der Gegen Stirn positioniert ist; Die Grundidee dieses Ansatzes ist die Hochregulation der Erregbarkeit in der M1 von Interesse 6,13,19 – 22; 2) anodische tDCS bilaterale M1 Stimulation (auch bezeichnet als "bihemispheric" oder "Dual" Stimulation) mit der Anode auf der M1 von Interesse und der Kathode auf der kontralateralen M1 5,6,14,23,24 positioniert ist; Die Grundidee dieses Ansatzes ist Vorteile Stimulation durch Hochregulation der Erregbarkeit in dem M1 von Interesse zu maximieren, während Erregbarkeit in die entgegengesetzte M1 Herunterregulieren (dh Modulation der interhemisphärischen Hemmung zwischen den beiden M1s); 3) Für tRNS, nur die oben erwähnte einseitige Montage M1 Stimulation wurde Beobachtungsated 4,6; mit diese Montage Erregbarkeit Wirkungen von tRNS wurden für das Frequenzspektrum von 100 bis 640 Hz 4 Verbesserung gefunden. Die Wahl der Hirnstimulation Strategie und Elektrode Montage stellt einen entscheidenden Schritt für eine effiziente und zuverlässige Nutzung der NEBS in der klinischen oder Forschungs Einstellungen. Hier diese drei NEBS Verfahren werden im Detail beschrieben, wie in menschlichen Motorsystem Studien verwendet und methodischen und konzeptionellen Aspekte werden diskutiert. Materialien für die ein- oder beidseitige tDCS und einseitige tRNS gleich sind (Abbildung 2).
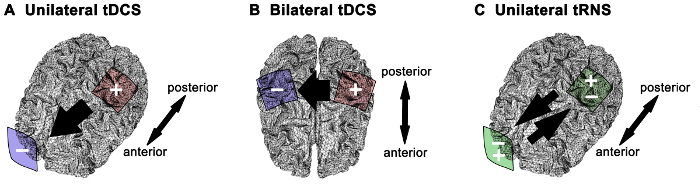
Abbildung 1. Elektrodenmontagen und Stromrichtung für verschiedene NEBS-Strategien. (A) für die einseitige anodische transkranielle Gleichstromstimulation (tDCS) wird die Anode über dem primären motorischen Kortex des Interesses und der Kathode über t positioniert zentrierter kontralateralen Supraorbitalbereich. (B) Für bilaterale motorischen Cortex Stimulation, Anode und Kathode sind jeweils über einen motorischen Kortex befindet. Die Position der Anode bestimmt den motorischen Kortex von Interesse für die anodische tDCS. (C) Für einseitige transkranielle Rauschen Stimulation (tRNS) ist eine Elektrode über dem motorischen Kortex und die andere Elektrode über der Gegenoberaugenhöhlenbereich. Der Stromfluss zwischen den Elektroden wird durch den schwarzen Pfeil angedeutet. Anode (+, rot), Kathode (-, blau), Wechselstrom (+/-, grün). Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.
Protocol
Representative Results
Discussion
Dieses Protokoll beschreibt typische Materialien und Verfahrensschritte zur Modulation der Hand Motorik und Geschicklichkeit Lernen NEBS verwenden, speziell uni- und bilaterale M1 Stimulation für die anodische tDCS und einseitige tRNS. Vor Beginn einer bestimmten NEBS-Protokoll für einen menschlichen motorischen Systems Studie der Wahl, z. B. im Rahmen des motorischen Lernens, methodische Aspekte (Sicherheit, Verträglichkeit, Verblindung) sowie konzeptionellen Aspekte (Montage oder Stromart spezifischen Ausw…
Disclosures
The authors have nothing to disclose.
Acknowledgements
MC und JR werden von der Deutschen Forschungsgemeinschaft (DFG RE 2740 / 3-1) unterstützt.
Materials
| NEBS device (DC Stimulator plus) | Neuroconn | ||
| Electrode cables | Neuroconn | ||
| Conductive-rubber electrodes | Neuroconn | 5×5 cm | |
| Perforated sponge bags | Neuroconn | 5×5 cm | |
| Non-conductive rubber sponge cover | Amrex-Zetron | FG-02-A103 | Rubber pad 3"*3" |
| NaCl isotonic solution | B. Braun Melsungen AG | A1151 | Ecoflac, 0,9% |
| Cotton crepe bandage | Paul Hartmann AG | 931004 | 8x5m, textile elasticity |
| Adhesive tape (Leukofix) | BSN medical | 02122-00 | 2,5cm*5m |
| Skin preparation paste | Weaver | 10-30 | |
| Magnetic stimulator | Magstim | 3010-00 | Magstim 200 |
| EMG conductive paste | GE Medical Systems | 217083 | |
| EMG bipolar electrodes | e.g., Natus Medical Inc. Viking 4 | ||
| EMG amplifier | e.g., Natus Medical Inc. Viking 4 | ||
| Cable for EMG signal transmission | e.g., Natus Medical Inc. Viking 4 | ||
| Data acquisition unit | Cambridge Electronic Design (CED) | MK1401-3 | AD converter |
| Computer for signal recording and offline analysis | |||
| Signal 4.0.9 | Cambridge Electronic Design (CED) | Software | |
| non-permanent skin marker | Edding | 8020 | 1 mm, blue |
References
- Reis, J., Fritsch, B. Modulation of motor performance and motor learning by transcranial direct current stimulation. Curr Opin Neurol. 24 (6), 590-596 (2011).
- Nitsche, M., Paulus, W. Excitability changes induced in the human motor cortex by weak transcranial direct current stimulation. J Physiol. 527 (3), 633-639 (2000).
- Nitsche, M. A., Cohen, L. G., et al. Transcranial direct current stimulation: State of the art. Brain Stimul. 1 (3), 206-223 (2008).
- Terney, D., Chaieb, L., Moliadze, V., Antal, A., Paulus, W. Increasing human brain excitability by transcranial high-frequency random noise stimulation. J Neurosci. 28 (52), 14147-14155 (2008).
- Kidgell, D. J., Goodwill, A. M., Frazer, A. K., Daly, R. M. Induction of cortical plasticity and improved motor performance following unilateral and bilateral transcranial direct current stimulation of the primary motor cortex. BMC Neurosci. 14 (1), 64 (2013).
- Prichard, G., Weiller, C., Fritsch, B., Reis, J. Brain Stimulation Effects of Different Electrical Brain Stimulation Protocols on Subcomponents of Motor Skill Learning. Brain Stimul. 7 (4), 532-540 (2014).
- Antal, A., Paulus, W., Hunter, M. A. Transcranial alternating current stimulation ( tACS ). Front Hum Neurosci. 7, 1-4 (2013).
- Collins, J. J., Chow, C. C., Imhoff, T. T. Stochastic resonance without tuning. Nature. 376 (6537), 236-238 (1995).
- Miniussi, C., Harris, J. A., Ruzzoli, M. Modelling non-invasive brain stimulation in cognitive neuroscience. Neurosci Biobehav Rev. 37 (8), 1702-1712 (2013).
- Bindman, L. J., Lippold, O. C., Redfearn, J. W. the Action of Brief Polarizing Currents on the Cerebral Cortex of the Rat (1) During Current Flow and (2) in the Production of Long-Lasting After-Effects. J Physiol. 172, 369-382 (1964).
- Fritsch, B., Reis, J., et al. Direct current stimulation promotes BDNF-dependent synaptic plasticity: Potential implications for motor learning. Neuron. 66 (2), 198-204 (2010).
- Galea, J. M., Celnik, P. Brain polarization enhances the formation and retention of motor memories. J Neurophysiol. 102 (1), 294-301 (2009).
- Reis, J., Fischer, J. T., Prichard, G., Weiller, C., Cohen, L. G., Fritsch, B. Time- but Not Sleep-Dependent Consolidation of tDCS-Enhanced Visuomotor Skills. Cereb Cortex. (1), 1-9 (2013).
- Saiote, C., Turi, Z., Paulus, W., Antal, A. Combining functional magnetic resonance imaging with transcranial electrical stimulation. Front Hum Neurosci. 7 (8), 435 (2013).
- Sehm, B., Kipping, J., Schäfer, A., Villringer, A., Ragert, P. A Comparison between Uni- and Bilateral tDCS Effects on Functional Connectivity of the Human Motor Cortex. Front Hum Neurosci Neurosci. 7 (4), 183 (2013).
- Moliadze, V., Antal, A., Paulus, W. Electrode-distance dependent after-effects of transcranial direct and random noise stimulation with extracephalic reference electrodes. Clin Neurophysiol. 121 (12), 2165-2171 (2010).
- Bikson, M., Rahman, a., Datta, a. Computational Models of Transcranial Direct Current Stimulation. Clin EEG Neurosci. 43 (3), 176-183 (2012).
- Opitz, A., Paulus, W., Will, A., Thielscher, A. Determinants of the electric field during transcranial direct current stimulation. Neuroimage. 109, 140-150 (2015).
- Nitsche, M., Paulus, W. Sustained excitability elevations induced by transcranial DC motor cortex stimulation in humans. Neurology. 57 (10), 1899-1901 (2001).
- Reis, J., Schambra, H. M., et al. Noninvasive cortical stimulation enhances motor skill acquisition over multiple days through an effect on consolidation. Proc Natl Acad Sci U S A. 106 (5), 1590-1595 (2009).
- Batsikadze, G., Moliadze, V., Paulus, W., Kuo, M. -. F., Nitsche, M. a Partially non-linear stimulation intensity-dependent effects of direct current stimulation on motor cortex excitability in humans. J Physiol. 591 (7), 1987-2000 (2013).
- Wiethoff, S., Hamada, M., Rothwell, J. C. Variability in response to transcranial direct current stimulation of the motor cortex. Brain Stimul. 7 (3), 468-475 (2014).
- Mordillo-Mateos, L., Turpin-Fenoll, L., et al. Effects of simultaneous bilateral tDCS of the human motor cortex. Brain Stimul. 5 (3), 214-222 (2012).
- Tazoe, T., Endoh, T., Kitamura, T., Ogata, T. Polarity Specific Effects of Transcranial Direct Current Stimulation on Interhemispheric Inhibition. PLoS One. 9 (12), e114244 (2014).
- Keel, J. C., Smith, M. J., Wassermann, E. M. A safety screening questionnaire for transcranial magnetic stimulation. Clin Neurophysiol. 112, 720 (2000).
- Villamar, M. F., Volz, M. S., Bikson, M., Datta, A., Dasilva, A. F., Fregni, F. Technique and considerations in the use of 4×1 ring high-definition transcranial direct current stimulation (HD-tDCS). J Vis Exp. (77), e50309 (2013).
- Brasil-Neto, J. P., Cohen, L. G., Panizza, M., Nilsson, J., Roth, B. J., Hallett, M. Optimal focal transcranial magnetic activation of the human motor cortex: effects of coil orientation, shape of the induced current pulse, and stimulus intensity. J Clin Neurophysiol. 9 (1), 132-136 (1992).
- Mills, K., Boniface, S., Schubert, M. Magnetic brain stimulation with a double coil: the importance of coil orientation. Electroencephalogr Clin Neurophysiol. 85 (1), 17-21 (1992).
- Rothwell, J., Hallett, M., Berardelli, A., Eisen, A., Rossini, P., Paulus, W. Magnetic stimulation motor evoked potentials. Electroencephalogr Clin Neurophysiol Suppl. 52, 97-103 (1999).
- Ueno, S., Tashiro, T., Harada, K. Localized stimulation of neural tissues in the brain by means of a paired configuration of time-varying magnetic fields. J Appl Phys. 64 (10), 5862-5864 (1988).
- Fleming, M. K., Sorinola, I. O., Newham, D. J., Roberts-Lewis, S. F., Bergmann, J. H. M. The effect of coil type and navigation on the reliability of transcranial magnetic stimulation. IEEE Trans Neural Syst Rehabil Eng. 20 (5), 617-625 (2012).
- Brunoni, A. R., Amadera, J., Berbel, B., Volz, M. S., Rizzerio, B. G., Fregni, F. A systematic review on reporting and assessment of adverse effects associated with transcranial direct current stimulation. Int J Neuropsychopharmacol. 14 (8), 1133-1145 (2011).
- Palm, U., Reisinger, E., et al. Brain Stimulation Evaluation of Sham Transcranial Direct Current Stimulation for Randomized, Placebo-Controlled Clinical Trials. Brain Stimul. 6 (4), 690-695 (2013).
- Sehm, B., Schäfer, A., et al. Dynamic modulation of intrinsic functional connectivity by transcranial direct current stimulation. J Neurophysiol. 108 (12), 3253-3263 (2012).
- Nitsche, M. A., Schauenburg, A., et al. Facilitation of implicit motor learning by weak transcranial direct current stimulation of the primary motor cortex in the human. J Cogn Neurosci. 15 (4), 619-626 (2003).
- Antal, A., Begemeier, S., Nitsche, M. A., Paulus, W. Prior state of cortical activity influences subsequent practicing of a visuomotor coordination task. Neuropsychologia. 46 (13), 3157-3161 (2008).
- Kang, E. K., Paik, N. J. Effect of a tDCS electrode montage on implicit motor sequence learning in healthy subjects. Exp Transl Stroke Med. 3 (1), 4 (2011).
- Kantak, S. S., Mummidisetty, C. K., Stinear, J. W. Primary motor and premotor cortex in implicit sequence learning – Evidence for competition between implicit and explicit human motor memory systems. Eur J Neurosci. 36 (5), 2710-2715 (2012).
- Nissen, M. J., Bullemer, P. Attentional requirements of learning: Evidence from performance measures. Cogn Psychol. 19 (1), 1-32 (1987).
- Stagg, C. J., Jayaram, G., Pastor, D., Kincses, Z. T., Matthews, P. M., Johansen-berg, H. Polarity and timing-dependent effects of transcranial direct current stimulation in explicit motor learning. Neuropsychologia. 49 (5), 800-804 (2011).
- Poreisz, C., Boros, K., Antal, A., Paulus, W. Safety aspects of transcranial direct current stimulation concerning healthy subjects and patients. Brain Res Bull. 72 (4-6), 208-214 (2007).
- Gandiga, P. C., Hummel, F. C., Cohen, L. G. Transcranial DC stimulation (tDCS): a tool for double-blind sham-controlled clinical studies in brain stimulation. Clin Neurophysiol. 117 (4), 845-850 (2006).
- Baudewig, J., Nitsche, M. A., Paulus, W., Frahm, J. Regional modulation of BOLD MRI responses to human sensorimotor activation by transcranial direct current stimulation. Magn Reson Med. 45 (2), 196-201 (2001).
- Venkatakrishnan, A., Sandrini, M. Combining transcranial direct current stimulation and neuroimaging: novel insights in understanding neuroplasticity. J Neurophysiol. 107 (1), 1-4 (2012).
- Neuling, T., Wagner, S., Wolters, C. H., Zaehle, T., Herrmann, C. S. Finite-element model predicts current density distribution for clinical applications of tDCS and tACS. Frontiers in Psychiatry. 3, 1-10 (2012).
- Bikson, M., Rahman, A. Origins of specificity during tDCS anatomical, activity-selective, and input-bias mechanisms. Front Hum Neurosci. 7, 1-5 (2013).
- Truong, D. Q., Hüber, M., et al. Brain Stimulation Clinician Accessible Tools for GUI Computational Models of Transcranial Electrical Stimulation BONSAI and SPHERES. Brain Stimul. 7 (4), 521-524 (2014).
- Caparelli-Daquer, E. M., Zimmermann, T. J., et al. A Pilot Study on Effects of 4×1 High-Definition tDCS on Motor Cortex Excitability. Proc Annu Int Conf IEEE Eng Med Biol Soc EMBS. , 735-738 (2012).
- Kuo, H. I., Bikson, M., et al. Comparing cortical plasticity induced by conventional and high-definition 4 x 1 ring tDCS: A neurophysiological study. Brain Stimul. 6 (4), 644-648 (2013).

