NMRによるリアルタイム酵素反応速度測定のための溶解動的核分極計装
Summary
The sensitivity enhancement provided by dissolution dynamic nuclear polarization (DNP) enables following metabolic processes in real time by NMR and MRI. The characteristics and performances of a dedicated dissolution DNP setup designed for study enzymatic reactions are discussed.
Abstract
NMRベースの調査の主な制限は、低感度です。これにより、代謝変換のリアルタイムNMR測定を防止し、長い取得時間を入力するよう求められます。溶解DNPを介した過分極は、電子・ツー・核スピン分極移動に起因する大規模なアウトオブ平衡核磁化のおかげで感度の問題の一部を回避します。得られた高NMR信号は、リアルタイムでの化学反応をモニターするために使用することができます。過分極NMRの欠点は、関連付けられた緩和時間定数のオーダーで、好ましい場合において、核スピン縦緩和時間定数、T 1、または程度で通常の信号取得のための限られた時間ウィンドウ内に常駐結合された核の一重項状態、T LLS。内因性分子および代謝速度の細胞取り込みは、腫瘍の発生と薬剤応答に不可欠な情報を提供することができます。ニューmerous以前の過分極NMR研究は、 インビボでの酵素活性をモニタリングするための代謝基質としてピルビン酸の関連性を実証しました。この作品は、特に、過分極NMRによる乳酸脱水素酵素(LDH)の存在下でピルビン酸対乳酸の変換率を、酵素反応の研究に必要な実験装置と方法の詳細な説明を提供します。
Introduction
動的核分極(DNP)、1,2-核スピン分極を強化するために設計された技術、 すなわち 、「アップ」および「ダウン」のスピン集団(P =との間の不均衡[N↑ – N↓] / [N↑+ N ↓])、1950年代に最初に導入されました。このような13 Cのような核スピンは、一般的に1 K程度の温度で、かつ生物学的用途のための突破口が入って来た3.357の磁場T. 3,4に、有利な条件でP = 10 -1までに偏光することができます低温で得られた高核分極レベルを保持しながら、過熱水で凍結分極サンプルを溶解することからなる溶解DNPの開発2000年代初頭。5液体状態のNMR信号はと比較して10倍3 -10 4により増強されます一般的な熱偏RT NMR条件。解散DNPは、したがって、非侵襲的に1秒以下の時間分解能とNMRにより監視ダイナミクスを可能にする、リアルタイムでその場で生化学反応速度を測定する方法を提供します6 – 。10それはまた、非常に低濃度で分析物を検出することが可能となった11。
非侵襲的分子イメージングモダリティの中で、過分極NMRは、同時にリアルタイムで基板及びその代謝産物を測定することができる唯一の技術です。溶解DNPは、代謝のその場での監視に関連する臨床MRI 12と最も有望なアプリケーションにインビトロ NMRに至るまで、様々な科学分野で熱意をもって受け取られた。13,14溶解DNPの主な制限があり、その上に時間後5倍の縦緩和時間定数T 1の順序は、極性の強化します化は失われます。比較的長いT 1を示す核スピンを有する分子を使用することが必要です。分極増強の時間期間を延長するために、長寿命状態(LLS)として知られているゆっくりと緩和核スピン状態は、使用することができる15 – 17 LLSがイントラペア双極子-双極子相互作用に非感受性であるので、それらのT LLS特性緩和時間定数は、T 1よりもはるかに長い数十分の磁化寿命18とすることができ、1時間まで、従って得られた、19,20、およびLLSは、磁気共鳴分光法の両方のために提案されている(MRS)そしてMRI。21
慎重に過分極NMRによる酵素反応速度を研究するために最適化する必要がある主なポイントは以下のとおりです。(i)は、固体分極を最大化すると、(ii)からの過分極の溶液の移送中に偏光損失を最小限に抑えますNMR分光計の偏光板。この記事では、カスタムメイドの溶解DNP装置および酵素反応を研究するための噴射システムの適応を説明します。特性とセットアップの性能はよく知られており、広く使用されている過分極基質[1- 13 C]ピルビン酸で実証されます。この選択の主な理由は、その中心的な役割、第1、第2、数分の間に監視反応を可能にし、その自然に長い13 C縦緩和時間(293 K以上の高磁場および温度でのT 1> 50秒)です癌代謝。13,14溶解DNP NMRおよびカスタム開発注入システムを使用して、乳酸脱水素酵素(LDH)によって触媒されるピルビン酸の酸化は、非標識乳酸9,22の最初のプールの存在下で、または添加しない非標識乳酸塩で監視することができ、ここに示されているように。 [1- 13 C]乳酸塩信号はviの中で測定されたことが示されています過分極[1- 13 C]ピルビン酸の注射後に(細胞内で含む)Voが原因でピルビン酸と乳酸の間ではなく、乳酸産生への高速ラベル交換に主である。6
私たちは、ここでLDHが、最初は乳酸を含むNMRチューブに注入し、超偏極[1- 13 C]ピルビン酸からの[1- 13 C]乳酸のリアルタイムの生産を提示します。
システムの説明
DNPの偏光子とNMR分光計:溶解DNPのセットアップで2つの主要な部分( 図1)があります。 DNP偏光子の主な要素は、ポンピングヘリウム浴に約1 Kにサンプルを冷却するクライオスタットです。クライオスタット3.35 T超電導マグネットに挿入された磁石のアイソセンタ( 図1)の偏光サンプルを有することを保証する形状を有しています。クライオスタットの内部に、試料(A)は、偏光bを測定するために、NMRコイル(B)に囲まれていますuildup、オーバーモードマイクロ波キャビティ(C)に含まれます。全サンプルは、ポンプヘリウム槽(d)の中で低温に保持し、導波管を介してマイクロ波を照射します。システム全体は、カスタムメイドのソフトウェア( 図2D)によって管理されています。
ハードウェアとDNPを実行するために必要な極低温機器とその後の溶解はまだ技術的な課題です。新しいDNPクライオスタット23,24が開発され、その極低温性能を測定するために試験した後、運転中の高速クールダウン、ヘリウム保持時間および全体的な最低限のヘリウム消費のために最適化しました。
クライオスタットは、2つの部分から構成されています。クライオスタットの最初の部分は概ね上部に分離することができる絶縁デュワー( 図2A)は、(A)尾部、または試料空間(B)と、外側真空容器(OVC)は、高真空とハウジング下に維持されます放射スクリーン(C)。クライオスタットの第二部は、メインでありますSERT( 図2B)、すべてのフロー規制が管理されている断熱デュワー、中に入れました。移送ライン(A)を介して外部記憶デュワーから液体ヘリウムは、(b)は分離器で凝縮第一段階であり、中間室は、クライオスタットコールドの頂部を保持し、蒸発したヘリウムを除去するための両方に使用されます転送中。分離器圧力は、クライオスタットの上部に巻き付け毛細管(C)を介してポンプで低下します。この毛細管における冷ヘリウムの流れは、バッフル(D)と絶縁デュワー(OVC)の放射スクリーンを冷却するために使用されます。サンプルは、サンプル空間に配置し、偏光されます。サンプル空間は、主クライオスタットインサートの尾部に巻き付け別の毛細管(E)を介して分離器に接続されています。この毛細管は、手動で外部から操作ニードル弁を介して開閉することができます。
DNP PR中に使用される低温を達成するためにocess、液体ヘリウムクライオスタット試料空間に収集することができる必要があり、その圧力はミリバールの範囲に下げ。クライオスタットの操作に必要な操作は、電子および電気機械的機器( 図2C)と異なる点で監視し、動作ポンプ3組ではなく、複雑なポンプシステムを介して実行されます。クライオスタットOVCは、第1ポンピング・システムによって高真空にポンピングする必要があります。このシステムは、ロータリーポンプ(A)によってバックアップターボ分子ポンプで構成されています。液体ヘリウムクライオスタットセパレータクライオスタット移送ラインの入口を介してストレージデュワー(B)から転送されます。セパレータは、第2ポンピング・セットに接続された出口を有します。このセットは、35 m 3の/時の膜ポンプ(C)で構成されています。この行はデュワーからとセパレータの冷却中転送中にゆでたヘリウムガスを除去することができます。セパレーターに収集された液体ヘリウムは、その後、キャップを介してサンプル空間に転送することができますillary管は、上記。サンプル空間に分離器から液体ヘリウムを転送するには、その後範囲をミリバールにサンプル空間の圧力を下げるために、時間ルーツは65メートル3 / hrでロータリーポンプ(d)でバックアップされたポンプ250メートル3 /からなる第3ポンプシステム手動バタフライバルブ(E)を介してクライオスタットに接続されています。
すべての真空システムの動作を制御し、電カスタムメイドのデバイス(F)によって調節されます。この装置は、クライオスタット分離器(g)及びサンプル空間(H)の出口、第二/第三ポンプシステム(C、D)、圧縮されたヘリウムボトル(i)と外部との間の真空ライン接続を制御します。 (F)と外部との間の通信は、一方向弁(j)を通過します。電気空気圧装置(F)と同様に、すべてのシステム・パラメータおよび溶解ハードウェアは共通のPCとUSBインターフェースカスタムメイドの電子デバイスによって制御され、運営されています。電子を通して最後に、すべてのシステム、デバイスは、関連する操作は、ソフトウェアのボタンを使用してインタフェースを介して起動されるカスタムメイドのスタンドアロンのソフトウェア( 図2D)によって管理されています。
サンプルを管理し、固体状態で挿入一連のNMRシグナルの蓄積を測定する( 図3A)に使用されます。偏光用のクライオスタットを準備するには、クライオスタットへの主要サンプルインサート(A)を、置きます。メインサンプルインサートはオーバーモード金メッキマイクロ波空洞の内部に配置NMRコイル(B)とを備えています。前凍結溶液を含む基板は、適切なサンプル容器に液体窒素温度(偏溶液)を偏光し、ガラス繊維試料ホルダー(C)の端下部にそれを配置することができます。磁石のアイソセンタに到達するために、メインサンプルインサート内に試料ホルダーをスライドさせます。サンプルホルダーに金メッキ導波路(d)を挿入します。導波路は、外部のマイクロ波源から発生したマイクロ波は、最小限の損失トンと一緒に旅行することができますサンプルO。
クライオスタット管理のためのカスタムメイドのソフトウェアは、(クライオスタットは、予め決定されたレベルに液体ヘリウムが充填されている充填、対応するインターフェースボタン、クールダウンのような異なる動作を(クライオスタット温度が近い液体ヘリウム温度に低下する)をクリックすると、自動的に処理し)、T≈1 K(液体ヘリウム槽が可能な最低温度を達成するためにポンピングされる)に冷却する追加のステップは、加圧(クライオスタットはリスクなしクライオスタットの開口部を可能にするために、わずかにPの室内圧力= 10から30ミリバールの上に加圧され、 )航空でクライオスタットの汚染の)および溶解(DNPのサンプルを溶解し、測定部位に生じた過分極ソリューションを転送するための自動処理、 すなわち 、NMR分光計。
分極は、分極磁場B 0に(94 GHzのマイクロ波を試料に照射が行われます</sUB> = 3.35 T)。サンプルはT DNPは、偏光蓄積時間である3 T DNP、後に完全に偏光考えられる。T DNPは、固体指定されたフィールドの状態と温度の目標核の縦緩和時間と同じオーダーの大きさです。すべての実験において、サンプルは、5つ以上のT DNPのために分極させました。
分極時間の終わりに、試料は、酵素活性の測定に使用するためのRT溶液に溶解されなければなりません。溶解プロセス中、溶解インサート( 図3B)のボイラからの過熱D 2 O 5mlをDNP増強試料に達し、それを溶解するために圧縮ヘリウムガス(P = 6~8バール)に押されています。得られた過分極溶液は溶解挿入口から、圧縮されたヘリウムガスにより溶解インサートを押し出される( 図3C-B </strong>)、2mMの内径のテフロン(登録商標)移送管。溶解工程に要する時間は300ミリ秒である。23 NMR分光計サイトへDNP偏光子からサ ンプル移送に必要な時間は約3秒です。
溶解プロセスは、溶解インサート( 図3B)を用いて行われます。溶解インサートは、電子空気式アセンブリで構成されている(a)は、サンプルと漏れのない連結を可能にする空気圧アセンブリボイラーと試料容器ロッカー(C)との間の接続管を含む炭素繊維棒(B)コンテナ、およびコンセントにバックアウト。電空アセンブリ( 図3C)を生成し、試料容器に炭素繊維棒を介して過熱D 2 Oを駆動した後、クライオスタットから過分極溶液を抽出するために使用されます。電空アセンブリは、同時の接続を制御する空気弁(A)で構成されていますmpressedヘリウム(P = 6~8バール)のライン(b)に示すように、炭素繊維棒を介してD 2 Oは、バルブ(D)を介して注入されるボイラー(c)は、出口(E)(F)。システムは、圧力G、温度計及びボイラー(C)における加熱抵抗ワイヤ、トリガー(H)と接続ボックス(I)の電子管理装置とシステムをインタフェースするために使用することによって完成します。
DNPクライオスタットとNMR分光計は、移送ライン、 すなわち、溶解がトリガされた過分極溶液は加圧されたヘリウムによって押された2mm内側の内径(P = 6~8バール)のPTFEチューブで接続されています。
溶解シーケンスは、以下の操作で構成されています。最初の300ミリ秒で、過熱D 2 Oは、過分極凍結溶液を融解し、溶解させるために試料容器にプッシュされます。その後、過分極溶液はPRESの平均値によってクライオスタットから抽出されます圧し(P = 6-8バー)注射は工程に記載された手順のいずれかを用いて行われる測定部位にヘリウムガスと2ミリメートル、内径のPTFEチューブを通して押され( 図3C-E)6.2.1または6.2ステップ0.2。
溶解DNP NMRセットアップの第二の成分は、NMR分光計です。本明細書中に記載のセットアップでは、NMR分光計は、 磁場 B 0 = 11.7テスラで動作します。 、5mmのNMRプローブは、溶解後過分極信号を測定するために使用されます。 NMR分光計は、固体状態と液体状態の両方NMR測定のために使用されるNMRコンソール、および会社が提供するソフトウェアXWINNMR介して操作されます。典型的な測定は、信号の取得に続いて(固体測定のために、liquidstateまたは未較正のために、キャリブレーションのいずれか)、低フリップ角ハードパルスで構成されています。
固体熱偏波信号とDNP由来のsiの測定gnalビルドアップNMR分光計に結合されたDNPの偏光子( 図3AB)の部位でのカスタムメイドの13 Cのコイルを使用して実行されます。この特定の状況ではNMR分光計は、信号のロックを実行しません。固体の測定が行われた場合に、偏光に著しい摂動を回避するために、取得の間の時間遅延は、大きく長い0.5 T DNPより、十分な長さであるべきです。
固体増強は以下のように定義されます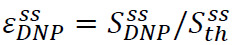 どこ
どこ![]() (ステップ3.3)で得られた過分極信号であり、
(ステップ3.3)で得られた過分極信号であり、 ![]() (ステップ3.2でくみ上げられた液体ヘリウム温度での熱平衡状態で得られた)固体状態信号( 図4A)です 。このパラメータd過分極溶液の転送中に不可避の損失の前にNMR実験のために利用可能な最大の偏光を、efines。測定は、未較正の低フリップ角パルスを用いる単パルス取得シーケンスを用いて行われます。パルスキャリブレーションは、一般的にsolidstate測定のためにスキップされます。
(ステップ3.2でくみ上げられた液体ヘリウム温度での熱平衡状態で得られた)固体状態信号( 図4A)です 。このパラメータd過分極溶液の転送中に不可避の損失の前にNMR実験のために利用可能な最大の偏光を、efines。測定は、未較正の低フリップ角パルスを用いる単パルス取得シーケンスを用いて行われます。パルスキャリブレーションは、一般的にsolidstate測定のためにスキップされます。
同様の手順は、液体状態の過分極シグナル増強を決定することができます。この場合には、注入前に分析管に入れた試料(ステップ6.2)D 2 O、500μlので構成されています溶解および注入後、監視するための2つの重要なパラメータがあります。最初は、NMR分光計サイトで過分極拡張機能です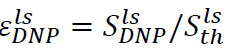 ( 図4B)、
( 図4B)、 ![]() ちょうどハイパーの注入後の信号であります (ステップ7.1)で得られた偏光液と
ちょうどハイパーの注入後の信号であります (ステップ7.1)で得られた偏光液と![]() (ステップ7.2)で得られた熱偏波信号です。第二は、基材と(ステップ7.1で得られた指数関数フィッティング信号により得られた)各代謝産物と関連する縦緩和時間T 1( 図4B、挿入図)、です。これら2つのパラメータは、十分な信号対雑音比(SNR)および代謝変換の測定のために利用可能な時間窓を得るために必要な最低限の基質濃度を規定します。固体分極の比
(ステップ7.2)で得られた熱偏波信号です。第二は、基材と(ステップ7.1で得られた指数関数フィッティング信号により得られた)各代謝産物と関連する縦緩和時間T 1( 図4B、挿入図)、です。これら2つのパラメータは、十分な信号対雑音比(SNR)および代謝変換の測定のために利用可能な時間窓を得るために必要な最低限の基質濃度を規定します。固体分極の比![]() そして、liquidstate偏光
そして、liquidstate偏光![]() 過分極溶液移送時の緩和に起因する偏光損失の推定を与えます。値ation12 "SRC =" /ファイル/ ftp_upload / 53548 / 53548equation12.jpg "幅=" 80 "/>リラクゼーション損失の非存在下で観察されるべきです。
過分極溶液移送時の緩和に起因する偏光損失の推定を与えます。値ation12 "SRC =" /ファイル/ ftp_upload / 53548 / 53548equation12.jpg "幅=" 80 "/>リラクゼーション損失の非存在下で観察されるべきです。
Protocol
Representative Results
Discussion
溶解DNP NMR実験の重要なポイントがある:(i)実験のために必要な最低の生成物濃度と同様に行わ及び(ii)可能な信号取得回数を決定した基板、のために達成分極レベル寿命偏光と検出サイト間および基板変換率への転送の持続時間に比べて、磁化。本明細書中に記載の溶解DNPセットアップの噴射システムは、わずか3-4として秒のサンプル転送を可能にします。転送はS.ボーエンとC.ヒルテ?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
著者は、有益な議論のための機器の選択と組み立てアシストするために博士のJJのファン・デル・クリンク、ならびに博士F.カテブ博士G. Berthoに感謝します。 ACは、スイス国立科学財団(PPOOP2_157547を付与する)によってサポートされていました。私たちは、パリソルボンヌシテ(NMR @コム、DIM解析、ヴィル・ド・パリ、財団デラRECHERCHEMédicale(FRM ING20130526708)、およびParteneriatヒューバートCurienブランクーシ32662QKから融資を認めている。私たちのチームはEquipexプログラムパリ・アン・共振の一部でありますそして、CACSICE。
Materials
| DNP polarizer | Vanderklink s.a.r.l (Switzerland) | /// | Cryostat and electronic equipment for sample polarization |
| Vacuum system components | Edwards vacuum (France) | Various |
– turbomolecular pumping setup – membrane pumping setup – high capacity roots pumping system – vacuum fittings and components |
| DNP 3.35T Magnet | Bruker (France) | ||
| 500MHz NMR Spectrometer | Bruker (France) | ||
| Origin 8.0 | OriginLab (US) | Data analysis software | |
| Chemicals | |||
| SODIUM PYRUVATE-1-13C, 99 ATOM % 13C | Sigma Aldrich (France) | 490709 | |
| ETHANOL-D6, ANHYDROUS, 99.5 ATOM % D | Sigma Aldrich (France) | 186414 | |
| 4-Hydroxy-TEMPO 97% | Sigma Aldrich (France) | 176141 | |
| Deuterium oxide | Sigma Aldrich (France) | 151882 | |
| reduced nicotinamide adenine dinucleotide (NADH) | Sigma Aldrich (France) | ||
| ethylene-diaminetetraacetic acid (EDTA) | Sigma Aldrich (France) | ||
| dithiothreitol (DTT) | Sigma Aldrich (France) | ||
| phosphate buffer, pH = 7.0 | Sigma Aldrich (France) | ||
| LDH enzyme in | Sigma Aldrich (France) | L-2500 | |
| bovine serum albumin, BSA | Sigma Aldrich (France) |
References
- Overhauser, A. W. Polarization of Nuclei in Metals. Phys. Rev. 92 (2), 411-415 (1953).
- Abragam, A., Goldman, M. Principles of dynamic nuclear polarisation. Rep. Prog. Phys. 41 (3), 395 (1978).
- Wolber, J., Ellner, F., et al. Generating highly polarized nuclear spins in solution using dynamic nuclear polarization. Nuc. Inst. Met. Phys. Res. Sec. A. 526 (1-2), 173-181 (2004).
- Cheng, T., Capozzi, A., Takado, Y., Balzan, R., Comment, A. Over 35% liquid-state 13C polarization obtained via dissolution dynamic nuclear polarization at 7 T and 1 K using ubiquitous nitroxyl radicals. PCCP. 15 (48), 20819-20822 (2013).
- Ardenkjaer-Larsen, J. H., Fridlund, B., et al. Increase in signal-to-noise ratio of > 10,000 times in liquid-state NMR. PNAS. 100 (18), 10158-10163 (2003).
- Day, S. E., Kettunen, M. I., et al. Detecting tumor response to treatment using hyperpolarized 13C magnetic resonance imaging and spectroscopy. Nat. Med. 13 (11), 1382-1387 (2007).
- Keshari, K. R., Wilson, D. M., et al. Hyperpolarized [2-13C]-Fructose: A Hemiketal DNP Substrate for In Vivo Metabolic Imaging. JACS. 131 (48), 17591-17596 (2009).
- Zeng, H., Lee, Y., Hilty, C. Quantitative Rate Determination by Dynamic Nuclear Polarization Enhanced NMR of a Diels−Alder Reaction. An. Chem. 82 (21), 8897-8902 (2010).
- Harrison, C., Yang, C., et al. Comparison of kinetic models for analysis of pyruvate-to-lactate exchange by hyperpolarized 13C NMR. NMR in Biom. 25 (11), 1286-1294 (2012).
- Allouche-Arnon, H., Gamliel, A., Sosna, J., Gomori, J. M., Katz-Brull, R. In vitro visualization of betaine aldehyde synthesis and oxidation using hyperpolarized magnetic resonance spectroscopy. Chem. Comm. 49 (63), 7076-7078 (2013).
- Lerche, M. H., Meier, S., et al. Quantitative dynamic nuclear polarization-NMR on blood plasma for assays of drug metabolism. NMR in Biom. 24 (1), 96-103 (2011).
- Nelson, S. J., Kurhanewicz, J., et al. Metabolic Imaging of Patients with Prostate Cancer Using Hyperpolarized [1-13C]Pyruvate. Sci. Trans. Med. 5 (198), 198ra108 (2013).
- Kurhanewicz, J., Vigneron, D. B., et al. Analysis of Cancer Metabolism by Imaging Hyperpolarized Nuclei: Prospects for Translation to Clinical Research. Neoplasia. 13 (2), 81-97 (2011).
- Comment, A., Merritt, M. E. Hyperpolarized Magnetic Resonance as a Sensitive Detector of Metabolic Function. Biochem. 53 (47), 7333-7357 (2014).
- Carravetta, M., Johannessen, O. G., Levitt, M. H. Beyond the T-1 limit: Singlet nuclear spin states in low magnetic fields. PRL. 92 (15), 153003 (2004).
- Carravetta, M., Levitt, M. H. Theory of long-lived nuclear spin states in solution nuclear magnetic resonance. I. Singlet states in low magnetic field. J. Chem. Phys. 122 (21), 214505 (2005).
- Vasos, P. R., Comment, A., et al. Long-lived states to sustain hyperpolarized magnetization. PNAS. 106 (44), 18469-18473 (2009).
- Claytor, K., Theis, T., Feng, Y., Warren, W. Measuring long-lived 13C2 state lifetimes at natural abundance. JMR. 239, 81-86 (2014).
- Pileio, G., Carravetta, M., Hughes, E., Levitt, M. H. The long-lived nuclear singlet state of N-15-nitrous oxide in solution. JACS. 130 (38), 12582-12583 (2008).
- Stevanato, G., Hill-Cousins, J. T., et al. A Nuclear Singlet Lifetime of More than One Hour in Room-Temperature Solution. Ange. Chem. Int. Ed. 54 (12), 3740-3743 (2015).
- Ghosh, R. K., Kadlecek, S. J., et al. Measurements of the Persistent Singlet State of N(2)O in Blood and Other Solvents-Potential as a Magnetic Tracer. MRM. 66 (4), 1177-1180 (2011).
- Harris, T., Eliyahu, G., Frydman, L., Degani, H. Kinetics of hyperpolarized 13C1-pyruvate transport and metabolism in living human breast cancer cells. PNAS. 106 (43), 18131-18136 (2009).
- Comment, A., van den Brandt, B., et al. Design and performance of a DNP prepolarizer coupled to a rodent MRI scanner. Conc. Mag. Res. B. 31 (4), 255-269 (2007).
- Balzan, R. . Methods for Molecular Magnetic Resonance Imaging and Magnetic Resonance Spectroscopy using Hyperpolarized Nuclei. 5966, 1-140 (2013).
- Bornet, A., Melzi, R., et al. Boosting Dissolution Dynamic Nuclear Polarization by Cross Polarization. JPC Letters. 4 (1), 111-114 (2013).
- Bowen, S., Hilty, C. Rapid sample injection for hyperpolarized NMR spectroscopy. PCCP. 12 (22), 5766-5770 (2010).
- Cavadini, S., Vasos, P. R. Singlet states open the way to longer time-scales in the measurement of diffusion by NMR spectroscopy. Conc. Mag. Res. A. 32 (1), 68-78 (2008).
- Ahuja, P., Sarkar, R., Vasos, P. R., Bodenhausen, G. Long-lived States in Multiple-Spin Systems. Chem. Phys. Chem. 10 (13), 2217-2220 (2009).
- Ahuja, P., Sarkar, R., Jannin, S., Vasos, P. R., Bodenhausen, G. Proton hyperpolarisation preserved in long-lived states. Chem. Comm. 46 (43), 8192-8194 (2010).
- Sarkar, R., Comment, A., et al. Proton NMR of 15N-Choline Metabolites Enhanced by Dynamic Nuclear Polarization. JACS. 131 (44), 16014-16015 (2009).

