Imaging Membrane Potential mit zwei Arten von genetisch kodierten Fluorescent Spannungssensoren
Summary
A method for imaging changes in membrane potential using genetically encoded voltage indicators is described.
Abstract
Genetically encoded voltage indicators (GEVIs) have improved to the point where they are beginning to be useful for in vivo recordings. While the ultimate goal is to image neuronal activity in vivo, one must be able to image activity of a single cell to ensure successful in vivo preparations. This procedure will describe how to image membrane potential in a single cell to provide a foundation to eventually image in vivo. Here we describe methods for imaging GEVIs consisting of a voltage-sensing domain fused to either a single fluorescent protein (FP) or two fluorescent proteins capable of Förster resonance energy transfer (FRET) in vitro. Using an image splitter enables the projection of images created by two different wavelengths onto the same charge-coupled device (CCD) camera simultaneously. The image splitter positions a second filter cube in the light path. This second filter cube consists of a dichroic and two emission filters to separate the donor and acceptor fluorescent wavelengths depending on the FPs of the GEVI. This setup enables the simultaneous recording of both the acceptor and donor fluorescent partners while the membrane potential is manipulated via whole cell patch clamp configuration. When using a GEVI consisting of a single FP, the second filter cube can be removed allowing the mirrors in the image splitter to project a single image onto the CCD camera.
Introduction
Der Schwerpunkt dieses Aufsatzes ist das optische Abbildungsveränderungsmembranpotentiale in vitro zu zeigen, unter Verwendung von genetisch kodierten fluoreszierenden Proteinen. Imaging Änderungen des Membranpotentials bietet die aufregende Möglichkeit, die Aktivität von neuronalen studieren. Wenn Änderungen des Membranpotentials führen zu einer Veränderung der Fluoreszenzintensität, wird jedes Pixel der Kamera ein Surrogat Elektrode eingriffsfreien Messung der neuronalen Aktivität ermöglicht. Seit über vierzig Jahren, organische spannungsabhängigen Farbstoffen wurden zur Beobachtung der Veränderungen des Membranpotentials 4.1 nützlich. Jedoch fehlt diesen Farbstoffen zelluläre Spezifität. Darüber hinaus sind einige Zelltypen schwierig zu färben. Genetisch kodierte Spannungsanzeigen (GeViS) überwinden diese Einschränkungen durch die Zellen spezifisch ausdrücken die fluoreszierende spannungsempfindliche Sonde untersucht werden müssen.
Es gibt drei Klassen von GeViS. Die erste Klasse von GEVI verwendet die vorsorgungs–Sensing-Domain von der Spannungsfühl Phosphatase entweder mit einem einzelnen fluoreszierenden Protein (FP) 5-9 oder ein Förster-Resonanzenergietransfer (FRET) Paar 10-12. Die zweite Klasse von Sensoren verwendet mikrobiellen Rhodopsin als Fluoreszenzindikator direkt 13-15 oder über elektrochromen FRET 16,17. Die dritte Klasse verwendet zwei Komponenten, die genetische Komponente eine Membran verankert FP und eine zweite Komponente, die eine membrangebundene Abschrecken Farbstoff ist 18-20 ist. Während die zweiten und dritten Klassen, die für in vitro und Scheibe Experimente sind 19,20, nur die erste Klasse von Sensoren liegen noch nützlich für die in vivo 6 analysiert.
In diesem Bericht werden wir die Darstellung von Membranpotential unter Verwendung der ersten Klasse von GeViS (Abbildung 1) in vitro zeigen. Diese erste Klasse von Spannungssensoren ist am einfachsten zu in-vivo-Bildgebung übergeht. Seit GeViS utilizing eine Spannung fühlenden Domain auf einen FP verschmolzen sind etwa 50-fach heller als das Rhodopsin Klasse von Sensoren, können sie eher als einen extrem leistungsfähigen Laser erfordern mit Bogenlampe Beleuchtung abgebildet werden. Eine weitere Folge der Unterschiede in der Helligkeit ist, dass die erste Klasse von GeViS leicht die Autofluoreszenz des Gehirns übersteigen kann. Die Rhodopsin-basierte Sonden kann es nicht. Die dritte Klasse von Sensor ist ebenso hell wie die erste Klasse erfordert aber die Zugabe eines chemischen Quencher, die schwierig in vivo zu verabreichen.
Wir werden daher zeigen die Übernahme einer Sonde mit einem einzigen FP (Bongwoori) 8 und eine Sonde, bestehend aus einem FRET-Paar (Nabi 2) 12. Die FRET-Konstrukte in diesem Bericht sind Schmetterling Versionen VSFP-CR (spannungssensitiven Fluoreszenzproteine - Klee-mRuby2) 11, bestehend aus einem grün fluoreszierenden Spender, Klee, und ein rot fluoreszierendes Akzeptor, mRuby2 namens Nabi 2.242 und 2.244 Nabi <sbis> 12. Die Einführung auf diese Arten von Aufnahmen sollten Forscher geben ein besseres Verständnis der Art der Informationen GeViS bereitstellen kann.
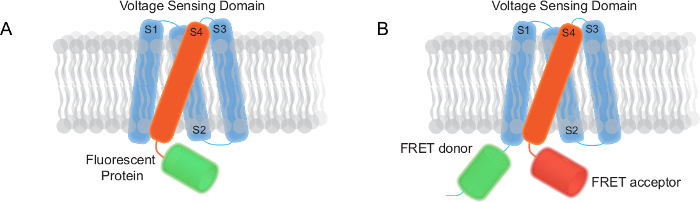
Abbildung 1. Zwei Arten von genetisch kodierte Spannungsanzeiger (GeViS) abgebildet in diesem Bericht (A) ein FP Mono basierend GEVI ein Transmembranspannung-Sensing-Domäne und ein fluoreszierendes Protein mit. (B) Ein FRET basierten GEVI bestehend aus einem Transmembranspannung-Sensing-Domäne, einer FRET-Donor und Akzeptor. Bitte hier klicken, um eine größere Version dieser Figur zu sehen.
Protocol
Representative Results
Discussion
Das Nervensystem verwendet Spannung auf mehrere verschiedene Arten, Hemmung verursacht eine leichte Hyperpolarisation, synaptischen Eingangs bewirkt eine leichte Depolarisation und ein Aktionspotential führt zu einer relativ großen Spannungsänderung. Die Fähigkeit von GeViS Änderungen des Membranpotentials zu messen bietet das vielversprechende Potential von gleichzeitig mehreren Komponenten neuronaler Schaltkreise analysieren. In diesem Bericht zeigen wir eine grundlegende Methode zur Bildgebung Änderungen des Me…
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by the World Class Institute (WCI) program of the National Research Foundation of Korea funded by Ministry of Education, Science, and Technology of Korea Grant WCI 2009-003 and Korea Institute of Science and Technology Institutional Program Project 2E24210. Sungmoo Lee was supported by Global Ph.D. Fellowship program (NRF-2013H1A2A1033344) of the National Research Foundation (NRF) under the Ministry of Education (MOE, Korea).
Materials
| Inverted Microscope | Olympus | IX71 | |
| 60X objective lens (numerical aperture = 1.35) | Olympus | UPLSAPO 60XO | |
| Excitation filter | Semrock | FF02-472/30 | For voltage imaging of super ecliptic pHluorin in Bongwoori |
| Dichroic mirror | Semrock | FF495-Di03-25×36 | |
| Emission filter | Semrock | FF01-497/LP | |
| 75W Xenon arc lamp | CAIRN | OptoSource Illuminator | LEDs and lasers are also effective light sources |
| Slow speed CCD camera | Hitachi | KP-D20BU | |
| Dual port camera adaptor | Olympus | U-DPCAD | |
| High speed CCD camera | RedShirtImaging, LLC | NeuroCCD-SM | |
| Image splitter | CAIRN | Optosplit 2 | |
| Excitation filter | Semrock | FF01-475/23-25 | For voltage imaging of FRET pair based GEVI consisting of Clover and mRuby2) |
| Dichroic mirror | Semrock | FF495-Di03-25×36 | |
| Emission filter | Chroma | ET520/40 | |
| Dichroic mirror | Semrock | FF560-FDi01-25X36 | |
| Emission filter | Chroma | ET645/75 | |
| Vibration isolation system | Kinetic systems | 250BM-IC, 5702E-3036-31 | |
| Patching chamber | Warner instruments | RC-26G, 64-0235 | |
| #0 Micro Coverglass (22x40mm) | Electron Microscopy Sciences | 72198-20 | |
| Temperature controller | Warner instruments | TC-344B | |
| #0 (0.08~0.13mm) – 10mm diameter glass coverslip | Ted Pella | 260366 | |
| Lipofection agent | Life Technologies | 11668-027 | |
| Calcium phosphate reagent | Clontech – Takara | 631312 | |
| Patch clamp amplifier | HEKA | EPC 10 USB amplifier | |
| Multi-channel data acquisition software | HEKA | Patchmaster | |
| Image acquisition and analysis software | RedShirtImaging | Neuroplex | |
| Spreadsheet application software | Microsoft | Microsoft Excel 2010 | |
| Data analysis software | OriginLab | OriginPro 8.6.0 | |
| Demagnifier | Qioptiq LINOS | Optem standard camera coupler 0.38x SC38 J clamp | |
| Confocal microscope | Nikon | Nikon A1R confocal microscope | |
| Anti-fade reagent | Life Technologies | P36930 |
References
- Salzberg, B. M., Davila, H. V., Cohen, L. B. Optical recording of impulses in individual neurones of an invertebrate central nervous system. Nature. 246, 508-509 (1973).
- Cohen, L. B., et al. Changes in axon fluorescence during activity: molecular probes of membrane potential. J. Membrane Biol. 19, 1-36 (1974).
- Tasaki, I., Warashina, A. Dye-membrane interaction and its changes during nerve excitation. Photochem Photobiol. 24, 191-207 (1976).
- Grinvald, A., Hildesheim, R. VSDI: a new era in functional imaging of cortical dynamics. Nat Rev Neurosci. 5, 874-885 (2004).
- Jin, L., Han, Z., Platisa, J., Wooltorton, J. R., Cohen, L. B., Pieribone, V. A. Single action potentials and subthreshold electrical events imaged in neurons with a fluorescent protein voltage probe. Neuron. 75, 779-785 (2012).
- Cao, G., Platisa, J., Pieribone, V. A., Raccuglia, D., Kunst, M., Nitabach, M. N. Genetically targeted optical electrophysiology in intact neural circuits. Cell. 154, 904-913 (2013).
- St-Pierre, F., Marshall, J. D., Yang, Y., Gong, Y., Schnitzer, M. J., Lin, M. Z. High-fidelity optical reporting of neuronal electrical activity with an ultrafast fluorescent voltage sensor. Nat Neurosci. 17, 884-889 (2014).
- Piao, H. H., Rajakumar, D., Kang, B. E., Kim, E. H., Baker, B. J. Combinatorial mutagenesis of the voltage-sensing domain enables the optical resolution of action potentials firing at 60 Hz by a genetically encoded fluorescent sensor of membrane potential. J Neurosci. 35, 372-385 (2015).
- Jung, A., Garcia, J. E., Kim, E., Yoon, B. J., Baker, B. J. Linker length and fusion site composition improve the optical signal of genetically encoded fluorescent voltage sensors. Neurophoton. 2, 021012 (2015).
- Dimitrov, D., et al. Engineering and characterization of an enhanced fluorescent protein voltage sensor. PLoS One. 2, e440 (2007).
- Lam, A. J., et al. Improving FRET dynamic range with bright green and red fluorescent proteins. Nat Methods. 9, 1005-1012 (2012).
- Sung, U., et al. Developing fast fluorescent protein voltage sensors by optimizing FRET interactions. PLoS One. 10, e0141585 (2015).
- Kralj, J. M., Douglass, A. D., Hochbaum, D. R., Maclaurin, D., Cohen, A. E. Optical recording of action potentials in mammalian neurons using a microbial rhodopsin. Nat Methods. 9, 90-95 (2012).
- Flytzanis, N. C., et al. Archaerhodopsin variants with enhanced voltage-sensitive fluorescence in mammalian and Caenorhabditis elegans neurons. Nat Commun. 5, 4894 (2014).
- Hochbaum, D. R., et al. All-optical electrophysiology in mammalian neurons using engineered microbial rhodopsins. Nat Methods. 11, 825-833 (2014).
- Gong, Y., Wagner, M. J., Zhong Li, J., Schnitzer, M. J. Imaging neural spiking in brain tissue using FRET-opsin protein voltage sensors. Nat Commun. 5, 3674 (2014).
- Zou, P., et al. Bright and fast multicoloured voltage reporters via electrochromic FRET. Nat Commun. 5, 4625 (2014).
- Chanda, B., Blunck, R., Faria, L. C., Schweizer, F. E., Mody, I., Bezanilla, F. A hybrid approach to measuring electrical activity in genetically specified neurons. Nat Neurosci. 8, 1619-1626 (2005).
- Wang, D., McMahon, S., Zhang, Z., Jackson, M. B. Hybrid voltage sensor imaging of electrical activity from neurons in hippocampal slices from transgenic mice. J Neurophysiol. 108, 3147-3160 (2012).
- Weigel, S., Flisikowska, T., Schnieke, A., Luksch, H. Hybrid voltage sensor imaging of eGFP-F expressing neurons in chicken midbrain slices. J Neurosci Methods. 233, 28-33 (2014).
- Waters, J. C., Sluder, G., Wolf, D. E. Live-Cell Fluorescence Imaging. Methods in Cell Biology Volume 81. , 115-140 (2007).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nat Protoc. 1, 2406-2415 (2006).
- Beaudoin, G. M., et al. Culturing pyramidal neurons from the early postnatal mouse hippocampus and cortex. Nat Protoc. 7, 1741-1754 (2012).
- Jiang, M., Chen, G. High Ca2+-phosphate transfection efficiency in low-density neuronal cultures. Nat Protoc. 1, 695-700 (2006).
- Molleman, A. . Patch clamping: an introductory guide to patch clamp electrophysiology. , 101-102 (2003).
- Osorio, N., Delmas, P. Patch clamp recording from enteric neurons in situ. Nat Protoc. 6, 15-27 (2010).
- Schroder, M., Kaufman, R. J. The mammalian unfolded protein response. Annu Rev Biochem. 74, 739-789 (2005).
- Wilt, B. A., Fitzgerald, J. E., Schnitzer, M. J. Photon shot noise limits on optical detection of neuronal spikes and estimation of spike timing. Biophys J. 104, 51-62 (2013).
- Lundby, A., Mutoh, H., Dimitrov, D., Akemann, W., Knopfel, T. Engineering of a genetically encodable fluorescent voltage sensor exploiting fast Ci-VSP voltage-sensing movements. PLoS One. 3, e2514 (2008).
- Peterka, D. S., Takahashi, H., Yuste, R. Imaging voltage in neurons. Neuron. 69, 9-21 (2011).

