Un método rápido para el procesamiento de sangre para aumentar el rendimiento de los niveles plasmáticos de péptido en la sangre humana
Summary
El método de transformación rápida de sangre se puede utilizar en los seres humanos y los rendimientos más altos niveles de péptidos, así como permite la evaluación de la forma molecular correcto. Por lo tanto, este método será una herramienta valiosa en la investigación de péptidos.
Abstract
La investigación en el campo de la regulación de la ingesta de alimentos está ganando importancia. Esto a menudo incluye la medición de péptidos que regulan la ingesta de alimentos. Para la correcta determinación de la concentración de un péptido, debería ser estable durante el procesamiento de sangre. Sin embargo, este no es el caso para varios péptidos que se degradan rápidamente por peptidasas endógenas. Recientemente, hemos desarrollado un método de procesamiento de la sangre empleando temperaturas R relucida, cidification A, P rotease inhibición, que sotopic controles exógenos y ilution D (RAPID) para el uso en ratas. Aquí, hemos establecido esta técnica para el uso en seres humanos y se investigó la recuperación, forma molecular y haciendo circular la concentración de las hormonas reguladoras de consumo de alimentos. El método RAPID mejoró significativamente la recuperación de 125 somatostatina-28 (+ 39%) marcado con I, péptido similar al glucagón-1 (+ 35%), la grelina de acilo y glucagón (+ 32%), la insulina y kisspectina (+ 29% ), nesfatin-1 (+ 28%), la leptina(+ 21%) y el péptido YY 3-36 (+ 19%) en comparación con el procesamiento estándar (sangre con EDTA en hielo, p <0,001). cromatografía de líquidos de alto rendimiento mostró que la elución de la grelina acilo endógeno en la posición esperada después de un procesamiento rápido, mientras que después del procesamiento estándar 62% de la grelina acilo se degrada lo que resulta en un pico anterior probable que representa la grelina desacil. Después de un rápido procesamiento de la relación de la grelina acilo / desacil en la sangre de los sujetos de peso normal fue de 1: 3 en comparación con 01:23, tras su transformación estándar (p = 0,03). También los niveles endógenos Kisspeptina fueron mayores después de RAPID en comparación con el procesamiento estándar (+ 99%, p = 0,02). El método de procesamiento de sangre RAPID se puede utilizar en los seres humanos, produce niveles de péptido más altas y permite la evaluación de la forma molecular correcta.
Introduction
A la luz de la creciente prevalencia de la obesidad en todo el mundo 1,2, la investigación en el campo de la regulación de la ingesta de alimentos está ganando importancia. Mientras que se conoce hasta ahora sólo un péptido que se produce en la periferia y de acción central para estimular la ingesta de alimentos, a saber, la grelina 3, dentro de las últimas décadas, una amplia gama de péptidos se ha identificado que reducen la ingesta de alimentos, por ejemplo. la leptina, el péptido YY (PYY) y también péptido similar al glucagón-1 (GLP-1) y la insulina 4, Por lo tanto, en los estudios que investigan los mecanismos de regulación de los niveles de hambre y de péptidos de saciedad a menudo se evalúa y, al mismo tiempo, se supone que el péptido estudiado es estable y se recuperó en altos rendimientos durante la formación de plasma. Sin embargo, muy a menudo esto no es el caso debido a la rápida descomposición endógena como se muestra antes de para, por ejemplo. grelina que se degrada de acilo a desacil grelina 5. Por lo tanto, hemos descrito recientemente el método rápido para elaboración de sangrecantar en ratas que emplean temperaturas R relucida, cidification A, P rotease inhibición, que sotopic controles exógenos y ilution D 6. Este método mejoró la recuperación para 11 de 12 péptidos ensayados y permitidos para la determinación de la forma molecular de circulación correcta en comparación con el procesamiento de sangre estándar (sangre EDTA en hielo) 6. Este método se ha utilizado en varios estudios posteriores 7-12 para la detección de circulación de la grelina, así como factor de 13 de liberación de corticotropina. Por lo tanto, el método ha demostrado ser útil para la investigación de péptidos en los roedores. Sin embargo, ya que los estudios de roedores no son siempre traducible a otra especie, el método debe ser establecido para el uso en la sangre humana también.
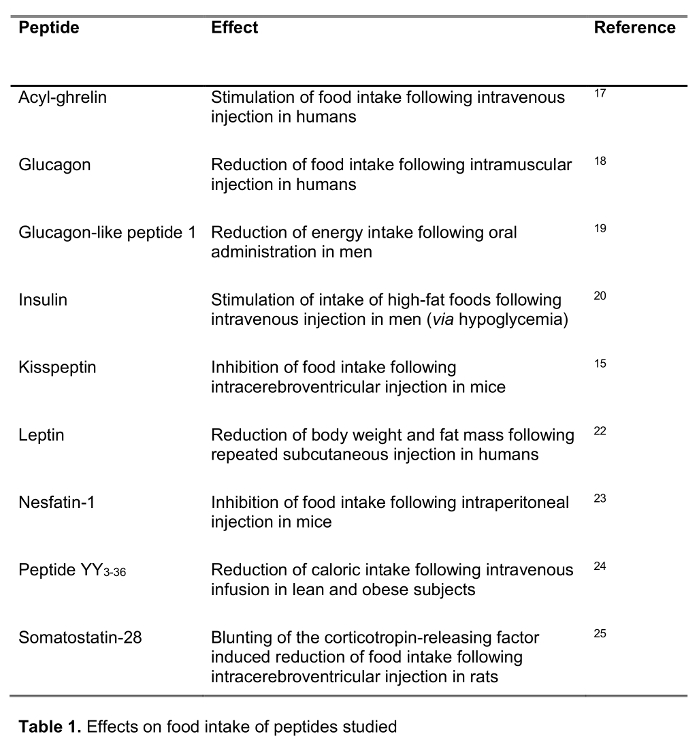
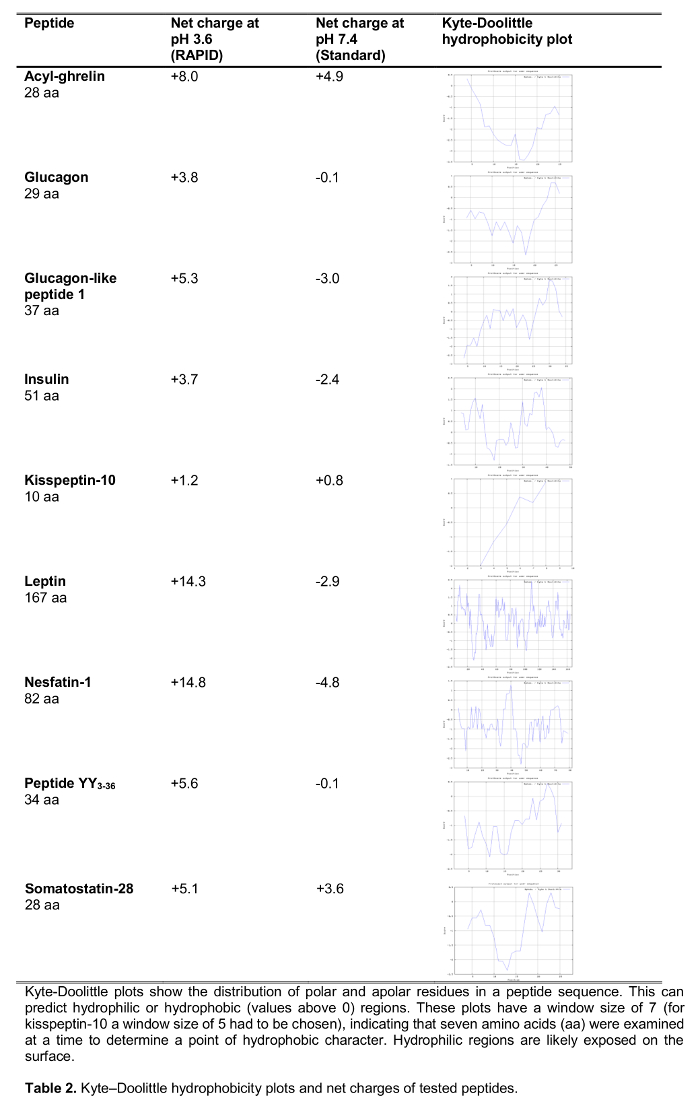
El objetivo del presente estudio fue probar el método rápido para el procesamiento de sangre en los seres humanos en comparación con el estándar de procesamiento de la sangre, la sangre EDTA sobre hielo, que es ampliamente recomendado y con frecuencia u 14sed en el ámbito clínico, así como la investigación. Hemos probado la recuperación de una selección de 125 péptidos marcados-I que participan en la regulación de la ingesta de alimentos incluyendo péptidos establecidos, así como nuevos candidatos recientemente propuesto para desempeñar un papel en la alimentación de regulación (efectos sobre la ingesta de alimentos se muestran en la Tabla 1) tras su procesamiento con ambos métodos. Las hormonas también fueron elegidos para representar péptidos de diferente longitud y carga (Tabla 2). Por otra parte, para la grelina se investigó la forma molecular (s) siguiendo el método estándar y rápida. Por último, se evaluó la grelina endógena (acilo y grelina desacil), así como los niveles de Kisspeptina, un péptido también sugerido recientemente que desempeñar un papel en la regulación de la ingesta de alimentos 15,16 tras un procesamiento rápido o estándar. Además, también se investigó estos niveles de péptidos en una población de sujetos con una amplia gama de índice de masa corporal (que va de 10.2-67.6 kg / m 2) para estudiar possibLe diferencias relacionadas con el peso corporal alterada crónicamente.
Diagnóstico, evaluación, y el Plan:
Los participantes del estudio
Todos los participantes del estudio fueron pacientes recientemente hospitalizados (inclusión fue dentro de los dos días de ingreso en el hospital) de la División de Medicina Psicosomática en la Charité-Universidad de Berlín y dieron su consentimiento informado por escrito. Para evitar cualquier impacto de género sólo se incluyeron pacientes de sexo femenino. Un total de 42 sujetos participaron en este estudio y se dividieron en tres grupos: peso normal (IMC de 18,5-25 kg / m 2, n = 12), la anorexia nerviosa (IMC <17,5 kg / m 2, n = 15) y obesidad (IMC> 30 kg / m 2, n = 15). Anoréxica y los pacientes eran obesosdiagnosticados de acuerdo con la Clasificación Internacional de Enfermedades-10 y hospitalizados por el aumento de peso (anorexia nerviosa) o la reducción de peso (obesidad), respectivamente. Todos los pacientes con peso normal fueron hospitalizados exclusivamente debido a los síntomas somáticos sin trastornos somáticos relevantes. Se excluyeron los pacientes con síntomas gastrointestinales somatomorfos o con antecedentes de cirugía gastrointestinal. Los criterios de exclusión abarcaron también una edad <18 años, embarazo actual y las enfermedades psicóticas no tratados. La recogida de sangre se realizó el día 2 o 3 después de la admisión hospitalaria antes de recibir tratamiento dietético con el fin de aumentar o reducir el peso corporal, respectivamente. parámetros antropométricos fueron evaluados en el mismo día.
Protocol
Representative Results
Discussion
Hemos informado anteriormente que el método rápido para el procesamiento de la sangre mejoró la recuperación de 11/12 péptidos en comparación con el procesamiento de sangre estándar en ratas 6. En el presente estudio hemos demostrado que este método también es adecuado para el uso en seres humanos. Después de un rápido procesamiento, la recuperación de 9 de 9 125 péptidos marcados-I probado se mejoró en comparación con el procesamiento de sangre estándar (sangre con EDTA en hielo). …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Este trabajo fue apoyado por la Fundación Alemana para la Investigación STE 1765 / 3-1 (AS) y el Ministerio alemán de Educación e Investigación 03IPT614A (CG). Agradecemos a Reinhard Lommel y Petra Buße por su excelente apoyo técnico, así como Karin Johansson y Christina Hentzschel para obtener ayuda con la organización y la ejecución de las medidas antropométricas
Materials
| diprotin A | Peptides International, Louisville, KY, USA | IDP-4132 | |
| E-64-d | Peptides International, Louisville, KY, USA | IED-4321-v | |
| antipain | Peptides International, Louisville, KY, USA | IAP-4062 | |
| leupeptin | Peptides International, Louisville, KY, USA | ILP-4041 | |
| chymostatin | Peptides International, Louisville, KY, USA | ICY-4063 | |
| Sep-Pak C18 cartridges | Waters Corporation, Milford, MA, USA | WAT051910 | 360 mg, 55-105 µm |
| acyl-ghrelin | Millipore, Billerica, MA, USA | 9088-HK | Radioactive |
| GLP-1 | Millipore, Billerica, MA, USA | 9035-HK | Radioactive |
| glucagon | Millipore, Billerica, MA, USA | 9030 | Radioactive |
| insulin | Millipore, Billerica, MA, USA | 9011S | Radioactive |
| leptin | Millipore, Billerica, MA, USA | 9081-HK | Radioactive |
| kisspeptin-10 | Phoenix Pharmaceuticals, Burlingame, CA, USA | T-048-56 | Radioactive |
| nesfatin-1 | Phoenix Pharmaceuticals, Burlingame, CA, USA | T-003-26 | Radioactive |
| PYY3-36 | Phoenix Pharmaceuticals, Burlingame, CA, USA | T-059-02 | Radioactive |
| somatostatin-28 | Phoenix Pharmaceuticals, Burlingame, CA, USA | T-060-16 | Radioactive |
| ZORBAX Rapid Resolution HT SB-C18 column | Agilent Technologies, Santa Clara, CA, USA | 822700-902 | 2.1 x 50 mm, 1.8 µm |
| Agilent 1200 LC | Agilent Technologies, Santa Clara, CA, USA | HPLC, several components, therefore no single catalog number | |
| Kisspeptin RIA | Phoenix Pharmaceuticals, Burlingame, CA, USA | # RK-048-56 | Radioactive |
| Total ghrelin RIA | Millipore, Billerica, MA, USA | # GHRT-89HK | Radioactive |
| Active ghrelin RIA | Millipore, Billerica, MA, USA | # GHRA-88HK | Radioactive |
| SigmaStat 3.1 | Systat Software, San Jose, CA, USA | online download |
References
- Finucane, M. M., et al. National, regional, and global trends in body-mass index since 1980: systematic analysis of health examination surveys and epidemiological studies with 960 country-years and 9.1 million participants. Lancet. 377 (9765), 557-567 (2011).
- James, W. P. The epidemiology of obesity: the size of the problem. J Intern Med. 263 (4), 336-352 (2008).
- Stengel, A., Taché, Y. Gastric peptides and their regulation of hunger and satiety. Curr Gastroenterol Rep. 14 (6), 480-488 (2012).
- Hussain, S. S., Bloom, S. R. The regulation of food intake by the gut-brain axis: implications for obesity. Int J Obes (Lond). 37 (5), 625-633 (2013).
- Hosoda, H., et al. Optimum collection and storage conditions for ghrelin measurements: octanoyl modification of ghrelin is rapidly hydrolyzed to desacyl ghrelin in blood samples). Clin Chem. 50 (6), 1077-1080 (2004).
- Stengel, A., et al. The RAPID method for blood processing yields new insight in plasma concentrations and molecular forms of circulating gut peptides. Endocrinology. 150 (11), 5113-5118 (2009).
- Stengel, A., et al. Lipopolysaccharide differentially decreases plasma acyl and desacyl ghrelin levels in rats: Potential role of the circulating ghrelin-acylating enzyme GOAT. Peptides. 31 (9), 1689-1696 (2010).
- Stengel, A., et al. Cold ambient temperature reverses abdominal surgery-induced delayed gastric emptying and decreased plasma ghrelin levels in rats. Peptides. 31, 2229-2235 (2010).
- Stengel, A., et al. Central administration of pan-somatostatin agonist ODT8-SST prevents abdominal surgery-induced inhibition of circulating ghrelin, food intake and gastric emptying in rats. Neurogastroenterol Motil. 23 (7), e294-e308 (2011).
- Stengel, A., et al. Abdominal surgery inhibits circulating acyl ghrelin and ghrelin-O-acyltransferase levels in rats: role of the somatostatin receptor subtype 2. Am J Physiol Gastrointest Liver Physiol. 301, G239-G248 (2011).
- Wang, L., et al. Intravenous injection of urocortin 1 induces a CRF2 mediated increase in circulating ghrelin and glucose levels through distinct mechanisms in rats. Peptides. 39, 164-170 (2013).
- Goebel-Stengel, M., Stengel, A., Wang, L., Taché, Y. Orexigenic response to tail pinch: role of brain NPY(1) and corticotropin releasing factor receptors. Am J Physiol Regul Integr Comp Physiol. 306 (3), R164-R174 (2014).
- Goebel, M., Stengel, A., Wang, L., Reeve, J., Taché, Y. Lipopolysaccharide increases plasma levels of corticotropin-releasing hormone in rats. Neuroendocrinology. 93 (3), 165-173 (2011).
- Banfi, G., Salvagno, G. L., Lippi, G. The role of ethylenediamine tetraacetic acid (EDTA) as in vitro anticoagulant for diagnostic purposes. Clin Chem Lab Med. 45 (5), 565-576 (2007).
- Stengel, A., Wang, L., Goebel-Stengel, M., Taché, Y. Centrally injected kisspeptin reduces food intake by increasing meal intervals in mice. Neuroreport. 22 (5), 253-257 (2011).
- De Bond, J. A., Smith, J. T. Kisspeptin and energy balance in reproduction. Reproduction. 147 (3), R53-R63 (2014).
- Wren, A. M., et al. Ghrelin enhances appetite and increases food intake in humans. J Clin Endocrinol Metab. 86 (12), 5992 (2001).
- Schulman, J. L., Carleton, J. L., Whitney, G., Whitehorn, J. C. Effect of glucagon on food intake and body weight in man. J Appl Physiol. 11 (3), 419-421 (1957).
- Steinert, R. E., Poller, B., Castelli, M. C., Drewe, J., Beglinger, C. Oral administration of glucagon-like peptide 1 or peptide YY 3-36 affects food intake in healthy male subjects. Am J Clin Nutr. 92 (4), 810-817 (2010).
- Dewan, S., et al. Effects of insulin-induced hypoglycaemia on energy intake and food choice at a subsequent test meal. Diabetes Metab Res Rev. 20 (5), 405-410 (2004).
- Schlogl, M., et al. Increased 24-hour ad libitum food intake is associated with lower plasma irisin concentrations the following morning in adult humans. Appetite. 90, 154-159 (2015).
- Heymsfield, S. B., et al. Recombinant leptin for weight loss in obese and lean adults: a randomized, controlled, dose-escalation trial. JAMA. 282 (16), 1568-1575 (1999).
- Shimizu, H., et al. Peripheral administration of nesfatin-1 reduces food intake in mice: the leptin-independent mechanism. Endocrinology. 150, 662-671 (2009).
- Batterham, R. L., et al. Inhibition of food intake in obese subjects by peptide YY3-36. N Engl J Med. 349 (10), 941-948 (2003).
- Shibasaki, T., et al. Antagonistic effect of somatostatin on corticotropin-releasing factor-induced anorexia in the rat. Life Sci. 42 (3), 329-334 (1988).
- Goebel-Stengel, M., Stengel, A., Taché, Y., Reeve, J. R. The importance of using the optimal plasticware and glassware in studies involving peptides. Anal Biochem. 414 (1), 38-46 (2011).
- Smets, E. M., et al. Decreased plasma levels of metastin in early pregnancy are associated with small for gestational age neonates. Prenat Diagn. 28 (4), 299-303 (2008).
- Kojima, M., et al. Ghrelin is a growth-hormone-releasing acylated peptide from stomach. Nature. 402 (6762), 656-660 (1999).
- Stengel, A., Yin Taché, Y., Yang, the Gastric X/A-like Cell as Possible Dual Regulator of Food Intake. J Neurogastroenterol Motil. 18 (2), 138-149 (2012).
- Inhoff, T., et al. Desacyl ghrelin inhibits the orexigenic effect of peripherally injected ghrelin in rats. Peptides. 29, 2159-2168 (2008).
- Hirayama, H., et al. Contrasting effects of ghrelin and des-acyl ghrelin on the lumbo-sacral defecation center and regulation of colorectal motility in rats. Neurogastroenterol Motil. 22 (10), 1124-1131 (2011).
- Horikoshi, Y., et al. Dramatic elevation of plasma metastin concentrations in human pregnancy: metastin as a novel placenta-derived hormone in humans. J Clin Endocrinol Metab. 88 (2), 914-919 (2003).
- Yang, Y. U., Xiong, X. Y., Yang, L. I., Xie, L., Huang, H. Testing of kisspeptin levels in girls with idiopathic central precocious puberty and its significance. Exp Ther Med. 9 (6), 2369-2373 (2015).
- Hosoda, H., Kojima, M., Matsuo, H., Kangawa, K. Ghrelin and des-acyl ghrelin: two major forms of rat ghrelin peptide in gastrointestinal tissue. Biochem Biophys Res Commun. 279 (3), 909-913 (2000).
- Raff, H. Total and active ghrelin in developing rats during hypoxia. Endocrine. 21 (2), 159-161 (2003).
- Evans, M. J., Livesey, J. H., Ellis, M. J., Yandle, T. G. Effect of anticoagulants and storage temperatures on stability of plasma and serum hormones. Clin Biochem. 34 (2), 107-112 (2001).
- Nabuchi, Y., Fujiwara, E., Kuboniwa, H., Asoh, Y., Ushio, H. The stability and degradation pathway of recombinant human parathyroid hormone: deamidation of asparaginyl residue and peptide bond cleavage at aspartyl and asparaginyl residues. Pharm Res. 14 (12), 1685-1690 (1997).
- White, A., Handler, P., Smith, E. L. . Principles of Biochemistry. , (1973).

