Как изучать базальной мембраны Жесткость как биофизической Trigger в раке простаты и других патологий, связанных с возрастом или метаболических заболеваний
Summary
Здесь мы объясняем протокол для моделирования биофизических микросреду, где сшивание и повышенная жесткость базальной мембраны (БМ), индуцированной передовых гликирования (возрасты) имеет патологическое значение.
Abstract
Здесь мы опишем протокол , который может быть использован для изучения биофизических микросреду , связанные с увеличенной толщиной и жесткости базальной мембраны (БМ) во время возрастных патологий и нарушений обмена веществ (например , рак, диабет, микрососудистой болезни, ретинопатия, нефропатия и нейропатия) , Предпосылкой модели является неферментативного сшивание реконструированной матрицы БМ (УКР) путем обработки гликолевого (GLA) для продвижения передовых гликирования endproduct (AGE) генерацию с помощью реакции Майяра. Примеры лабораторных методов, которые могут быть использованы для подтверждения возраста, поколение неферментативного сшивание и повышенную жесткость в GLA обработке RBM очерчены. К ним относятся подготовка отечественных RBM (обработанных фосфатно-буферном солевом растворе, PBS) и жесткой RBM (обработанных GLA) для определения: его содержание AGE фотометрическим анализа и иммунофлюоресценции микроскопии, его неферментативного сшиванию додецилсульфата полиакриламида натриягель-электрофореза (SDS-PAGE), а также конфокальной микроскопии, а его повышенную жесткость с помощью реометрия. Процедура, описанная здесь, может быть использован для увеличения жесткости (модули упругости, Е) RBM до 3,2 раза, в соответствии с измерениями, проводимыми в здоровой по сравнению с патологически измененной ткани предстательной железы человека. Для того, чтобы воссоздать биофизической микросреду, связанный со старением и пораженной железы три типа клеток простаты были введены на родном RBM и жесткой RBM: RWPE-1, простаты эпителиальные клетки (УИКи), полученной из нормальной предстательной железы; BPH-1, УИКи, полученные из железы, пострадавших от доброкачественной гиперплазии предстательной железы (ДГПЖ); и PC3, метастатические клетки, полученные из вторичного костного опухоль, исходящая от рака простаты. Несколько параметров могут быть измерены, в том числе размер, форма и инвазивные характеристики железистой ацинусов 3D образованного RWPE-1 и BPH-1 по сравнению с родной жесткой УОР и средней длины ячейки, миграционный скорости и сохранения клеточного движения 3D-СФЕРOID, образованные PC3 клетками в тех же условиях. Сотовый путей и внутриклеточную локализацию белков сигнализации также могут быть оценены.
Introduction
The basement membrane (BM) is a sheet of specialized extracellular matrix (ECM) that maintains stable tissue borders by separating layers of epithelial cells from the stroma1. Covalent crosslinking between adjacent triple helices of collagen IV in the BM stabilizes their lateral association by establishing an irregular network of super-twisted helices2. These collagen IV lattices act as a scaffold for its interaction with laminin and other BM components1. The structural arrangement of the BM provides it with the mechanical strength and rigidity necessary for the normal development of glandular epithelia3.
During aging and disease the BM progressively thickens and stiffens3,4. For example, a 3-fold increase in the elastic modulus (E) of the ocular BM occurs between the ages of 50 and 80 in the normal population, and this stiffening is further exacerbated in metabolic disorders like diabetes5. The structural and biomechanical changes in the BM that result in its increased stiffness occur when its ECM components, collagen IV and laminin, become non-enzymatically crosslinked following their exposure to advanced glycation endproducts (AGEs).
The purpose of the method described here was to establish a model for the investigation of how BM stiffness, due to AGE exposure, promotes prostate epithelial cell (PEC) and prostate tumour cell (PTC) invasiveness in the context of the switch to metastatic prostate cancer (PCa). To do this a previous method used for generating 3D glandular acini from mammary epithelial cells (MECs) in reconstituted rBM gels6 was adapted to include an additional step where the rBM gels are pre-treated with glycolaldehyde (GLA). Several techniques for assessing GLA induced crosslinking and stiffening of pre-treated rBM gels are described, including photometric analysis, sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS PAGE), confocal microscopy and rheometric analysis. The prostate cell types selected for culture on the pre-stiffened rBM include: RWPE-1, PECs derived from a normal prostate gland7; BPH-1, PECs derived from a prostate gland affected by BPH8; and PC3, metastatic PTCs derived from a secondary tumor located in the vertebral bone of a prostate cancer (PCa) patient9.
In addition to advancing the study of prostate gland pathology, the protocol for stiffening of rBM gels by their treatment with GLA can be adapted to investigate how BM stiffness contributes to other age-related pathologies and metabolic disorders. For example, the model can be directly applied to investigate how metastatic cancer is induced by BM stiffness in organs such as the breast, colon, ovary and pancreas by the incorporation of appropriate cell types. Furthermore, the protocol can be adapted to investigate how stiff BM promotes biomechanical mechanisms of disease progression in diabetes-related microvascular disease, retinopathy, nephropathy and neuropathy.
Protocol
Representative Results
Discussion
Протокол для генерации 3D – железистой ацинусов из MECs в чистых RBM гелей 6 был изменен в предыдущем исследовании , добавлением 4 мг / мл типа коллагена в матрице RBM. Добавление коллагена приводит к модулю упругости геля RBM возрастающей от 175 ± 37 до 1589 ± 380 Па. Это 9,1-кратное увеличение жесткости модулирует рост, выживание, миграцию и дифференцировку MECs 21. Протокол был изменен снова, включив стадию обработки D – (-) – рибоза содействовать неферментативного сшивание типа I коллагена, который был добавлен к гелю RBM. Полученный в результате увеличение в 15 раз в жесткости было обнаружено , что сотрудничать с онкогенных трансформации MECs содействовать их инвазивного поведения 22. Экспериментальный подход добавления типа коллагена УКР гелей облегчает прямое взаимодействие MECs с коллагеновых волокон, что происходит только в тканях человека после физического барьера между стромыи эпителий обеспечивается БМ подвергается протеолитической деградации. Создавая 3D железистой ацинусы из УИКов в чистых гелей RBM предварительно обработанных GLA, текущий протокол открывает путь к изучению , как BM жесткость сама по себе может вызвать их инвазивное поведение (рисунок 3). Уровни жесткости БМ, наведенные в этом протоколе имеют физиологическое значение. Инкубация с 50 мМ GLA в течение 6 ч и 14 ч соответственно увеличили модули упругости чистого RBM геля до 175 ± 90 и 322 ± 160 по сравнению с 122 ± 55 Паскалях в RBM гелей , обработанных PBS (таблица 1). Это увеличение от 1,7 до 3,2 раза в жесткости RBM резюмирует в 2,5- до 3,4-кратное увеличение жесткости наблюдается в злокачественную по сравнению с нормальной простаты или ДГПЖ ткани 23-26. Как указано в недавней публикации 13 морфологических изменений , вызванных накоплением AGE и жесткости УКР в PEC ацинусов может быть определена количественно для статистически значимого сдвига от арСкругленные к многоугольной формы, снижение люминал / общая площадь ацинарными и торчащие клетки мигрируют из acina в AGE богатых RBM (рисунок 3). Иммуноблоттинга также могут быть использованы для оценки маркеров EMT (например , потеря Е-кадгерина 13) , а также поведение сократительной (например , фосфорилируется легкой цепи миозина-2, pMLC2 13) в УИКов , выросших в нормальных по сравнению с жесткой RBM (рисунок 3). Дальнейшая оценка с использованием иммунофлуоресцентного окрашивания и конфокальной микроскопии может быть применен для визуализации BM (например , ламинин, коллаген IV и накопление AGE 13), клеточный апикально-базальной полярности (например , апикальная локализация EEA1: ранний эндосом антиген 1 и GM130: 130 кД цис-Гольджи маркер 13) и клеточные структуры молекул адгезии (например , локализация E-кадгерина в межклеточных соединений 13) (рисунок 3).
<img aл = "Рисунок 3" SRC = "/ файлы / ftp_upload / 54230 / 54230fig3.jpg" />
Рис . 3: Обзор различных протоколов , представленные здесь Диаграмма показывает , как подготовить и тугим восстановленного базальной мембраны (УКР) с гликолевый альдегид (реакция Майяра), как семена клеток на жесткой RBM, как анализировать жесткий RBM ( степень реакции Майяра) и процедур, которые могут быть использованы для анализа клеточных и молекулярных изменений, вызванных возрастными богатых УКР. AGE, передовые гликирования; БМ, базальная мембрана; DAPI, 4 ', 6-диамидино-2-фенилиндол; EEA1, ранний эндосом антиген 1; GAPDH, глицеральдегид-3-фосфат-дегидрогеназы; GLA, гликолевый альдегид; GEE, этиловый эфир глицина; GM130, 130 кДа цис-Гольджи маркер; п-MLC2 (Thr18 / Ser19), легкой цепи миозина-2 фосфорилируется на участках треонин 18 и серин 19; RBM, восстанавливали базальная мембрана; SDS-PAGE, додецилсульфата электрофорез в полиакриламидном геле натрия. Для RWPE1 ацинусы Scale бар = 10 мкм; для опухолевых клеток PC3сфероиды Шкала бар = 100 мкм. Эта цифра была изменена со ссылкой 13. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Действия по устранению неполадок будет необходимо, если D – (-) – рибоза выбран в качестве сшивающего агента для RBM. В ходе разработки протокола было установлено , что лечение с помощью 1 М D – (-) – рибозы в течение 72 ч, как описано выше для RBM / коллагеновых гелей 22, приводит к обезвоживанию и усадки RBM гелей. Оценка более низких концентраций D – (-) – рибоза и более короткие времена обработки могут помочь преодолеть это ограничение.
Потенциальным ограничением в будущих приложениях протокола могут встречаться, где более высокие уровни жесткости RBM желательны. Если более длительное время инкубации и более высокие концентрации GLA используются для индукции более высокие уровни жесткости геля RBM это будет необходимо оценить , являются ли эти условия обработки оказывает влияние на выживаемость и пролиферацию клеток, как описано выше 13. Следует также отметить, что инкубация клеток RWPE-1 с сывороткой индуцирует фенотипическую ЕМТ-подобный переход и подверженность воздействию сыворотки или сыворотки, содержащие материалы следует избегать. Например, если эксперименты предполагают трансфекцию коротких интерферирующих РНК (миРНК) олигонуклеотиды, процедура должна быть оптимизирована с использованием RWPE-1 клеток, выращенных в KSFM, не переключая клетки с низким содержанием сыворотки трансфекция сред. Этот недостаток может поставить под угрозу уровень молчанием генов достигается при использовании переходных миРНК подходов в модели. Для некоторых белковых мишеней было бы рекомендовать использовать индуцируемые векторы shRNA для перестраиваемой молчанием генов и желаемого снижения уровня белка. Адаптации , которые включают ферментативное сшивание с помощью стромальной клетки или опухолевой клетки , связанные лизилоксидазы (LOX) , 17 также могут быть включены в будущие модели.
jove_content "> Этот протокол будет способствовать дальнейшему изучению про-инвазивных механизмов, вызванных зависящих от возраста БМ жесткости в УИКов (RWPE-1, ВРН-1) и оценки анти-метастатических мишеней в инвазивные ПТК (PC3). Учитывая, что ДГПЖ считается нарушение обмена веществ 27, этот протокол также открывает путь к нашему лучшему пониманию взаимосвязи между нарушениями обмена веществ и повышенным риском развития рака простаты. Принимая во внимание , что BM жесткость , индуцированное его воздействием АПЭ может быть триггером для инвазии в другой рак типа, это будет представлять интерес для использования протокола для создания аналогичных моделей , которые включают нормальные эпителиальные клетки и опухолевые клетки из других органов (например , молочной железы, толстой кишки, яичников, поджелудочной железы).Критические шаги в рамках протокола, вместе с их тайминги, приведены на рисунке 4. На начальном этапе очень важно для поддержания исходного раствора RBM при 4 ° С , пока она оттаивает , чтобы предотвратить его Polymerization. наконечники пипеток не следует размещать в гм маточного раствора, пока они не были охлажденным до 4 ° С. Для следующего шага также важно обеспечить камерные слайды уравновешивали до 4 ° С, прежде чем они покрывают раствором RBM. Как только температура раствора RBM возрастает выше 4 ° С она будет подвергаться необратимой полимеризации с образованием геля. Это важно, чтобы RBM не нарушается во время стадии полимеризации, чтобы гарантировать, что она образует ровную поверхность, подходящей для культивирования клеток и микроскопического анализа. Продолжительность инкубации с ГЛК с или без ингибиторов реакции Майяра (цианоборгидрид натрия и amingoguanidine) определит, насколько жесткой гель RBM становится. Рекомендуется использовать 6 часов инкубации с ГЛК , если требуется полу-жесткие условия, и 14 ч инкубации , если жесткие условия необходимы (таблица 1). Альтернативные время инкубации или концентрации GLA могут быть использованы, если разных уровнейжесткости желательно. В этом случае реологического анализа гелей RBM должны быть включены в качестве важного шага. После стадии закалки реакции Майяра при инкубации с GEE и последующих стадий промывки с PBS, гели RBM можно использовать сразу или хранить при температуре 4 ° С в течение до 48 часов до их использования для культивирования клеток. После того, как клеточные культуры настроены, важно, чтобы изменить культуральную среду (включая все процедуры) каждые два дня. Рекомендуется поддерживать культуру 3D клеток в течение 3-12 дней в зависимости от параметров исследуемых. Для 3D PEC ацинусов рекомендуется анализировать культуру через 6 дней, а для 3D PTC СФЕРОИДОВ анализ рекомендуется после 3-х дней культивирования в первой инстанции.
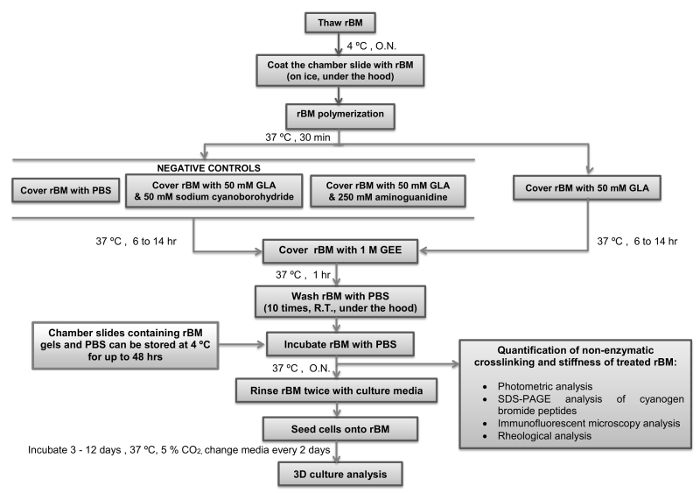
Рис . 4: Простой Обзор протокола с критически важными шагами и таймингов указывало на Floж диаграмма показывает, как подготовить и застывают водостойких базальной мембраны (УКР) с гликолевый альдегид (реакция Майяра) с критическими шагами и тайминги указанных. Точки, где протокол может быть остановлен, и УОР гели хранятся, также указаны. RBM, восстанавливали базальная мембрана; GLA, гликолевый альдегид; GEE, этиловый эфир глицина; ON, в течение ночи; PBS, фосфатно-буферный солевой раствор; RT, комнатная температура. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Disclosures
The authors have nothing to disclose.
Acknowledgements
We thank Simon Hayward (Vanderbilt University Medical Center) for the BPH-1 cells; and Thomas Cox and Janine Erler (Biotech Research & Innovation Centre, University of Copenhagen) for their assistance with rheological measurements. MR-T was funded by Worldwide Cancer Research, formerly The Association of International Cancer Research (Grant 08-0803 to JS), The British Embassy Montevideo and Agencia Nacional de Investigacion e Innovacion (UK_RH_2015_1_2 to MR-T). MC was supported by Prostate Cancer UK (Grant S14-017 to JS and GS). KW was funded by The China Scholarship Council. MAM was funded by The Saudi Arabian Cultural Bureau.
Materials
| I – Material for monolayer culture | |||
| BPH-1 | CaP Cell Line Database | PCaCL-132 | Contact: simon.hayward@mcmail.vanderbilt.edu |
| Complete keratinocyte serum-free media | ThermoFisher Scientific | 17005-075 | Do not warm at 37 ºC before use |
| Fetal calf serum | First Link UK Ltd | 02-00-850 | Store at -20 ºC in aliquots |
| PC3 | American Type Culture Collection | CRL-1435 | |
| Penicillin/streptomycin | ThermoFisher Scientific | 15070-063 | |
| Phosphate Buffer Saline (Dulbecco A) tablets | Oxoid | BR0014G | |
| RPMI 1640 medium | Sigma-Aldrich | R5886 | warm in 37 ºC water bath before use |
| RWPE-1 | American Type Culture Collection | CRL-11609 | |
| Trypsin-EDTA solution | Sigma-Aldrich | T4049 | |
| Name | Company | Catalog Number | Comments |
| II – Material for 3D culture | |||
| Acetonitrile | Sigma-Aldrich | 271004 | |
| Aminoguanidine hydrochloride | Sigma-Aldrich | 396494 | Irritating to eyes, respiratory system and skin |
| Chamber slides, 8-well | Thermo Scientific Nunc Lab-Tek | TKT-210-816M | |
| Culture Matrix reconstituted basement membrane (rBM) reduced growth factor extract | AMS Biotechnology | 3445-005-01 | Store Basement membrane (BM) at -80 ºC in aliquots |
| Cyanogen bromide | Sigma-Aldrich | C91492 | Toxic by contact skin and inhalation |
| Formic acid | Sigma-Aldrich | 695076 | |
| Glycine ethyl ester hydrochloride (GEE) | Sigma-Aldrich | 50060 | Irritating to eyes |
| Glycolaldehyde dimer (GLA) | Sigma-Aldrich | G6805 | |
| Sodium cyanoborohydride | Sigma-Aldrich | 71435 | Highly flammable; Toxic by contact skin and inhalation |
| Syringe filter 0.22 microns | Appleton Woods | BC680 | |
| Name | Company | Catalog Number | Comments |
| III – Material to quantify Maillard reaction | |||
| 4’,6-diamidino-2-phenylindole (DAPI) | ThemoFisher Scientific | D3571 | light sensitive and store at -20 ºC in aliquots |
| Cloning cylinders | Sigma-Aldrich | C1059 | |
| Goat anti-mouse IgG (H+L) Alexa Fluor 488 conjugate | ThemoFisher Scientific | A-11001 | light sensitive |
| Goat anti-rabbit IgG (H+L) Alexa Fluor 488 conjugate | ThemoFisher Scientific | A-11034 | light sensitive |
| Goat serum | Abcam | ab7481 | Store at -20 ºC in aliquots |
| Vectashield mounting media | Vector Laboratories | H-1000 | |
| Mouse anti-pentosidine clone PEN-12 mAb | TransGenic Inc | KH012 | |
| Paraformaldehyde (PFA) | Sigma-Aldrich | F8775 | Store at -20 ºC in aliquots |
| Rabbit anti-human collagen IV polyclonal antibody | Acris Antibodies | R1041 | Store at -20 ºC in aliquots |
| Rabbit anti-laminin A/C pAb | Santa Cruz Biotechnology Inc | sc-7292 | Store at -20 ºC in aliquots |
| Polyethylene glycol tert-octylphenyl ether (Triton-X100) | Sigma-Aldrich | T9284 | |
| Polyethylene glycol sorbitan monolaurate (Tween-20) | Sigma-Aldrich | P1379 | |
| Dialysis cassette Slide-A-Lyzer | ThemoFisher Scientific | 66333 | |
| Name | Company | Catalog Number | Comments |
| IV – Equipment | |||
| ARG2 controlled strain rotational rheometer | T.A. Instruments | ||
| Axiovert S100 (20x magnification) microscope | Zeiss | ||
| CO2 controlled humidified incubation chamber for Zeiss Axio S100 microscope | Solent Scientific | ||
| Confocal Axiovert 200M (40x, 63x magnification) microscope | Zeiss | ||
| Olympus LH50A microscope fitted with a digital camera using phase-contrast | Olympus | ||
| PHERAstar Plus plate reader spectrophotometer | BMG Labtech | ||
| Name | Company | Catalog Number | Comments |
| V – Software | |||
| Image J 1.47v | National Institute of Health, USA | ||
| MetaXpress | Molecular Divices |
References
- Timpl, R., Brown, J. C. Supramolecular assembly of basement membranes. Bioessays. 18 (2), 123-132 (1996).
- Yurchenco, P. D., Ruben, G. C. Type IV collagen lateral associations in the EHS tumor matrix. Comparison with amniotic and in vitro networks. Am J Pathol. 132 (2), 278-291 (1988).
- Halfter, W., et al. Protein composition and biomechanical properties of in vivo-derived basement membranes. Cell Adh Migr. 7 (1), 64-71 (2013).
- Candiello, J., Cole, G. J., Halfter, W. Age-dependent changes in the structure, composition and biophysical properties of a human basement membrane. Matrix Biol. 29 (5), 402-410 (2010).
- To, M., et al. Diabetes-induced morphological, biomechanical, and compositional changes in ocular basement membranes. Exp Eye Res. 116, 298-307 (2013).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and oncogenesis of MCF-10A mammary epithelial acini grown in three-dimensional basement membrane cultures. Methods. 30 (3), 256-268 (2003).
- Bello, D., Webber, M. M., Kleinman, H. K., Wartinger, D. D., Rhim, J. S. Androgen responsive adult human prostatic epithelial cell lines immortalized by human papillomavirus 18. Carcinogenesis. 18 (6), 1215-1223 (1997).
- Hayward, S. W., et al. Establishment and characterization of an immortalized but non-transformed human prostate epithelial cell line: BPH-1. In Vitro Cell Dev Biol Anim. 31 (1), 14-24 (1995).
- Kaighn, M. E., Narayan, K. S., Ohnuki, Y., Lechner, J. F., Jones, L. W. Establishment and characterization of a human prostatic carcinoma cell line (PC-3). Invest Urol. 17 (1), 16-23 (1979).
- Laemmli, U. K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227 (5259), 680-685 (1970).
- Towbin, H., Staehelin, T., Gordon, J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proc Natl Acad Sci U S A. 76 (9), 4350-4354 (1979).
- Rabilloud, T. Mechanisms of protein silver staining in polyacrylamide gels: a 10-year synthesis. Electrophoresis. 11 (10), 785-794 (1990).
- Rodriguez-Teja, M., et al. AGE-modified basement membrane cooperates with Endo180 to promote epithelial cell invasiveness and decrease prostate cancer survival. J Pathol. 235 (4), 581-592 (2015).
- Graf, B. W., Boppart, S. A. Imaging and analysis of three-dimensional cell culture models. Methods Mol Biol. 591, 211-227 (2010).
- Yao, N. Y., Larsen, R. J., Weitz, D. A. Probing nonlinear rheology with inertio-elastic oscillations. J Rheology. 52 (4), 1013-1025 (2008).
- Baker, A. M., Bird, D., Lang, G., Cox, T. R., Erler, J. T. Lysyl oxidase enzymatic function increases stiffness to drive colorectal cancer progression through FAK. Oncogene. 32 (14), 1863-1868 (2013).
- Caley, M. P., et al. Tumor-associated Endo180 requires stromal-derived LOX to promote metastatic prostate cancer cell migration on human ECM surfaces. Clin Exp Metastasis. 3 (2), 151-165 (2016).
- Sturge, J., Wienke, D., East, L., Jones, G. E., Isacke, C. M. GPI-anchored uPAR requires Endo180 for rapid directional sensing during chemotaxis. J Cell Biol. 162 (5), 789-794 (2003).
- Sturge, J., Wienke, D., Isacke, C. M. Endosomes generate localized Rho-ROCK-MLC2-based contractile signals via Endo180 to promote adhesion disassembly. J Cell Biol. 175 (2), 337-347 (2006).
- Rodriguez-Teja, M., et al. Survival Outcome and EMT Suppression Mediated by a Lectin Domain Interaction of Endo180 and CD147. Mol Cancer Res. 13 (3), 538-547 (2015).
- Paszek, M. J., et al. Tensional homeostasis and the malignant phenotype. Cancer Cell. 8 (3), 241-254 (2005).
- Levental, K. R., et al. Matrix crosslinking forces tumor progression by enhancing integrin signaling. Cell. 139 (5), 891-906 (2009).
- Carson, W. C., et al. Material characterization of ex vivo prostate tissue via spherical indentation in the clinic. Med Eng Phys. 33 (3), 302-309 (2011).
- Hoyt, K., et al. Tissue elasticity properties as biomarkers for prostate cancer. Cancer Biomark. 4 (4-5), 213-225 (2008).
- Krouskop, T. A., Wheeler, T. M., Kallel, F., Garra, B. S., Hall, T. Elastic moduli of breast and prostate tissues under compression. Ultrason Imaging. 20 (4), 260-274 (1998).
- Zhang, M., et al. Quantitative characterization of viscoelastic properties of human prostate correlated with histology. Ultrasound Med Biol. 34 (7), 1033-1042 (2008).
- Corona, G., et al. Benign prostatic hyperplasia: a new metabolic disease of the aging male and its correlation with sexual dysfunctions. Int J Endocrinol. , (2014).

