SNARE-mediert Fusion Single Proteoliposomes med tethered Støttede bilagene i en mikrofluid Flow Cell overvåkes av polarisert TIRF Mikroskopi
Summary
Her presenterer vi en protokoll for å detektere enkelt, skarptromme-mediert fusjonshendelser mellom liposomer og støttet bilagene i microfluidic kanaler ved hjelp av polarisert TIRFM, med enkelt molekyl følsomhet og ~ 15 ms tidsoppløsning. Lipid og løselig last utgivelsen kan oppdages samtidig. Liposomstørrelseforandringer, lipid diffusivitet, og fusion pore egenskaper måles.
Abstract
I allestedsnærværende fremgangsmembranfusjon åpningen av et fusjons pore etablerer den første forbindelse mellom to tidligere adskilte rom. Under neurotransmitter eller hormon utgivelse via eksocytose, kan fusjon pore forbigående åpne og lukke gjentatte ganger, som regulerer lastefrigjøringskinetikk. Pore dynamikk også bestemme modus for vesikkel resirkulering; irreversible forseglingsegenskaper resultater i forbigående, "kiss-and-run" fusion, fører mens utvidelse til full fusjon. For bedre å forstå hvilke faktorer som styrer pore dynamikk, har vi utviklet en analyse for å overvåke membran fusjon ved hjelp av polarisert total intern refleksjon fluorescens (TIRF) mikroskopi med enkelt molekyl følsomhet og ~ 15 ms tidsoppløsning i en biokjemisk veldefinert in vitro system. Fusjon av fluorescensmerkede små unilamellære vesikler som inneholder v-SNARE-proteiner (v-SUV) med en plan bilags peiling t-snarer, støttet på en myk polymer pute (t-SBL, t-støttet bilags), Blir overvåket. Analysen bruker microfluidic strømningskanaler som sikrer minimal prøve forbruket samtidig leverer en konstant tetthet av SUVer. Utnyttelse den raske signalforsterkning ved overføring av lipid etiketter fra SUV til SBL under fusjon, er kinetikk av lipid dye transfer overvåkes. Sensitiviteten av TIRF mikros tillater relativ enkle lipid fluorescerende merkelapper, fra hvilken lipid diffusivitet og SUV størrelse kan utledes for hver fusjon arrangement. Lipid fargestoff utgivelsen tider kan være mye lengre tid enn forventet for uhindret passasje gjennom permanent åpne porene. Ved hjelp av en modell som foruts retardasjon av lipid utgivelsen skyldes pore flimring, en pore "åpenhet", brøkdel av tiden pore forblir åpen under fusjon, kan estimeres. Et løselig markør kan være innkapslet i SUVer for samtidig overvåkning av lipid og løselig last utgivelse. Slike målinger angir noen porer kan forsegles på nytt etter å ha mistet en del av det løselige last.
Introduction
Membran fusion er en universell biologisk prosess som kreves for intracellulær trafficking av lipider og proteiner, sekresjon, gjødsling, utvikling, og innhyllet virus oppføring i vertsorganismer 1-3. For de fleste intracellulær fusjon reaksjoner inkludert frigjøring av hormoner og signalstoffer via eksocytose, er energi å fusjonere to lipidbilagene levert av dannelsen av en fire-heliksbunt mellom beslektet løselig N-etylmaleimid sensitiv faktor vedlegg protein reseptor (Snare) proteiner, forankret i vesikkel (v-SNARE) og målet membran (t-SNARE) 4, henholdsvis. Synaptic vesicle eksocytose er den mest strengt regulert fusjonsreaksjon og skjer innen et millisekund etter ankomst av et aksjonspotensial 1,4,5. Sammensmeltingen pore, den første forbindelse mellom de to fusing avdelinger, kan flimre åpen og lukket flere ganger før forsegles eller utvide irreversibelt 5-7. Den tidligere resultaterforbigående, "kiss & run" fusion, mens sistnevnte fører til full fusjon. Faktorer som regulerer balansen mellom disse to modusene for fusjon og mekanismer som regulerer pore flimring er ikke godt forstått 5,8.
Snare proteiner er nødvendig for eksocytose; synaptisk vesikkelfusjon er avskaffet ved spalting av snarer av nervegifter 9. Bulk fusion eksperimenter med små unilamellære vesikler (SUV) viste at snarer er ikke bare nødvendig, men også tilstrekkelig til å drive membranfusjon 10. I denne analysen bulk, SUV rekonstituert med v-snarer (v-SUV) ble dopet med fluorescerende fosfolipider (N – (7-nitro-2-1,3-benzoxadiazol-4-yl) -phosphoethanolamine (NBD-PE) og ( N -. (lissamin rhodamine B sulfonyl) -phosphoethanolamine (LR-PE) og blandet med umerkede vesikler som inneholder t-snarer (t-SUV) Opprinnelige fluorescens av NBD-PE i v-SUV ble stanset ved Förster resonans energi overføring (FRET ) til LR-PE. Som labeLED v-SUVer fusjonere med umerkede t-SUVer, blir fluoroforen overflatetetthet i nå kombinert membran redusert og den resulterende økningen i NBD-PE fluorescens rapporterer omfanget av lipid blande 10. Ettersom hoveddelen analysen er lett å sette opp og analysere, har det vært mye brukt for å studere mekanismene for SNARE-mediert fusjon 10-14. Det har imidlertid flere begrensninger, slik som lav følsomhet og dårlig tidsoppløsning. Viktigst, som et ensemble måling, det gjennomsnitt resultater over alle hendelser som gjør diskriminering mellom dokking og fusjon, samt deteksjon av hemifusion mellomprodukter vanskelige.
Det siste tiåret har flere grupper, inkludert våre, har utviklet nye metoder for å overvåke fusion hendelser på singelen vesikkel nivå 15-27. Ha og kolleger brukte v-SUVer tjoret på en overflate og overvåket sin fusjon med gratis t-SUVer 18,19. Lipidblanding ble overvåket ved bruk av FRET mellom et par av lipid-bundne fluoroforer emsengs i v- og t-SUVer, henholdsvis ved hjelp av total intern refleksjon fluorescens (TIRF) mikros 18. Senere Brunger laboratorium brukes en enkelt lipid-label arter sammen med et innhold markør for samtidig påvisning av lipid og innhold blande 20,28. Både lipid og innholdet markører ble inkludert ved høye, selvlukkende konsentrasjoner; fusjon med umerkede SUVer resulterte i fluorescens dequenching 20,28.
Andre har smeltet v-SUV til planar bilayers rekonstituert med t-snarer 15-17,21-27,29. Den plane geometri målet (t-SNARE holdige) dobbeltlag bedre etterligner den fysiologiske fusjon prosessen av små, svært buede vesikler med flatskjerm plasma membran. Den Steinem gruppe næringsdrivende pore spennende membraner rekonstituert med t-snarer, suspendert over et porøst silisiumnitrid substrat og oppdaget fusjon med individuelle v-SUVer bruker konfokal laser scanning mikros 23. andre fbrukte v-SUV til planar bilayers rekonstituert med t-snarer, støttet på et glass substrat 15-17,21,22,24-27,29. Den store fordelen med å bruke støttede dobbeltlag (SBLs) er at TIRF mikroskopi kan brukes til å oppdage tilkoblings og fusjonsbegivenheter med utmerket signal-til-støy-forhold og uten innblanding fra frie v-SUVer, selv om du bruker MicroFluidics gir også enkelthendelse oppløsning ved hjelp av standard langt-feltet epifluorescence mikros 24.
En stor bekymring er hvorvidt og hvordan substrat-bilaget interaksjoner påvirke støttet bilagskvalitet og fusjonsprosessen. Tidlig arbeid gjort bruk av planar SBLs som var direkte understøttet på et glass eller kvarts substrat 15-17. Disse SBLs ble laget ved adsorpsjon, sprengning, spredning og blanding av t-SUV-membraner på substratet. Det ble snart innså imidlertid at å utelate en nøkkel t-SNARE komponent, SNAP25, fra SBLs fremstilt på denne måten resultert i v-SUV docking og fusion kinetikk indistinguisHable fra de som oppnås ved bruk av komplett t-snarer 17. Fordi SNAP25 er absolutt nødvendig for fusjon in vivo 30,31, ble den fysiologiske betydningen av disse tidlige forsøk satt i spørsmålet. Tamm gruppe vant denne utfordringen ved å bruke bedre kontrollert støttet bilagsdannelse 21. Det pleide Langmuir-Blodgett avsetning for proteinfritt første vedlegget SBL, etterfulgt av fusjon av at enkeltlag med t-SUVer 21. Dette resulterte i SNAP25 avhengig fusjon.
For å unngå eventuelle gjenstander i forbindelse med en to-lags direkte understøttet på et glass-substrat uten behov for å bruke Langmuir-Blodgett metoder, Karatekin et al., Innføres en myk, hydratisert poly (etylenglykol) (PEG) pute mellom bilaget og substratet 24. Denne endringen resulterte også i SNAP25 avhengig fusjon 24. Bilag polstrede på en myk polymersjikt hadde vært kjent for å bedre bevare transmembraneprotein mobilitet og funksjon 32, og hadde blitt brukt i fusjonsstudier med virus 33. I tillegg pegylert bilag synes å beholde noen evne til selv helbrede og er veldig robust 34,35. Først blir en fraksjon av kommersielt tilgjengelige, lipid-koblet PEG-kjedene som inngår i t-SUV membran. Når disse t-SUVer sprekke og danne en plan dobbeltlag på et glass substrat, en PEG børste dekker både flygeblader av den plane bilaget. Fordi plane bilagsdannelse er drevet av adhesjon av PEG-kjedene omkring t-SUVer på den hydrofile glassoverflaten, liposom sprengning og plane bilagsdannelse er forholdsvis ufølsomme overfor lipid preparat som brukes. Imidlertid, når store mengder av kolesterol er inkludert, øker de kohesive egenskaper av SUV, SUV kan ikke briste spontant. Dersom dette er tilfelle, kan osmotisk sjokk eller toverdige ioner anvendes for å hjelpe plane bilagsdannelse 25.
Som nevnt ovenfor, i dette apming en PEG børste dekker begge sider av den plane, støttet bilaget. Børsten som vender mot mikrofluidstrømningskanalen bidrar til å hindre ikke-spesifikk adhesjon av innkommende v-SUVer som også vanligvis er dekket med et lag PEG. Dannelse av V- og T-snare komplekser starter fra membranen-distal N-termini og fortsetter i etapper mot membran-proksimale domener 36. Til V-SUVer å interagere med T-SBL, V- og T-SNARE N-termini behovet for å stikke opp over PEG børster, som synes å være tilfelle under betingelsene for analysen. Børste høyde kan tilpasses til å studere andre enn feller proteiner ved å variere tettheten av PEGylerte lipider og PEG kjedelengde 37,38. En annen fordel med PEG børster dekker proksimale overflater av fikserings bilagene er at de etterligner den overfylt miljø av biologiske membraner som er fullpakket med 30,000-40,000 integrerte membranproteiner per kvadrat micron 39. Akkurat som PEG-kjedene i denne analyse ble repulsive proteinlaget som dekker biologiske membraner trenger å bli skjøvet til side for å tillate kontakt mellom de to fosfolipid dobbeltlag for fusjon til å forekomme.
Mikrofluidstrømningskanaler er brukt i denne analysen, siden de tilbyr unike fordeler. Først gjør microfluidic flyt mer enhetlig deponering av T-SUV til å spre og sikring for å danne t-SBL. For det andre, den lille kanal volum (<1 ul) minimaliserer prøve forbruk. For det tredje, de små volumer som kreves for at hele eksperimentet som skal utføres under konstant strømning. Flow fjerner svakt, antagelig ikke-spesifikt, følges v-SUV fra SBL 16. Det opprettholder også en konstant tetthet av v-SUVer over t-SBL, forenkle kinetisk analyse 17. Endelig er forankret vesikler lett skilles fra gratis de båret av flyten 25. Fjerde, flere microfluidic kanaler kan brukes på samme dekkglass, hver sondering en annen tilstand. Dette gjør det mulig å sammenligne forholdene During den samme forsøkskjøring. En lignende tilnærming har blitt brukt av van Oijen gruppe for å studere fusjon mellom influensavirus og polstrede SBLs 33.
I TIRF mikroskopi, den eksponentielle desintegrasjon av det svinnende felt (med en desintegrasjonskonstanten ~ 100 nm) rammen fluorescenseksitasjon i de molekyler som er i umiddelbar nærhet av glass-buffer grensesnitt. Dette reduserer bidraget av fluorescerende molekyler som er lenger bort, øker signal-til-støyforholdet, og gjør det mulig enkelt molekyl følsomhet med ramme eksponeringstider på 10-40 msek. Den flyktige feltet fører også til et signal økning på fusjon: som den merkede lipider overføring fra SUV inn i SBL, befinner de seg i gjennomsnitt i en sterkere eksitasjon felt. Økningen i fluorescens er sterkere for større liposomer.
Når polarisert lys blir brukt til å generere det flyktige feltet, ytterligere effekter bidrar til endringene i fluorescens ved transfer av etiketter fra SUV inn i SBL. Noen fargestoffer lipid har en overgang dipol orientert med en foretrukket midlere vinkel med hensyn til dobbeltlaget, hvor de er innleiret. Dette skaper en forskjell i mengden av fluorescens emittert ved fluoroforene når de er i SUV versus SBL, ettersom det polariserte strålen vil eksitere fargestoffer i de to membraner på en annen måte. For det første, vil eksiteringen bjelken samhandle med overgangs dipoler orientert rundt den sfæriske SUV, mens det for den sistnevnte, vil dipol-orienteringer være begrenset av den flate SBL geometri. For eksempel, når s-polarisert innfallende lys (polarisert vinkelrett på innfallsplanet) anvendes, er eksitasjon mer effektiv når fargestoffet er i den SBL enn i SUV for et lipid fargestoff overgang dipol orientert parallelt med membranen 29,40 (slik som for Dil eller gjorde 41-43). En SUV dopet med en slik fluorofor vises dimme når det dokker ut mot SBL (figur 7, Representat ive resultater). Som en fusjon pore åpner og forbinder SUV og SBL membraner, fluorescerende prober diffus i SBL og bli mer sannsynlig å bli begeistret av s-polarisert flyktig felt 25,27,29. Følgelig fluorescens signal integreres over hele fusjons området øker sterkt i løpet av farvestoffoverføring fra SUV inn i SBL 27 (figur 3 og figur 7). En ytterligere faktor som bidrar til å signalisere endringene som følger fusjon blir dequenching av fluorescerende markører som de fortynnes når de overføres inn i SBL. Bidraget av dequenching er vanligvis liten i forhold til evanescent felt råte og polariseringseffekter i analysen beskrevet her, fordi bare en liten del ( 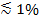 ) Av lipidene er merket.
) Av lipidene er merket.
Signalet Økningen ved fusjon kan utnyttes til å utlede fusjon poreegenskapene ved å sammenligne den tid,1 "src =" / files / ftp_upload / 54349 / 54349eq2.jpg "/>, som kreves for en lipid å flykte gjennom en pore som er fritt gjennomtrengelig for lipider til selve utgivelsen tid,  . Dersom de to tidsskalaer er sammenlignbare, vil det bli konkludert med at den pore presenterer liten motstand mot strømning lipid. Men hvis selve utgivelsen tid er betydelig lengre enn tiden for diffusjon begrenset utgivelse, ville dette indikere en prosess, for eksempel pore flimring, hemmende lipid utgivelse. Spredningen begrenset utgivelsen tid,
. Dersom de to tidsskalaer er sammenlignbare, vil det bli konkludert med at den pore presenterer liten motstand mot strømning lipid. Men hvis selve utgivelsen tid er betydelig lengre enn tiden for diffusjon begrenset utgivelse, ville dette indikere en prosess, for eksempel pore flimring, hemmende lipid utgivelse. Spredningen begrenset utgivelsen tid, 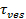 , Avhenger av størrelsen av fikserings liposom og lipid-diffusivitet; sin estimering krever disse to parametere som skal kvantifiseres. Den eneste molekyl sensitiviteten til analysen tillater lipid diffusivitet som skal måles ved å spore flere enkelt lipid fluoroforer etter at de slipper inn i SBL for hver fusjon arrangement 26. Størrelsen av hver fikserings vesikkelkan estimeres 27 ved å kombinere (i) intensiteten av et enkelt lipid fargestoff, (ii) endringen i total fluorescens rundt et forankrings område etter at alle fluoroforen blir overført til SBL ved fusjon, (iii) den kjente merking tettheten av SUV lipider, og (iv) det areal per lipid. For mange fusjonsbegivenheter, ble selve lipid frigjørings ganger funnet å være mye tregere enn forventet ved diffusjon-kontrollert frigjøring 27, som ble nevnt tidligere forutsatt uniform SUV størrelse 44. Forutsatt retardasjon av lipid utgivelsen skyldes pore flimring, tillater en kvantitativ modell estimering av "pore åpenhet", brøkdel av tiden pore forblir åpen i fusion 27.
, Avhenger av størrelsen av fikserings liposom og lipid-diffusivitet; sin estimering krever disse to parametere som skal kvantifiseres. Den eneste molekyl sensitiviteten til analysen tillater lipid diffusivitet som skal måles ved å spore flere enkelt lipid fluoroforer etter at de slipper inn i SBL for hver fusjon arrangement 26. Størrelsen av hver fikserings vesikkelkan estimeres 27 ved å kombinere (i) intensiteten av et enkelt lipid fargestoff, (ii) endringen i total fluorescens rundt et forankrings område etter at alle fluoroforen blir overført til SBL ved fusjon, (iii) den kjente merking tettheten av SUV lipider, og (iv) det areal per lipid. For mange fusjonsbegivenheter, ble selve lipid frigjørings ganger funnet å være mye tregere enn forventet ved diffusjon-kontrollert frigjøring 27, som ble nevnt tidligere forutsatt uniform SUV størrelse 44. Forutsatt retardasjon av lipid utgivelsen skyldes pore flimring, tillater en kvantitativ modell estimering av "pore åpenhet", brøkdel av tiden pore forblir åpen i fusion 27.
Når praktisk, er det viktig å teste fusjons mekanismer ved hjelp av både lipid og oppløselige innhold etiketter. For eksempel kan lipid utgivelsen være tilbakestående av andre enn pore flimrende prosesser, for eksempel begrensning av lipid diffusjon av snaren proteiner som surround than pore. Hvis dette var tilfelle, og slipp av innholdet vil gå forut for utgivelsen av lipid etiketter, forutsatt at pore er stor nok til å tillate passasje av løselige sonder. En mer grunnleggende feil i tilnærmingen kan være i antakelsen om at overføringen av merket lipider til SBL skjer gjennom en smal fusjon pore kobler SBL til en vesikkel som i stor grad har beholdt sin pre-fusion form. Lipid overføringen til SBL kan også skyldes hurtig utvidelse av fusjons pore med en samtidig, ekstremt hurtig sammenbrudd av SUV inn i SBL membranen, som tidligere er foreslått basert på lipid frigjøringsdata alene 29. Overvåking av både lipid og innholdet slipper samtidig, ble det funnet at mange porer lukkes igjen etter frigjøring alle deres lipid-etiketter, men beholdt noen av deres oppløselige last 27. Dette indikerer at i det minste noen av liposomer ikke kollapser inn i SBL etter fusjon, og at lipidet farvestoffoverføring inn i SBL skjer gjennom en fusjon pore. I tillegg er lipid og innholdet utgivelsen skjedde samtidig 27, noe som gjør det usannsynlig at retardasjon av lipid utgivelsen skyldes hindring av lipid diffusjon av snaren proteiner rundt pore 45.
En SUV-SBL fusjon protokoll som ikke overvåke løselige innholdet meldingen ble tidligere utgitt av Karatekin og Rothman 25. Her er mer den siste utviklingen med, nemlig samtidig overvåking av lipid og innholdet slipp og estimering av SUV, lipid, og fusion pore egenskaper 27. Protokollen starter med instruksjoner for utarbeidelse av microfluidic celler, laget ved å binde en poly (dimetylsiloksan) (PDMS) elastomer blokk inneholder riller med et glass dekk 25. Deretter er utarbeidelse av v-SUVer med både lipid og innhold markører forklart. § 4 og § 5 gi instruksjoner for montering av microfluidic celler, danner de SBLs in situ og se etter feil og flyt, innføring av VSUVS i strømnings celler og påvisning av fusjonsbegivenheter. § 6 gir instruksjoner for dataanalyse.
Protocol
Representative Results
Discussion
Vellykket gjennomføring av SUV-SBL fusjon analysen beskrevet her, avhenger kritisk av flere viktige skritt, for eksempel funksjonell tilberedning av proteiner i liposomer, få god kvalitet SBLs, og velge de riktige bildeparameterne for å oppdage enkle molekyler. Selv om det kan ta litt tid og krefter på å lykkes, når analysen er gjennomført med suksess, gir det et vell av informasjon om fusjonsprosessen ikke er tilgjengelig fra noen annen in vitro fusjon analysen diskutert i Introduksjon. Satsene ved hvil…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We thank Vladimir Polejaev (Yale West Campus Imaging Core) for the design and construction of the polarized TIRF microscope, David Baddeley (Yale University) for help with two-color detection instrumentation, and James E. Rothman (Yale University) and Ben O’Shaughnessy (Columbia University) and members of their groups for stimulating discussions. EK is supported by a Kavli Neuroscience Scholar Award from the Kavli Foundation and NIH grant 1R01GM108954.
Materials
| Reagents | ||||
| Milli-Q (MQ) water | Millipore | |||
| KOH | J.T. Baker | 3040-05 | ||
| Ethanol 190 Proof | Decon | |||
| Isopropanol | Fisher Chemical | A416P4 | ||
| HEPES | AmericanBio | AB00892 | ||
| Sodium Cholride (KCl) | AB01915 | |||
| Dithiothreitol | AB00490 | |||
| N-[2-hydroxyethyl] piperazine-N'-[2-ethanesulfonic acid] (HEPES) | AmericanBio | AB00892 | ||
| EGTA | Acros Organics | 409911000 | ||
| Buffers | ||||
| HEPES-KOH buffer (pH 7.4) | 25 mM HEPES-KOH, 140 mM KCl, 100 μM EGTA, 1 mM DTT | |||
| Solvents | ||||
| Chloroform | J.T. Baker | 9180-01 | in glass bottle, CAUTION, wear PPE | |
| Methanol | J.T. Baker | 9070-03 | in glass bottle, CAUTION, wear PPE | |
| Liposome preparation | ||||
| Gastight Hamilton syringe | Hamilton | var. sizes | only use glass sringe with solents (Chlorophorm/ Methanon, 2:1, v/v) | http://www.hamiltoncompany.com |
| Glass tubes Pyrex Vista 11 ml, 16×100 mm screw cap culture tube | Pyrex | 70825-16 | clean thoroughly, rinse with chloroform | http://catalog2.corning.com/LifeSciences/ |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine, 16:0-18:1 PC (POPC) | Avanti Polar Lipids | 850457 | Lipids come dissolved in CHCl3 or as lyphilized powder in sealed vials. Aliquot upon opening. Store extra as dried lipid films under inert atmosphere at -20 °C. Keep stocks in CHCl3/MeOH (2:1, v/v) at -20 °C. let come to RT before opening | http://www.avantilipids.com/ |
| 1,2-dioleoyl-sn-glycero-3-phospho-L-serine (sodium salt), 18:1 PS (DOPS) | 840035 | |||
| 1-stearoyl-2-arachidonoyl-sn-glycero-3-phosphoethanolamine, 18:0-20:4 PE (SAPE) | 850804 | |||
| L-α-phosphatidylinositol-4,5-bisphosphate (Brain, Porcine) (ammonium salt), Brain PI(4,5)P2 | 840046 | |||
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(7-nitro-2-1,3-benzoxadiazol-4-yl) (ammonium salt), 18:1 NBD PE | 810145 | |||
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-2000] (ammonium salt), 18:1 PEG2000 PE | 880130 | |||
| cholesterol (ovine wool, >98%) | 700000 | |||
| DiD' oil; DiIC18(5) oil (1,1'-Dioctadecyl-3,3,3',3'-Tetramethylindodicarbocyanine Perchlorate) | Molecular Probes | D-307 | https://www.thermofisher.com/ | |
| Rotavapor R-210 | Buchi | R-210 | heat bath above Tm of lipids used | http://www.buchi.com/ |
| OG n-Octyl-β-D-Glucopyranoside | Affymetrix | 0311 | store at -20°C, let come to RT before opening | https://www.anatrace.com/ |
| Shaker – Eppendorf Thermomixer R | Eppendorf | https://www.eppendorf.com/ | ||
| Slide-A-Lyze Dialysis Cassettes, 20K MWCO, 3 mL | life technologies | 66003 | https://www.lifetechnologies.com/ | |
| Bio-Beads SM-2 Adsorbents | Bio-Rad | 1523920 | http://www.bio-rad.com/ | |
| OptiPrep Density Gradient Medium | Sigma-Aldrich | D1556 | http://www.sigmaaldrich.com/ | |
| Ultracentrifugation tube, Thinwall, Ultra-Clear, 13.2 mL, 14 x 89 mm | Beckman Coulter | 41121703 | https://www.beckmancoulter.com/ | |
| Beckman SW41 Ti rotor | ||||
| SuflorhodamineB | Molecular Probes | S-1307 | https://www.thermofisher.com/ | |
| Econo-Column Chromatography Columns, 2.5 × 10 cm | Bio-Rad | 7372512 | http://www.bio-rad.com/ | |
| Sepharose CL-4B | GE Healthcare | 17-0150-01 | http://www.gelifesciences.com/ | |
| SYPRO Orange Protein Gel Stain | Molecular Probes | S-6650 | 5,000X Concentrate in DMSO | https://www.lifetechnologies.com/ |
| PDMS block | ||||
| Sylgard 184 Silicone elastomer kit, PDMS | Dow Corning | 3097358-1004 | http://www.dowcorning.com/ | |
| Pyrex glass petri dish, 150 x 20 mm, complete with cover | Corning | 3160-152 | http://catalog2.corning.com/LifeSciences/ | |
| Hole puncher – Reusable Biopsy Punch, 0.75mm | World Precision Instruments | 504529 | http://www.wpi-europe.com/ | |
| Manual Hole Punching Machine | SYNEO | MHPM-UNV | http://www.syneoco.com/ | |
| Drill .035 x .026 x 1.5 304 SS TiN coated round punch | CR0350265N20R4 | drill diameter: 0.9 mm | ||
| Tygon Microbore tubing, 0.25 mm ID, 0.76 mm OD | Cole-Parmer | 06419-00 | 0.010" ID, 0.030" OD | http://www.coleparmer.com/ |
| Silicone Tubing (0.51 mm ID, 2.1 mm OD | 95802-00 | 0.020" ID, 0.083" OD | ||
| Cover glass - cleanroom cleaned | ||||
| Schott Nexterion cover slip glass D | Schott | 1472305 | http://www.us.schott.com/ | |
| plasma cleaner | Harrick | PDC-32G | http://harrickplasma.com/ | |
| pTIRF setup and accessories | ||||
| IX81 microscope body | Olympus | IX81 | http://www.olympus-lifescience.com/en/ | |
| EM CCD camera | Andor | ixon-ultra-897 | http://www.andor.com/ | |
| Thermo Plate, heated microscope stage | Tokai Hit | MATS-U52RA26 | http://www.tokaihit.com/ | |
| 1 ml hamilton glass syringes (4x) | Hamilton | 81365 | http://www.hamiltoncompany.com | |
| syringe pump | kd Scientific | KDS-230 | http://www.kdscientific.com/ |
References
- Sudhof, T. C., Rothman, J. E. Membrane fusion: grappling with SNARE and SM proteins. Science. 323, 474-477 (2009).
- Wickner, W., Schekman, R. Membrane fusion. Nat Struct Mol Biol. 15, 658-664 (2008).
- Harrison, S. C. Viral membrane fusion. Nat Struct Mol Biol. 15, 690-698 (2008).
- Jahn, R., Scheller, R. H. SNAREs–engines for membrane fusion. Nat Rev Mol Cell Biol. 7, 631-643 (2006).
- Lindau, M., Alvarez de Toledo, G. The fusion pore. Biochim Biophys Acta. 1641, 167-173 (2003).
- Staal, R. G., Mosharov, E. V., Sulzer, D. Dopamine neurons release transmitter via a flickering fusion pore. Nat Neurosci. 7, 341-346 (2004).
- Wu, Z., et al. Nanodisc-cell fusion: Control of fusion pore nucleation and lifetimes by SNARE protein transmembrane domains. Sci. Rep. 6, 27287 (2016).
- Alabi, A. A., Tsien, R. W. Perspectives on kiss-and-run: role in exocytosis, endocytosis, and neurotransmission. Ann Rev Physiol. 75, 393-422 (2013).
- Rossetto, O., Pirazzini, M., Montecucco, C. Botulinum neurotoxins: genetic, structural and mechanistic insights. Nature Rev Microbiol. 12, 535-549 (2014).
- Weber, T., et al. SNAREpins: minimal machinery for membrane fusion. Cell. 92, 759-772 (1998).
- Nickel, W., et al. Content mixing and membrane integrity during membrane fusion driven by pairing of isolated v-SNAREs and t-SNAREs. Proc Natl Acad Sci U S A. 96, 12571-12576 (1999).
- McNew, J. A., et al. Compartmental specificity of cellular membrane fusion encoded in SNARE proteins. Nature. 407, 153-159 (2000).
- Melia, T. J., You, D. Q., Tareste, D. C., Rothman, J. E. Lipidic antagonists to SNARE-mediated fusion. J Biol Chem. 281, 29597-29605 (2006).
- Hernandez, J. M., et al. Membrane fusion intermediates via directional and full assembly of the SNARE complex. Science. 336, 1581-1584 (2012).
- Fix, M., et al. Imaging single membrane fusion events mediated by SNARE proteins. Proc Natl Acad Sci U S A. 101, 7311-7316 (2004).
- Bowen, M. E., Weninger, K., Brunger, A. T., Chu, S. Single molecule observation of liposome-bilayer fusion thermally induced by soluble N-ethyl maleimide sensitive-factor attachment protein receptors (SNAREs). Biophys J. 87, 3569-3584 (2004).
- Liu, T., Tucker, W. C., Bhalla, A., Chapman, E. R., Weisshaar, J. C. SNARE-driven, 25-millisecond vesicle fusion in vitro. Biophys J. 89, 2458-2472 (2005).
- Yoon, T. Y., Okumus, B., Zhang, F., Shin, Y. K., Ha, T. Multiple intermediates in SNARE-induced membrane fusion. Proc Natl Acad Sci U S A. 103, 19731-19736 (2006).
- Diao, J., et al. A single-vesicle content mixing assay for SNARE-mediated membrane fusion. Nat Commun. 1, 1-6 (2010).
- Kyoung, M., et al. In vitro system capable of differentiating fast Ca2+-triggered content mixing from lipid exchange for mechanistic studies of neurotransmitter release. Proc Natl Acad Sci U S A. 108, E304-E313 (2011).
- Domanska, M. K., Kiessling, V., Stein, A., Fasshauer, D., Tamm, L. K. Single vesicle millisecond fusion kinetics reveals number of SNARE complexes optimal for fast SNARE-mediated membrane fusion. J Biol Chem. 284, 32158-32166 (2009).
- Kreutzberger, A. J., Kiessling, V., Tamm, L. K. High Cholesterol Obviates a Prolonged Hemifusion Intermediate in Fast SNARE-Mediated Membrane Fusion. Biophys J. 109, 319-329 (2015).
- Schwenen, L. L., et al. Resolving single membrane fusion events on planar pore-spanning membranes. Sci Rep. 5, 12006 (2015).
- Karatekin, E., et al. A fast, single-vesicle fusion assay mimics physiological SNARE requirements. Proc Natl Acad Sci U S A. 107, 3517-3521 (2010).
- Karatekin, E., Rothman, J. E. Fusion of single proteoliposomes with planar, cushioned bilayers in microfluidic flow cells. Nat Protoc. 7, 903-920 (2012).
- Smith, M. B., et al. Interactive, computer-assisted tracking of speckle trajectories in fluorescence microscopy: application to actin polymerization and membrane fusion. Biophys J. 101, 1794-1804 (2011).
- Stratton, B. S., et al. Cholesterol Increases the Openness of SNARE-mediated Flickering Fusion Pores. Biophysical journal. 110, (2016).
- Diao, J., et al. Synaptic proteins promote calcium-triggered fast transition from point contact to full fusion. Elife. 1, e00109 (2012).
- Kiessling, V., Domanska, M. K., Tamm, L. K. Single SNARE-mediated vesicle fusion observed in vitro by polarized TIRFM. Biophys J. 99, 4047-4055 (2010).
- Blasi, J., et al. Botulinum neurotoxin A selectively cleaves the synaptic protein SNAP-25. Nature. 365, 160-163 (1993).
- Washbourne, P., et al. Genetic ablation of the t-SNARE SNAP-25 distinguishes mechanisms of neuroexocytosis. Nat Neurosci. 5, 19-26 (2002).
- Diaz, A. J., Albertorio, F., Daniel, S., Cremer, P. S. Double cushions preserve transmembrane protein mobility in supported bilayer systems. Langmuir. 24, 6820-6826 (2008).
- Floyd, D. L., Ragains, J. R., Skehel, J. J., Harrison, S. C., van Oijen, A. M. Single-particle kinetics of influenza virus membrane fusion. Proc Natl Acad Sci U S A. 105, 15382-15387 (2008).
- Albertorio, F., et al. Fluid and air-stable lipopolymer membranes for biosensor applications. Langmuir. 21, 7476-7482 (2005).
- Daniel, S., Albertorio, F., Cremer, P. S. Making lipid membranes rough, tough, and ready to hit the road. Mrs Bulletin. 31, 536-540 (2006).
- Gao, Y., et al. Single reconstituted neuronal SNARE complexes zipper in three distinct stages. Science. 337, 1340-1343 (2012).
- Kenworthy, A. K., Hristova, K., Needham, D., Mcintosh, T. J. Range and Magnitude of the Steric Pressure between Bilayers Containing Phospholipids with Covalently Attached Poly(Ethylene Glycol). Biophys J. 68, 1921-1936 (1995).
- Knoll, W., et al. Solid supported lipid membranes: New concepts for the biomimetic functionalization of solid surfaces. Biointerphases. 3, Fa125-Fa135 (2008).
- Quinn, P., Griffiths, G., Warren, G. Density of newly synthesized plasma membrane proteins in intracellular membranes II. Biochemical studies. J Cell Biol. 98, 2142-2147 (1984).
- Sund, S. E., Swanson, J. A., Axelrod, D. Cell membrane orientation visualized by polarized total internal reflection fluorescence. Biophys J. 77, 2266-2283 (1999).
- Johnson, D. S., Toledo-Crow, R., Mattheyses, A. L., Simon, S. M. Polarization-controlled TIRFM with focal drift and spatial field intensity correction. Biophys J. 106, 1008-1019 (2014).
- Anantharam, A., Onoa, B., Edwards, R. H., Holz, R. W., Axelrod, D. Localized topological changes of the plasma membrane upon exocytosis visualized by polarized TIRFM. J Cell Biol. 188, 415-428 (2010).
- Axelrod, D. Carbocyanine dye orientation in red cell membrane studied by microscopic fluorescence polarization. Biophys J. 26, 557-573 (1979).
- Wang, T., Smith, E. A., Chapman, E. R., Weisshaar, J. C. Lipid mixing and content release in single-vesicle, SNARE-driven fusion assay with 1-5 msec resolution. Biophys J. 96, 4122-4131 (2009).
- Chernomordik, L. V., Frolov, V. A., Leikina, E., Bronk, P., Zimmerberg, J. The pathway of membrane fusion catalyzed by influenza hemagglutinin: restriction of lipids, hemifusion, and lipidic fusion pore formation. J Cell Biol. 140, 1369-1382 (1998).
- Takamori, S., et al. Molecular anatomy of a trafficking organelle. Cell. 127, 831-846 (2006).
- Wilhelm, B. G., et al. Composition of isolated synaptic boutons reveals the amounts of vesicle trafficking proteins. Science. 344, 1023-1028 (2014).
- Scott, B. L., et al. Liposome fusion assay to monitor intracellular membrane fusion machines. Methods Enzymol. 372, 274-300 (2003).
- Linkert, M., et al. Metadata matters: access to image data in the real world. J Cell Biol. 189, 777-782 (2010).
- Soumpasis, D. M. Theoretical analysis of fluorescence photobleaching recovery experiments. Biophys J. 41, 95-97 (1983).
- Ohki, S. A mechanism of divalent ion-induced phosphatidylserine membrane fusion. Biochim Biophys Acta. 689, 1-11 (1982).
- Berquand, A., et al. Two-step formation of streptavidin-supported lipid bilayers by PEG-triggered vesicle fusion. Fluorescence and atomic force microscopy characterization. Langmuir. 19, 1700-1707 (2003).
- Tamm, L. K., McConnell, H. M. Supported phospholipid bilayers. Biophys J. 47, 105-113 (1985).
- Rawle, R. J., van Lengerich, B., Chung, M., Bendix, P. M., Boxer, S. G. Vesicle fusion observed by content transfer across a tethered lipid bilayer. Biophys J. 101, L37-L39 (2011).
- Wagner, M. L., Tamm, L. K. Reconstituted syntaxin1a/SNAP25 interacts with negatively charged lipids as measured by lateral diffusion in planar supported bilayers. Biophys J. 81, 266-275 (2001).
- Kalb, E., Frey, S., Tamm, L. K. Formation of Supported Planar Bilayers by Fusion of Vesicles to Supported Phospholipid Monolayers. Biochimica Et Biophysica Acta. 1103, 307-316 (1992).

