SNARE-medierad fusion av Single proteoliposomer med tjudrad bilayers stöds i en mikroflödes Flow Cell övervakas av polariserat TIRF mikroskopi
Summary
Här presenterar vi ett protokoll för att detektera enstaka, snara-medierad fusion händelser mellan liposomer och stöds dubbelskikt i mikroflödessystem kanaler med hjälp av polariserat TIRFM, med enda molekyl känslighet och ~ 15 ms tidsupplösning. Lipid och löslig lastfrigör kan detekteras samtidigt. Liposomstorlek, lipid diffusivitet, och fusion pore egenskaper mäts.
Abstract
I den allestädes närvarande processen för membranfusion öppnandet av en fusion por etablerar den första anslutningen mellan två tidigare separata fack. Under signalsubstans eller hormonfrisättning via exocytos, fusions por kan övergående öppna och stänga flera gånger, som reglerar lastfrisättningskinetik. Pore dynamik bestämmer också läget av vesikler återvinning, irreversibla återförslutning resulterar i övergående, "kiss-and-run" fusion leder medan utvidgning till full fusion. För att bättre förstå vilka faktorer styr pore dynamik, utvecklade vi en analys för att övervaka membranfusion med hjälp av polariserat total inre reflektion fluorescens (TIRF) mikroskopi med enda molekyl känslighet och ~ 15 ms tidsupplösning i ett biokemiskt väldefinierat in vitro-system. Fusion av fluorescerande små unilamellära vesiklar som innehåller v-SNARE proteiner (v-SUV) med en plan tvåskiktsmembran bärande t-snaror, uppburen på en mjuk polymer kudde (t-SBL, t-stöd tvåskiktsmembran), Övervakas. Analysen använder mikroflödessystem flödeskanaler som säkerställer minimal provförbrukningen samtidigt leverera en konstant densitet av stadsjeepar. Utnyttja den snabba signalförstärkning vid överföring av lipid etiketter från SUV till SBL under fusion, är kinetiken lipid färgöverförings övervakas. Känsligheten hos TIRF mikroskopi tillåter att spåra enskilda fluorescerande lipid etiketter, från vilken lipid diffusivitet och SUV storlek kan härledas för varje fusion händelse. Lipid färgfrisättningstider kan vara mycket längre än väntat för obehindrad passage genom permanent öppna porer. Med hjälp av en modell som förutsätter fördröjning av lipid frisättning beror på pore flimmer, en por "öppenhet", den del av tiden porerna förblir öppen under fusion, kan uppskattas. En löslig markör kan inkapslas i SUV för samtidig övervakning av lipid och löslig last release. Sådana mätningar indikerar vissa porer kan återförsluta efter att ha förlorat en del av den lösliga last.
Introduction
Membranfusion är en universell biologisk process som krävs för intracellulär handel med lipider och proteiner, utsöndring, gödsling, utveckling och insvept virus inträde i värdorganismer 1-3. För de flesta intracellulära fusionsreaktioner inklusive frisättning av hormoner och signalsubstanser via exocytos, är energin för att sammansmälta två lipiddubbelskikt tillhandahålls genom bildning av ett fyra-helix bundle mellan cognate löslig N-etylmaleimid-känslig faktor fastsättning proteinreceptor (SNARE) proteiner, förankrad i vesikeln (v-SNARE) och målmembranet (t-SNARE) 4, respektive. Synaptic vesikler exocytos är den mest hårt reglerad fusion reaktion och inträffar inom en millisekund efter ankomsten av en aktionspotential 1,4,5. Fusions por, den första anslutningen mellan de två fixerings facken, kan flimmer öppna och slutna flera gånger innan återförslutning eller expandera irreversibelt 5-7. De tidigare resultatövergående, "Kiss & run" fusion, medan den senare leder till full fusion. Faktorer som styr balansen mellan dessa två typer av fusion och mekanismer som reglerar por flimmer är inte väl förstått 5,8.
SNARE proteiner krävs för exocytos; synaptiska vesikelfusion avskaffas vid klyvning av snaror av neurotoxiner 9. Bulkfusionsexperiment med användning av små unilamellära vesiklar (SUVs) visade att snaror inte bara krävs, men också tillräcklig för att driva membranfusion 10. I detta bulk assay, SUVs rekonstitueras med v-snaror (v-SUV) till dopad med fluorescerande fosfolipider (N – (7-nitro-2-1,3-bensoxadiazol-4-yl) -phosphoethanolamine (NBD-PE) och ( N -. (lissaminrodamin B sulfonyl) -phosphoethanolamine (LR-PE) och blandades med omärkta vesiklar innehållande t-snaror (t-SUV) Initialt fluorescensen av NBD-PE i v-SUVs släckes genom Förster resonansenergiöverföring (FRET ) till LR-PE. som labELED v-SUV smälta samman med omärkta t-SUV, är fluoroforen ytdensitet i det nu kombinerade membranet reduceras och den resulterande ökningen i NBF-PE fluorescens rapporterar omfattningen av lipidblandning 10. Som bulk analysen är lätt att ställa upp och analysera, har det i stor utsträckning använts för att studera mekanismerna för SNARE-medierad sammansmältning 10-14. Det har dock flera begränsningar, såsom låg känslighet och dålig tidsupplösning. Viktigast som en ensemble mätning, det genomsnitt resultat under alla omständigheter gör diskriminering mellan dockning och fusion, samt detektering av hemifusion mellan svårt.
Under det senaste årtiondet flera grupper, inklusive vårt, har utvecklat nya analyser för att övervaka fusions evenemang på enstaka vesikler nivå 15-27. Ha och kollegor använde v-SUV bundna på en yta och övervakas deras fusion med gratis t-SUV 18,19. Lipidblandning övervakades med användning av FRET mellan ett par lipid-bundna fluoroforer embäddas in i v- och t-SUV, respektive, med hjälp av total inre reflektion fluorescens (TIRF) mikroskopi 18. Senare Brunger laboratorium använde en enda lipid-label art tillsammans med en innehåll markör för samtidig detektion av lipid och innehåll blanda 20,28. Både lipid och innehållet markörerna ingick vid höga, självläckande koncentrationer; fusion med omärkta SUVs resulterade i fluorescens dequenching 20,28.
Andra har smält v-SUV till plana bilayers ombildade med t-snaror 15-17,21-27,29. Den plana geometri målet (t-SNARE innehållande) biskikt bättre efterliknar den fysiologiska fusionsprocessen av små, mycket böjda vesiklar med platt plasmamembranet. Den Steinem grupp som användes pore överbryggande membran rekonstituerade med t-snaror, suspenderade genom ett poröst kiselnitrid substratet och detekteras fusion med enskilda v-SUVs med användning av konfokal laserscanningsmikroskopi 23. andra fbegagnade v-SUVs till plana biskikt rekonstituerade med t-snaror, uppburen på ett glassubstrat 15-17,21,22,24-27,29. Den stora fördelen med att använda stöds dubbla skikt (SBLs) är att TIRF mikroskopi kan användas för att detektera dockning och fusion händelser med utmärkt signal-brusförhållande och utan inblandning från fria v-SUV, även om användning av mikrofluidik ger också enstaka händelse upplösning med standard fjärrfälts epifluorescensmikroskopi 24.
En viktig fråga är om och hur substrat tvåskiktsmembran interaktioner påverkar stöds tvåskiktsmembran kvalitet och fusionsprocessen. Tidigt arbete utnyttjade plana SBLs som direkt stöd på ett glas eller kvartssubstrat 15-17. Dessa SBLs gjordes genom adsorption, spricker, spridning och blandning av t-SUV membran på substratet. Det var snart insåg dock att utelämna en viktig t-SNARE komponent, SNAP25 från SBLs framställda på detta sätt resulterade i v-SUV dockning och fusion kinetik indistinguisHable från de som erhållits genom att använda den fullständiga t-snaror 17. Eftersom SNAP25 är absolut nödvändig för fusion in vivo 30,31, var den fysiologiska relevansen av dessa tidiga försök ifrågasättas. Tamm grupp klarade denna utmaning genom att använda kontrolleras bättre stöd tvåskiktsmembran bildning 21. Det brukade Langmuir-Blodgett avsättning för proteinfritt första broschyr av SBL, följt av fusion av det monolager med t-SUV 21. Detta resulterade i SNAP25 beroende fusion.
För att undvika potentiella artefakter associerade med ett dubbelskikt direkt uppburen på ett glassubstrat utan behov av att använda Langmuir-Blodgett metoder, Karatekin et al. Infört en mjuk, hydratiserad poly (etylenglykol) (PEG) kudde mellan dubbelskiktet och substratet 24. Denna modifiering resulterade också i SNAP25 beroende fusion 24. Dubbelskikt vadderade på ett mjukt polymerskikt hade varit kända för att bättre bevara transprotein rörlighet och funktion 32, och hade använts i fusionsstudier med virus 33. Dessutom PEGylerade bilayers tycks behålla en del förmåga att självläka och är mycket robust 34,35. Först är en fraktion av kommersiellt tillgängliga, lipid-länkad PEG-kedjor som ingår i t-SUV membran. När dessa t-SUVs brista och bilda en plan tvåskiktsmembran på ett glassubstrat, omfattar en PEG borste båda broschyrer av den plana biskikt. Eftersom plana biskikt bildning drivs av vidhäftning av PEG-kedjor närliggande t-SUVs på den hydrofila glasytan, liposom sprängning och plana biskikt bildning är relativt okänsliga för lipidkompositionen användas. När emellertid stora mängder kolesterol ingår, ökar de kohesiva egenskaperna hos SUVs, SUVs kanske inte brista spontant. Om detta är fallet, kan osmotisk chock eller tvåvärda joner användas för att hjälpa till plana biskikt bildning 25.
Såsom nämnts ovan, i detta apgrepp en PEG borste täcker båda sidorna av den plana, uppburen dubbelskiktet. Borsten mot mikroflödesflödeskanalen hjälper till att förhindra ospecifik vidhäftning av inkommande v-SUV som också är oftast täckt med en PEG lager. Bildning av V- och t-SNARE-komplex utgår från membran distala N-terminaler och fortsätter i etapper mot membran-proximala domänerna 36. För v-SUV att interagera med t-SBL, V- och t-SNARE N-terminaler är nödvändigt att skjuta över PEG borstar, som verkar vara fallet i enlighet med villkoren i analysen. Borsthöjden kan anpassas för att studera andra än snaror proteiner genom att variera densiteten hos PEGylerade lipider och PEG kedjelängd 37,38. En annan fördel med de PEG-borstar som täcker de proximala ytorna av fixerings bilayers är att de efterliknar det trånga miljön i biologiska membran, vilka är packade med 30,000-40,000 integrerade membranproteiner per kvadratmikron 39. Precis som de PEG-kedjor i denna analys, den Repulsive proteinskikt som täcker biologiska membran måste skjutas åt sidan för att tillåta kontakt mellan de två fosfolipid bilayers för fusion skall ske.
Mikroflödesströmningskanaler används i denna analys, eftersom de erbjuder unika fördelar. Först gör mikroflödes flöde jämnare avsättning av T-SUV för att sprida och säkring för att bilda t-SBL. För det andra, (<1 l) minimerar den lilla kanalvolymen provförbrukning. För det tredje, de små volymer som behövs låta hela experimentet genomföras under konstant flöde. Flow avlägsnar svagt, förmodligen ospecifikt, vidhäftade v-SUV från SBL 16. Det har även en konstant densitet av v-SUV ovanför t-SBL, förenklar kinetisk analys 17. Slutligen dockade blåsor lätt skiljas från fri dem som bärs av flödet 25. Fjärde flera mikroflödessystem kanaler kan användas på samma täck varje sondering olika tillstånd. Detta möjliggör jämförelser av villkor During samma experimentkörning. Ett liknande tillvägagångssätt har använts av van Oijen för att studera fusion mellan influensavirus och vadde SBLs 33.
I TIRF mikroskopi, den exponentiella avklingningen av det evanescenta fältet (med en sönderfallskonstant ~ 100 nm) begränsar fluorescensexcitation till de molekyler som är i mycket nära anslutning för det glasbuffertgränssnittet. Detta minimerar bidraget från fluorescerande molekyler som ligger längre bort, ökar signal-brusförhållande, och tillåter enda molekyl känslighet med ram exponeringstider på 10 till 40 msek. Det evanescenta fältet leder också till en signalökning på fusion: som den märkta lipider överföring från SUV till SBL, de befinner sig, i genomsnitt, en starkare exciteringsfältet. Denna ökning i fluorescens är starkare för större liposomer.
Om polariserat ljus används för att generera det evanescenta fältet, ytterligare effekter bidra till förändringar i fluorescens vid tverför av etiketter från SUV i SBL. Vissa lipid-färgämnen har en övergångs dipol orienterad med en föredragen medel vinkel med avseende på dubbelskiktet i vilket de är inbäddade. Detta skapar en skillnad i mängden av fluorescens som emitteras av de fluoroforer när de är i SUV kontra SBL, eftersom den polariserade strålen att excitera färgämnen i de två membranen på olika sätt. För de förstnämnda kommer excitationsstrålen interagera med övergångs dipoler orienterade kring den sfäriska SUV, medan det senare kommer dipol riktlinjer begränsas av den plana SBL geometri. Till exempel, när s-polariserade infallande ljuset (polariserat vinkelrätt mot infallsplanet) används, är excitering mer effektiv när färgämnet är i SBL än i SUV för en lipid färgämne övergångs dipol orienterad parallellt med membranet 29,40 (såsom den av Dil eller gjorde 41-43). En SUV dopad med en sådan fluorofor visas dim när den dockar har laddats in i SBL (Figur 7, Representat ive Resultat). Som en fusion pore öppnas och förbinder de SUV och SBL membran, fluorescerande prober diffundera in i SBL och blir mer sannolikt att exciteras av s-polariserade evanescent fält 25,27,29. Följaktligen ökar fluorescenssignalen integreras runt fusionsstället kraftigt under färgöverföring från SUV till SBL 27 (Figur 3 och Figur 7). En ytterligare faktor som bidrar till signal förändringar som följer fusion dequenching av fluorescerande markörer som de späds när de överförs in i SBL. Bidraget från dequenching är vanligtvis små i jämförelse med evanescent fältröta och polariseringseffekter i analysen beskriven här, eftersom endast en liten fraktion ( 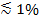 ) Av lipiderna är märkta.
) Av lipiderna är märkta.
Signalökning vid fusion kan utnyttjas för att härleda fusion pore egenskaper genom att jämföra den tid,1 "src =" / filer / ftp_upload / 54349 / 54349eq2.jpg "/>, som krävs för en lipid fly genom en por som är fritt permeabel för lipider till frigöra tid själva,  . Om de två tidsskalor är jämförbara, skulle man dra slutsatsen att porerna uppvisar litet motstånd mot lipid flödet. Men om frigöra tid själva är betydligt längre än den tid för diffusion begränsad frisättning, skulle detta tyda på en process, såsom porer flimmer, fördröjer lipid release. Spridning begränsade frigöra tid,
. Om de två tidsskalor är jämförbara, skulle man dra slutsatsen att porerna uppvisar litet motstånd mot lipid flödet. Men om frigöra tid själva är betydligt längre än den tid för diffusion begränsad frisättning, skulle detta tyda på en process, såsom porer flimmer, fördröjer lipid release. Spridning begränsade frigöra tid, 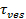 , Beror på storleken av fixerings liposomer och lipid-diffusivitet; sin uppskattning kräver dessa två parametrar som skall kvantifieras. Den enda molekyl känsligheten för analysen tillåter lipid diffusivitet som skall mätas genom att spåra flera enda lipid fluoroforer efter frigivningen i SBL för varje fusion händelse 26. Storleken på varje fusing vesikelkan uppskattas 27 genom att kombinera (i) intensiteten av en enda lipid färgämne, (ii) förändring av det totala fluorescens runt en dockningsområdet efter det alla fluoroforer överförs till SBL upon fusion, (iii) den kända märkningsdensitet av SUV lipider, och (iv) området per lipid. För många fusion händelser, var de faktiska lipid frisättningstider visat sig vara mycket långsammare än väntat genom diffusion-kontrollerad frisättning 27, som noterades tidigare antagande enhetlig SUV storlek 44. Förutsatt fördröjning av lipid frisättning beror på pore flimmer, gör en kvantitativ modell uppskattning av "pore öppenhet", den del av tiden porerna förblir öppen under fusion 27.
, Beror på storleken av fixerings liposomer och lipid-diffusivitet; sin uppskattning kräver dessa två parametrar som skall kvantifieras. Den enda molekyl känsligheten för analysen tillåter lipid diffusivitet som skall mätas genom att spåra flera enda lipid fluoroforer efter frigivningen i SBL för varje fusion händelse 26. Storleken på varje fusing vesikelkan uppskattas 27 genom att kombinera (i) intensiteten av en enda lipid färgämne, (ii) förändring av det totala fluorescens runt en dockningsområdet efter det alla fluoroforer överförs till SBL upon fusion, (iii) den kända märkningsdensitet av SUV lipider, och (iv) området per lipid. För många fusion händelser, var de faktiska lipid frisättningstider visat sig vara mycket långsammare än väntat genom diffusion-kontrollerad frisättning 27, som noterades tidigare antagande enhetlig SUV storlek 44. Förutsatt fördröjning av lipid frisättning beror på pore flimmer, gör en kvantitativ modell uppskattning av "pore öppenhet", den del av tiden porerna förblir öppen under fusion 27.
Närhelst praktiskt, är det viktigt att testa fusionsmekanismer med användning av både lipid- och lösliga innehåll etiketter. Till exempel kan lipid frisättning fördröjas av andra än por flimmer processer, såsom begränsning av lipid diffusion av snaran proteiner som omger than pore. Om så vore fallet, släpp sedan av innehållet skulle föregå frigörande av lipid etiketter, förutsatt att por är tillräckligt stor för att tillåta passage av lösliga sonder. En mer grundläggande brist i den strategi skulle kunna vara i antagandet att överföringen av märkta lipider till SBL sker genom en smal fusion por ansluter SBL till en vesikel som till stor del har behållit sin pre-fusion form. Lipid överföring till SBL kan också vara resultatet av en snabb utvidgning av fusions por med en åtföljande, extremt snabb kollaps av SUV i SBL membran, som föreslog tidigare på lipid släppuppgifter enbart 29. Övervakning både lipid och innehåll släpper samtidigt visade det sig att många porer återförslutas efter att ha släppt alla sina fettetiketter, men behöll en del av deras lösliga last 27. Detta tyder på att åtminstone vissa liposomer inte kollapsar in i SBL efter smältning, och att lipiden färgämnesöverföring in i SBL sker genom en fusion por. Dessutom, lIPID och innehåll frisättning inträffade samtidigt 27, vilket gör det osannolikt att fördröjning av lipid frigör berodde på besvär av lipid diffusion av snaran proteiner omger por 45.
En SUV-SBL fusionsprotokoll som inte övervaka lösliga innehåll frisättning har tidigare publicerats av Karatekin och Rothman 25. Här är den senaste utvecklingen ingår, nämligen samtidig övervakning av lipid och innehåll släpper och uppskattning av SUV, lipid, och fusion pore egenskaper 27. Protokollet börjar med instruktioner för framställning av de mikroflödesceller, tillverkade genom bindning av en poly (dimetylsiloxan) (PDMS) elastomer segmentinnehållande räfflor med ett täckglas 25. Därefter framställning av v-SUV med både lipid och innehåll markörer förklaras. §§ 4 och 5 ger instruktioner för montering av mikroflödesceller, bildar SBLs in situ och kontroll av defekter och smidighet, införande VSUVS in flödescellerna och detektering av fusionshändelser. Avsnitt 6 innehåller instruktioner för dataanalys.
Protocol
Representative Results
Discussion
Ett framgångsrikt genomförande av SUV-SBL fusion analys som beskrivs här beror kritiskt på flera viktiga steg, såsom funktionell beredning av proteiner i liposomer, få bra kvalitet SBLs, och välja rätt avbildningsparametrar för att detektera enstaka molekyler. Även om det kan ta lite tid och ansträngning för att lyckas, när analysen genomförs framgångsrikt, ger det en mängd information om fusionsprocess inte kan erhållas från någon annan in vitro fusionsanalys diskuteras i Introduktion. De ku…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We thank Vladimir Polejaev (Yale West Campus Imaging Core) for the design and construction of the polarized TIRF microscope, David Baddeley (Yale University) for help with two-color detection instrumentation, and James E. Rothman (Yale University) and Ben O’Shaughnessy (Columbia University) and members of their groups for stimulating discussions. EK is supported by a Kavli Neuroscience Scholar Award from the Kavli Foundation and NIH grant 1R01GM108954.
Materials
| Reagents | ||||
| Milli-Q (MQ) water | Millipore | |||
| KOH | J.T. Baker | 3040-05 | ||
| Ethanol 190 Proof | Decon | |||
| Isopropanol | Fisher Chemical | A416P4 | ||
| HEPES | AmericanBio | AB00892 | ||
| Sodium Cholride (KCl) | AB01915 | |||
| Dithiothreitol | AB00490 | |||
| N-[2-hydroxyethyl] piperazine-N'-[2-ethanesulfonic acid] (HEPES) | AmericanBio | AB00892 | ||
| EGTA | Acros Organics | 409911000 | ||
| Buffers | ||||
| HEPES-KOH buffer (pH 7.4) | 25 mM HEPES-KOH, 140 mM KCl, 100 μM EGTA, 1 mM DTT | |||
| Solvents | ||||
| Chloroform | J.T. Baker | 9180-01 | in glass bottle, CAUTION, wear PPE | |
| Methanol | J.T. Baker | 9070-03 | in glass bottle, CAUTION, wear PPE | |
| Liposome preparation | ||||
| Gastight Hamilton syringe | Hamilton | var. sizes | only use glass sringe with solents (Chlorophorm/ Methanon, 2:1, v/v) | http://www.hamiltoncompany.com |
| Glass tubes Pyrex Vista 11 ml, 16×100 mm screw cap culture tube | Pyrex | 70825-16 | clean thoroughly, rinse with chloroform | http://catalog2.corning.com/LifeSciences/ |
| 1-palmitoyl-2-oleoyl-sn-glycero-3-phosphocholine, 16:0-18:1 PC (POPC) | Avanti Polar Lipids | 850457 | Lipids come dissolved in CHCl3 or as lyphilized powder in sealed vials. Aliquot upon opening. Store extra as dried lipid films under inert atmosphere at -20 °C. Keep stocks in CHCl3/MeOH (2:1, v/v) at -20 °C. let come to RT before opening | http://www.avantilipids.com/ |
| 1,2-dioleoyl-sn-glycero-3-phospho-L-serine (sodium salt), 18:1 PS (DOPS) | 840035 | |||
| 1-stearoyl-2-arachidonoyl-sn-glycero-3-phosphoethanolamine, 18:0-20:4 PE (SAPE) | 850804 | |||
| L-α-phosphatidylinositol-4,5-bisphosphate (Brain, Porcine) (ammonium salt), Brain PI(4,5)P2 | 840046 | |||
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-(7-nitro-2-1,3-benzoxadiazol-4-yl) (ammonium salt), 18:1 NBD PE | 810145 | |||
| 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-2000] (ammonium salt), 18:1 PEG2000 PE | 880130 | |||
| cholesterol (ovine wool, >98%) | 700000 | |||
| DiD' oil; DiIC18(5) oil (1,1'-Dioctadecyl-3,3,3',3'-Tetramethylindodicarbocyanine Perchlorate) | Molecular Probes | D-307 | https://www.thermofisher.com/ | |
| Rotavapor R-210 | Buchi | R-210 | heat bath above Tm of lipids used | http://www.buchi.com/ |
| OG n-Octyl-β-D-Glucopyranoside | Affymetrix | 0311 | store at -20°C, let come to RT before opening | https://www.anatrace.com/ |
| Shaker – Eppendorf Thermomixer R | Eppendorf | https://www.eppendorf.com/ | ||
| Slide-A-Lyze Dialysis Cassettes, 20K MWCO, 3 mL | life technologies | 66003 | https://www.lifetechnologies.com/ | |
| Bio-Beads SM-2 Adsorbents | Bio-Rad | 1523920 | http://www.bio-rad.com/ | |
| OptiPrep Density Gradient Medium | Sigma-Aldrich | D1556 | http://www.sigmaaldrich.com/ | |
| Ultracentrifugation tube, Thinwall, Ultra-Clear, 13.2 mL, 14 x 89 mm | Beckman Coulter | 41121703 | https://www.beckmancoulter.com/ | |
| Beckman SW41 Ti rotor | ||||
| SuflorhodamineB | Molecular Probes | S-1307 | https://www.thermofisher.com/ | |
| Econo-Column Chromatography Columns, 2.5 × 10 cm | Bio-Rad | 7372512 | http://www.bio-rad.com/ | |
| Sepharose CL-4B | GE Healthcare | 17-0150-01 | http://www.gelifesciences.com/ | |
| SYPRO Orange Protein Gel Stain | Molecular Probes | S-6650 | 5,000X Concentrate in DMSO | https://www.lifetechnologies.com/ |
| PDMS block | ||||
| Sylgard 184 Silicone elastomer kit, PDMS | Dow Corning | 3097358-1004 | http://www.dowcorning.com/ | |
| Pyrex glass petri dish, 150 x 20 mm, complete with cover | Corning | 3160-152 | http://catalog2.corning.com/LifeSciences/ | |
| Hole puncher – Reusable Biopsy Punch, 0.75mm | World Precision Instruments | 504529 | http://www.wpi-europe.com/ | |
| Manual Hole Punching Machine | SYNEO | MHPM-UNV | http://www.syneoco.com/ | |
| Drill .035 x .026 x 1.5 304 SS TiN coated round punch | CR0350265N20R4 | drill diameter: 0.9 mm | ||
| Tygon Microbore tubing, 0.25 mm ID, 0.76 mm OD | Cole-Parmer | 06419-00 | 0.010" ID, 0.030" OD | http://www.coleparmer.com/ |
| Silicone Tubing (0.51 mm ID, 2.1 mm OD | 95802-00 | 0.020" ID, 0.083" OD | ||
| Cover glass - cleanroom cleaned | ||||
| Schott Nexterion cover slip glass D | Schott | 1472305 | http://www.us.schott.com/ | |
| plasma cleaner | Harrick | PDC-32G | http://harrickplasma.com/ | |
| pTIRF setup and accessories | ||||
| IX81 microscope body | Olympus | IX81 | http://www.olympus-lifescience.com/en/ | |
| EM CCD camera | Andor | ixon-ultra-897 | http://www.andor.com/ | |
| Thermo Plate, heated microscope stage | Tokai Hit | MATS-U52RA26 | http://www.tokaihit.com/ | |
| 1 ml hamilton glass syringes (4x) | Hamilton | 81365 | http://www.hamiltoncompany.com | |
| syringe pump | kd Scientific | KDS-230 | http://www.kdscientific.com/ |
References
- Sudhof, T. C., Rothman, J. E. Membrane fusion: grappling with SNARE and SM proteins. Science. 323, 474-477 (2009).
- Wickner, W., Schekman, R. Membrane fusion. Nat Struct Mol Biol. 15, 658-664 (2008).
- Harrison, S. C. Viral membrane fusion. Nat Struct Mol Biol. 15, 690-698 (2008).
- Jahn, R., Scheller, R. H. SNAREs–engines for membrane fusion. Nat Rev Mol Cell Biol. 7, 631-643 (2006).
- Lindau, M., Alvarez de Toledo, G. The fusion pore. Biochim Biophys Acta. 1641, 167-173 (2003).
- Staal, R. G., Mosharov, E. V., Sulzer, D. Dopamine neurons release transmitter via a flickering fusion pore. Nat Neurosci. 7, 341-346 (2004).
- Wu, Z., et al. Nanodisc-cell fusion: Control of fusion pore nucleation and lifetimes by SNARE protein transmembrane domains. Sci. Rep. 6, 27287 (2016).
- Alabi, A. A., Tsien, R. W. Perspectives on kiss-and-run: role in exocytosis, endocytosis, and neurotransmission. Ann Rev Physiol. 75, 393-422 (2013).
- Rossetto, O., Pirazzini, M., Montecucco, C. Botulinum neurotoxins: genetic, structural and mechanistic insights. Nature Rev Microbiol. 12, 535-549 (2014).
- Weber, T., et al. SNAREpins: minimal machinery for membrane fusion. Cell. 92, 759-772 (1998).
- Nickel, W., et al. Content mixing and membrane integrity during membrane fusion driven by pairing of isolated v-SNAREs and t-SNAREs. Proc Natl Acad Sci U S A. 96, 12571-12576 (1999).
- McNew, J. A., et al. Compartmental specificity of cellular membrane fusion encoded in SNARE proteins. Nature. 407, 153-159 (2000).
- Melia, T. J., You, D. Q., Tareste, D. C., Rothman, J. E. Lipidic antagonists to SNARE-mediated fusion. J Biol Chem. 281, 29597-29605 (2006).
- Hernandez, J. M., et al. Membrane fusion intermediates via directional and full assembly of the SNARE complex. Science. 336, 1581-1584 (2012).
- Fix, M., et al. Imaging single membrane fusion events mediated by SNARE proteins. Proc Natl Acad Sci U S A. 101, 7311-7316 (2004).
- Bowen, M. E., Weninger, K., Brunger, A. T., Chu, S. Single molecule observation of liposome-bilayer fusion thermally induced by soluble N-ethyl maleimide sensitive-factor attachment protein receptors (SNAREs). Biophys J. 87, 3569-3584 (2004).
- Liu, T., Tucker, W. C., Bhalla, A., Chapman, E. R., Weisshaar, J. C. SNARE-driven, 25-millisecond vesicle fusion in vitro. Biophys J. 89, 2458-2472 (2005).
- Yoon, T. Y., Okumus, B., Zhang, F., Shin, Y. K., Ha, T. Multiple intermediates in SNARE-induced membrane fusion. Proc Natl Acad Sci U S A. 103, 19731-19736 (2006).
- Diao, J., et al. A single-vesicle content mixing assay for SNARE-mediated membrane fusion. Nat Commun. 1, 1-6 (2010).
- Kyoung, M., et al. In vitro system capable of differentiating fast Ca2+-triggered content mixing from lipid exchange for mechanistic studies of neurotransmitter release. Proc Natl Acad Sci U S A. 108, E304-E313 (2011).
- Domanska, M. K., Kiessling, V., Stein, A., Fasshauer, D., Tamm, L. K. Single vesicle millisecond fusion kinetics reveals number of SNARE complexes optimal for fast SNARE-mediated membrane fusion. J Biol Chem. 284, 32158-32166 (2009).
- Kreutzberger, A. J., Kiessling, V., Tamm, L. K. High Cholesterol Obviates a Prolonged Hemifusion Intermediate in Fast SNARE-Mediated Membrane Fusion. Biophys J. 109, 319-329 (2015).
- Schwenen, L. L., et al. Resolving single membrane fusion events on planar pore-spanning membranes. Sci Rep. 5, 12006 (2015).
- Karatekin, E., et al. A fast, single-vesicle fusion assay mimics physiological SNARE requirements. Proc Natl Acad Sci U S A. 107, 3517-3521 (2010).
- Karatekin, E., Rothman, J. E. Fusion of single proteoliposomes with planar, cushioned bilayers in microfluidic flow cells. Nat Protoc. 7, 903-920 (2012).
- Smith, M. B., et al. Interactive, computer-assisted tracking of speckle trajectories in fluorescence microscopy: application to actin polymerization and membrane fusion. Biophys J. 101, 1794-1804 (2011).
- Stratton, B. S., et al. Cholesterol Increases the Openness of SNARE-mediated Flickering Fusion Pores. Biophysical journal. 110, (2016).
- Diao, J., et al. Synaptic proteins promote calcium-triggered fast transition from point contact to full fusion. Elife. 1, e00109 (2012).
- Kiessling, V., Domanska, M. K., Tamm, L. K. Single SNARE-mediated vesicle fusion observed in vitro by polarized TIRFM. Biophys J. 99, 4047-4055 (2010).
- Blasi, J., et al. Botulinum neurotoxin A selectively cleaves the synaptic protein SNAP-25. Nature. 365, 160-163 (1993).
- Washbourne, P., et al. Genetic ablation of the t-SNARE SNAP-25 distinguishes mechanisms of neuroexocytosis. Nat Neurosci. 5, 19-26 (2002).
- Diaz, A. J., Albertorio, F., Daniel, S., Cremer, P. S. Double cushions preserve transmembrane protein mobility in supported bilayer systems. Langmuir. 24, 6820-6826 (2008).
- Floyd, D. L., Ragains, J. R., Skehel, J. J., Harrison, S. C., van Oijen, A. M. Single-particle kinetics of influenza virus membrane fusion. Proc Natl Acad Sci U S A. 105, 15382-15387 (2008).
- Albertorio, F., et al. Fluid and air-stable lipopolymer membranes for biosensor applications. Langmuir. 21, 7476-7482 (2005).
- Daniel, S., Albertorio, F., Cremer, P. S. Making lipid membranes rough, tough, and ready to hit the road. Mrs Bulletin. 31, 536-540 (2006).
- Gao, Y., et al. Single reconstituted neuronal SNARE complexes zipper in three distinct stages. Science. 337, 1340-1343 (2012).
- Kenworthy, A. K., Hristova, K., Needham, D., Mcintosh, T. J. Range and Magnitude of the Steric Pressure between Bilayers Containing Phospholipids with Covalently Attached Poly(Ethylene Glycol). Biophys J. 68, 1921-1936 (1995).
- Knoll, W., et al. Solid supported lipid membranes: New concepts for the biomimetic functionalization of solid surfaces. Biointerphases. 3, Fa125-Fa135 (2008).
- Quinn, P., Griffiths, G., Warren, G. Density of newly synthesized plasma membrane proteins in intracellular membranes II. Biochemical studies. J Cell Biol. 98, 2142-2147 (1984).
- Sund, S. E., Swanson, J. A., Axelrod, D. Cell membrane orientation visualized by polarized total internal reflection fluorescence. Biophys J. 77, 2266-2283 (1999).
- Johnson, D. S., Toledo-Crow, R., Mattheyses, A. L., Simon, S. M. Polarization-controlled TIRFM with focal drift and spatial field intensity correction. Biophys J. 106, 1008-1019 (2014).
- Anantharam, A., Onoa, B., Edwards, R. H., Holz, R. W., Axelrod, D. Localized topological changes of the plasma membrane upon exocytosis visualized by polarized TIRFM. J Cell Biol. 188, 415-428 (2010).
- Axelrod, D. Carbocyanine dye orientation in red cell membrane studied by microscopic fluorescence polarization. Biophys J. 26, 557-573 (1979).
- Wang, T., Smith, E. A., Chapman, E. R., Weisshaar, J. C. Lipid mixing and content release in single-vesicle, SNARE-driven fusion assay with 1-5 msec resolution. Biophys J. 96, 4122-4131 (2009).
- Chernomordik, L. V., Frolov, V. A., Leikina, E., Bronk, P., Zimmerberg, J. The pathway of membrane fusion catalyzed by influenza hemagglutinin: restriction of lipids, hemifusion, and lipidic fusion pore formation. J Cell Biol. 140, 1369-1382 (1998).
- Takamori, S., et al. Molecular anatomy of a trafficking organelle. Cell. 127, 831-846 (2006).
- Wilhelm, B. G., et al. Composition of isolated synaptic boutons reveals the amounts of vesicle trafficking proteins. Science. 344, 1023-1028 (2014).
- Scott, B. L., et al. Liposome fusion assay to monitor intracellular membrane fusion machines. Methods Enzymol. 372, 274-300 (2003).
- Linkert, M., et al. Metadata matters: access to image data in the real world. J Cell Biol. 189, 777-782 (2010).
- Soumpasis, D. M. Theoretical analysis of fluorescence photobleaching recovery experiments. Biophys J. 41, 95-97 (1983).
- Ohki, S. A mechanism of divalent ion-induced phosphatidylserine membrane fusion. Biochim Biophys Acta. 689, 1-11 (1982).
- Berquand, A., et al. Two-step formation of streptavidin-supported lipid bilayers by PEG-triggered vesicle fusion. Fluorescence and atomic force microscopy characterization. Langmuir. 19, 1700-1707 (2003).
- Tamm, L. K., McConnell, H. M. Supported phospholipid bilayers. Biophys J. 47, 105-113 (1985).
- Rawle, R. J., van Lengerich, B., Chung, M., Bendix, P. M., Boxer, S. G. Vesicle fusion observed by content transfer across a tethered lipid bilayer. Biophys J. 101, L37-L39 (2011).
- Wagner, M. L., Tamm, L. K. Reconstituted syntaxin1a/SNAP25 interacts with negatively charged lipids as measured by lateral diffusion in planar supported bilayers. Biophys J. 81, 266-275 (2001).
- Kalb, E., Frey, S., Tamm, L. K. Formation of Supported Planar Bilayers by Fusion of Vesicles to Supported Phospholipid Monolayers. Biochimica Et Biophysica Acta. 1103, 307-316 (1992).

