Måling av partikkelstørrelsesfordelingen i Grumsete Solutions ved dynamisk lysspredning Mikros
Summary
En protokoll for direkte måling av partikkelstørrelsesfordelingen i konsentrerte løsninger ved hjelp av dynamisk lysspredning mikroskopi er presentert.
Abstract
A protocol for measuring polydispersity of concentrated polymer solutions using dynamic light scattering is described. Dynamic light scattering is a technique used to measure the size distribution of polymer solutions or colloidal particles. Although this technique is widely used for the assessment of polymer solutions, it is difficult to measure the particle size in concentrated solutions due to the multiple scattering effect or strong light absorption. Therefore, the concentrated solutions should be diluted before measurement. Implementation of the confocal optical component in a dynamic light scattering microscope1 helps to overcome this barrier. Using such a microscopic system, both transparent and turbid systems can be analyzed under the same experimental setup without a dilution. As a representative example, a size distribution measurement of a temperature-responsive polymer solution was performed. The sizes of the polymer chains in an aqueous solution were several tens of nanometers at a temperature below the lower critical solution temperature (LCST). In contrast, the sizes increased to more than 1.0 µm when above the LCST. This result is consistent with the observation that the solution turned turbid above the LCST.
Introduction
Particle size is one of the most fundamental properties of colloidal and polymer solutions. Numerous techniques are used to measure the particle size. Particle sizes of 1.0 µm or larger can be measured directly using an optical microscope. For smaller particles, alternative techniques, such as laser diffraction, electron microscopy, or atomic force microscopy, are used2,3. Dynamic light scattering is a commonly-used technique for the measurement of particle size distributions in solutions4. The results obtained using this technique are not derived from images of the particles but from the characteristic time of the fluctuations in scattered light intensity. These fluctuations originate from Brownian motion, which is characterized by a diffusion constant. The size distribution is obtained from the distribution of diffusion constants using the Einstein-Stokes equation. Due to its simplicity, dynamic light scattering is widely used for the routine assessment of solutions, such as paints and food colloids.
Pretreatment is required for most of the techniques used for the particle size measurement of solution samples. In the case of electron microscopy and atomic force microscopy, the sample must be analyzed under vacuum conditions. Therefore, it is difficult to observe the samples in their native forms. Furthermore, for laser diffraction and dynamic light scattering, only diluted samples that are free from multiple scattering and light absorption can be measured. To overcome this difficulty, several new techniques have been proposed for the measurement of dynamic light scattering from undiluted, concentrated solutions, such as cross-correlation spectroscopy5,6, low-coherence dynamic light scattering7,8, diffusing-wave spectroscopy9,10, and differential dynamic microscopy11,12.
We have developed a new apparatus called a dynamic light scattering microscope1. This apparatus enables us to measure turbid samples without dilution by means of a confocal optical system in which multiple scattering is eliminated using a pinhole. However, the measurement procedure and data analysis are slightly more complicated than those of commercially-available instruments. This video explains the measurement procedure and data analysis in detail using the analysis of the temperature-responsive polymer, poly(N-isopropylacrylamide), as an example.
Protocol
Representative Results
Discussion
Den innledende amplitude av tiden korrelasjonsfunksjonen er svært avhengig av navet, som vist i figur 2 (a). Dette motsier tilsynelatende det faktum at løsningen er homogen (med unntak av det tynne lag ved grenseflaten) 8. Denne variasjon i den innledende amplitude skyldes en variasjon i mengden av reflektert lys. Delvis heterodyne teori 16 forutsier at den innledende amplitude, A, den spredte lysintensiteten, jeg s, og den reflekterte lysintensitet, I r, tilfredsstiller den følgende ligning 1
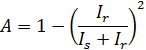
Denne ligning viser at den større I r blir, blir mindre A. Derfor er en redusert ved å sette fokus posisjon nær grensesnittet. Den tilsynelatende diffusjon konstant D A can oppnås ved å montere den tid korrelasjonsfunksjonen i tilfelle av monodisperse løsninger:
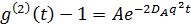
hvor 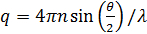 . Her, n er brytningsindeksen for det oppløsningsmiddel (vann, 1,33), er θ det spredte vinkel (180 °), og λ er bølgelengden for lys (514,5 nm). Siden vi brukt backscattering geometri, er verdien av q fast. Imidlertid er dette punktet løses ved å bruke forskjellige bølgelengder av lys. Legg merke til at enhver form for kontinuerlig-bølge laser kilde er tilgjengelig for å konstruere DLS mikroskop. Takket være den lille bestrålte volum, blir koherensen faktor 17 anslått til å være mer enn 0,99 og er neglisjerbar. For polydisperse løsninger, er fordelingsfunksjonen av D A erholdt ved den inverse Laplace-transformasjonen. Delvis heterodyne theory forutsier også at D A er ikke den samme som den faktiske diffusjonskonstant D. Disse to konstanter diffusjon tilfredsstiller følgende ligning:
. Her, n er brytningsindeksen for det oppløsningsmiddel (vann, 1,33), er θ det spredte vinkel (180 °), og λ er bølgelengden for lys (514,5 nm). Siden vi brukt backscattering geometri, er verdien av q fast. Imidlertid er dette punktet løses ved å bruke forskjellige bølgelengder av lys. Legg merke til at enhver form for kontinuerlig-bølge laser kilde er tilgjengelig for å konstruere DLS mikroskop. Takket være den lille bestrålte volum, blir koherensen faktor 17 anslått til å være mer enn 0,99 og er neglisjerbar. For polydisperse løsninger, er fordelingsfunksjonen av D A erholdt ved den inverse Laplace-transformasjonen. Delvis heterodyne theory forutsier også at D A er ikke den samme som den faktiske diffusjonskonstant D. Disse to konstanter diffusjon tilfredsstiller følgende ligning:
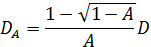
Diffusjonskonstanten D omdannes til den hydrodynamiske radius R h ved bruk av Einsteins-Stokes ligning 4. Når A = 1, blir dette forholdet D A = D. I dette tilfelle er datakonverteringsprosessen den samme som for den felles dynamisk lysspredning. Den røde linje vist i figur 2 (b) tilsvarer dette tilfellet. I motsetning til dette, blir dette forholdet D A = 0,5 D på grensen av A → 0. Derfor er størrelsen anslått til å være dobbelt så stor som den faktiske størrelsen når A er liten (i praksis, mindre enn 0,2), som vist ved blå linje på figur 2 (b) </strong>. Hvis vi vet at A er vesentlig liten, kan den horisontale aksen forskyves, slik som vist i figur 2 (c). I prinsippet kan vi konvertere D A til D for enhver verdi av A. I praksis er det imidlertid bedre å sette den innledende amplitude som er mindre enn 0,2, fordi den enkle tilnærming D A ~ 0,5 D gjelder.
Den fremtredende trekk ved dynamisk lysspredning mikroskop teknikken ble demonstrert ved hjelp av en PNIPA løsning. Den konformasjon av PNIPA under og over LCST har blitt grundig studert ved hjelp av små-vinkel nøytron spredning 15,18. I motsetning til dette, har dynamisk lysspredning ikke blitt benyttet for analyse av PNIPA ovenfor LCST på grunn av dens turbiditet 19. Dette problem løses ved dynamisk lysspredning mikroskop, som vist i figur 3 (a) og (b). Størrelsen på disse aggregater er flere &# 181; m, noe som ikke kan oppnås ved enten liten vinkel røntgen / nøytronspredning eller konvensjonelle lysspredningsteknikker. Tids løst målinger ved hjelp av dette systemet gi informasjon om aggregering prosessen i løpet av temperaturendringer.
Ulempen med dynamisk lysspredning mikroskop er også illustrert i figur 3. For resultatet under LCST er tidskorrelasjonsfunksjonen sterkt preget av svært liten mengde støv tilstede (de svarte linjene i figur 3). For eksempel, ikke tidskorrelasjonsfunksjonen ikke råtner helt, selv med korrelasjonstider i størrelsesorden 1,0 sek. Dette er fordi volumet bestråles med dette apparat (ca. 1,0 mm) er betydelig mindre enn det bestrålt med vanlig dynamisk lysspredning apparat (ca. 100 pm). I de tilfeller hvor intensiteten av spredt lys er svak, blir signalet skjules av støy, slik som den som forårsakes av small mengder støv i løsningen. Derfor kan de tre toppene er vist i figur 3 (b) ikke har kvantitativ betydning, selv om den generelle rekkefølgen av størrelsen er meningsfylt. Legg merke til at en slik svak spredningsobjekt kan måles ved en konvensjonell dynamisk lysspredning apparat.
Vi har vist at dynamisk lysspredning mikroskop gjør oss i stand til å måle både gjennomsiktige og grumsete prøver med samme oppsett. Siden den optiske veilengde i prøvene er kort, kan denne teknikken bli anvendt for sterkt lys-absorberende prøver, slik som karbon nanorør suspensjoner 20. I tillegg, på grunn av høy romlig oppløsning, denne teknikken kan anvendes på biologiske celler. For sin anvendelse til biologi, kan denne metoden også kan kombineres med andre avbildningsteknikker, slik som fluorescens og Raman avbildning. Følgelig tror vi at den dynamisk lysspredning mikroskop er et kraftig verktøy for et omfattende forskningsfelt.
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work has been financially supported by Grants-in-Aid for Scientific Research from the Ministry of Education, Culture, Sports, Science, and Technology (No. 25248027 to M.S.).
Materials
| N-isopropylacrylamide, 98% | Tokyo Chemical Industry Co., Ltd. | I0401 | |
| toluene, 99% | Wako Pure Chemical Industries, Ltd. | 201-01876 | |
| petroleum ether, distillation temperature 30 ~ 60 °C | Wako Pure Chemical Industries, Ltd. | 169-22565 | |
| N,N,N',N'-tetramethylethylenediamine, 99% | Sigma | T9281 | |
| ammonium persulfate, 98% | Sigma | 248614 | |
| polystyrene latex suspension, 1 wt% | Duke Scientific Corporation | 3500A | |
| argon | Koike Sanso Kogyo Co., Ltd. | purity > 99.999 vol.% | |
| cavity slide | Matsunami Glass Ind.,Ltd. | 83-0336 | |
| inverted microscope | Nikon Instech Co., Ltd. | ECLIPSE Ti-U | |
| Thermo Plate | Tokai Hit CO.,Ltd | TP-108R-C | |
| Ar-Kr ion laser | Spectra-Physics | Stabilite 2018 | |
| avalanche photodiode | ALV-GmbH | ALV-High Q.E. Avalanche Photo Diode | |
| correlator | ALV-GmbH | ALV-5000/EPP |
References
- Hiroi, T., Shibayama, M. Dynamic Light Scattering Microscope: Accessing Opaque Samples with High Spatial Resolution. Opt. Express. 21, 20260-20267 (2013).
- Barth, H. G., Flippen, R. B. Particle Size Analysis. Anal. Chem. 67, 257-272 (1995).
- Liu, Y., Wang, Z., Zhang, X. Characterization of supramolecular polymers. Chem. Soc. Rev. 41, 5922-5932 (2012).
- Berne, B. J., Pecora, R. . Dynamic Light Scattering with Applications to Chemistry, Biology and Physics. , (2000).
- Phillies, G. D. J. Experimental demonstration of ruultiple-scattering suppression in quasielastic-light-scattering spectroscopy by homodyne coincidence techniques. Phys. Rev. A. 24, 1939-1943 (1981).
- Phillies, G. D. J. Suppression of multiple scattering effects in quasielastic light scattering by homodyne crosscorrelation techniques. J. Chem. Phys. 74, 260-262 (1981).
- Ishii, K., Yoshida, R., Iwai, T. Single-scattering spectroscopy for extremely dense colloidal suspensions by use of a low-coherence interferometer. Opt. Lett. 30, 555-557 (2005).
- Xia, H., Ishi, K., Iwai, T. Hydrodynamic Radius Sizing of Nanoparticles in Dense Polydisperse Media by Low-Coherence Dynamic Light Scattering. Jpn. J. Appl. Phys. 44, 6261-6264 (2005).
- Maret, G., Wolf, P. E. Multiple light scattering from disordered media. The effect of brownian motion of scatterers. Z. Phys. B. 65, 409-413 (1987).
- Pine, D. J., Weitz, D. A., Chaikin, P. M., Herbolzheimer, E. Diffusing wave spectroscopy. Phys. Rev. Lett. 60, 1134-1137 (1988).
- Cerbino, R., Trappe, V. Differential Dynamic Microscopy: ProbingWave Vector Dependent Dynamics with a Microscope. Phys. Rev. Lett. 108, 188102 (2012).
- Lu, P. J., et al. Characterizing Concentrated, Multiply Scattering, and Actively Driven Fluorescent Systems with Confocal Differential Dynamic Microscopy. Phys. Rev. Lett. 108, 218103 (2012).
- Provencher, S. W. A constrained regularization method for investing data represented by linear algebraic or integral equations. Comp. Phys. Comm. 27, 213-227 (1982).
- Provencher, S. W., Stepanek, P. Global analysis of dynamic light scattering autocorrelation functions. Part. Part. Syst. Charact. 13, 291 (1996).
- Takata, S., Norisuye, T., Shibayama, M. Small-angle Neutron Scattering Study on Preparation Temperature Dependence of Thermosensitive Gels. Macromolecules. 35, 4779-4784 (2002).
- Pusey, P. N., van Megen, W. Dynamic Light Scattering by Non-Ergodic Media. Physica A. 157, 705-741 (1989).
- Chu, B. . Laser Light Scattering. 2nd Ed. , (1991).
- Shibayama, M., Tanaka, T., Han, C. C. Small-Angle Neutron-Scattering Study on Poly(N-Isopropyl Acrylamide) Gels near Their Volume-Phase Transition-Temperature. J. Chem. Phys. 97, 6829-6841 (1992).
- Tanaka, T., Sato, E., Hirokawa, Y., Hirotsu, S., Peetermans, J. Critical Kinetics of Volume Phase Transition of Gels. Phys. Rev. Lett. 55, 2455-2458 (1985).
- Hiroi, T., Ata, S., Shibayama, M. Transitions of Aggregation States for Concentrated Carbon Nanotube Dispersion. J. Phys. Chem. C. 120, 5776-5782 (2016).

