Mätning av partikelstorleksfördelning i grumliga lösningar genom dynamisk ljusspridning Mikroskopi
Summary
Ett protokoll för direkt mätning av partikelstorleksfördelning i koncentrerade lösningar med dynamisk ljusspridning mikroskopi presenteras.
Abstract
A protocol for measuring polydispersity of concentrated polymer solutions using dynamic light scattering is described. Dynamic light scattering is a technique used to measure the size distribution of polymer solutions or colloidal particles. Although this technique is widely used for the assessment of polymer solutions, it is difficult to measure the particle size in concentrated solutions due to the multiple scattering effect or strong light absorption. Therefore, the concentrated solutions should be diluted before measurement. Implementation of the confocal optical component in a dynamic light scattering microscope1 helps to overcome this barrier. Using such a microscopic system, both transparent and turbid systems can be analyzed under the same experimental setup without a dilution. As a representative example, a size distribution measurement of a temperature-responsive polymer solution was performed. The sizes of the polymer chains in an aqueous solution were several tens of nanometers at a temperature below the lower critical solution temperature (LCST). In contrast, the sizes increased to more than 1.0 µm when above the LCST. This result is consistent with the observation that the solution turned turbid above the LCST.
Introduction
Particle size is one of the most fundamental properties of colloidal and polymer solutions. Numerous techniques are used to measure the particle size. Particle sizes of 1.0 µm or larger can be measured directly using an optical microscope. For smaller particles, alternative techniques, such as laser diffraction, electron microscopy, or atomic force microscopy, are used2,3. Dynamic light scattering is a commonly-used technique for the measurement of particle size distributions in solutions4. The results obtained using this technique are not derived from images of the particles but from the characteristic time of the fluctuations in scattered light intensity. These fluctuations originate from Brownian motion, which is characterized by a diffusion constant. The size distribution is obtained from the distribution of diffusion constants using the Einstein-Stokes equation. Due to its simplicity, dynamic light scattering is widely used for the routine assessment of solutions, such as paints and food colloids.
Pretreatment is required for most of the techniques used for the particle size measurement of solution samples. In the case of electron microscopy and atomic force microscopy, the sample must be analyzed under vacuum conditions. Therefore, it is difficult to observe the samples in their native forms. Furthermore, for laser diffraction and dynamic light scattering, only diluted samples that are free from multiple scattering and light absorption can be measured. To overcome this difficulty, several new techniques have been proposed for the measurement of dynamic light scattering from undiluted, concentrated solutions, such as cross-correlation spectroscopy5,6, low-coherence dynamic light scattering7,8, diffusing-wave spectroscopy9,10, and differential dynamic microscopy11,12.
We have developed a new apparatus called a dynamic light scattering microscope1. This apparatus enables us to measure turbid samples without dilution by means of a confocal optical system in which multiple scattering is eliminated using a pinhole. However, the measurement procedure and data analysis are slightly more complicated than those of commercially-available instruments. This video explains the measurement procedure and data analysis in detail using the analysis of the temperature-responsive polymer, poly(N-isopropylacrylamide), as an example.
Protocol
Representative Results
Discussion
Den initiala amplituden för tidskorrelationsfunktion beror i hög grad på den brännpunkt, såsom visas i fig 2 (a). Detta motsäger till synes det faktum att lösningen är homogen (med undantag för det tunna skiktet vid gränsytan) 8. Denna variation i den initiala amplituden skrivs en variation i mängden av reflekterat ljus. Partiell heterodyn teori 16 förutsäger att den initiala amplitud, A, det spridda ljuset Intensitet, I s, och det reflekterade ljusets intensitet, Ir, uppfylla följande ekvation 1
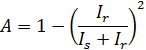
Denna ekvation visar att den större Ir blir, blir den mindre A. Därför är ett minskas genom att ställa in fokalpositionen nära gränsytan. Den skenbara diffusion konstant D A can erhållas genom att anpassa tidskorrelationsfunktion i fallet med monodispersa lösningar:
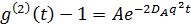
var 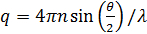 . Här, n är brytningsindex för lösningsmedlet (vatten, 1,33), är θ det spridda vinkeln (180 °), och λ är våglängden för ljus (514,5 nm). Eftersom vi tillämpade bakåtspridning geometri, är värdet på q fast. Emellertid är denna punkt löses genom användning av olika ljusvåglängder. Observera att någon form av kontinuerlig våg laserkälla finns att konstruera DLS mikroskop. Tack vare den lilla bestrålad volym, samstämmighet faktor 17 uppskattas till mer än 0,99 och är försumbar. För polydispersa lösningar, är fördelningsfunktionen för D A erhålls genom den inversa Laplace transformation. Partiella heterodyn theory förutspår också att D A inte är densamma som den faktiska diffusionskonstanten D. Dessa två diffusionskonstanter uppfyller följande ekvation:
. Här, n är brytningsindex för lösningsmedlet (vatten, 1,33), är θ det spridda vinkeln (180 °), och λ är våglängden för ljus (514,5 nm). Eftersom vi tillämpade bakåtspridning geometri, är värdet på q fast. Emellertid är denna punkt löses genom användning av olika ljusvåglängder. Observera att någon form av kontinuerlig våg laserkälla finns att konstruera DLS mikroskop. Tack vare den lilla bestrålad volym, samstämmighet faktor 17 uppskattas till mer än 0,99 och är försumbar. För polydispersa lösningar, är fördelningsfunktionen för D A erhålls genom den inversa Laplace transformation. Partiella heterodyn theory förutspår också att D A inte är densamma som den faktiska diffusionskonstanten D. Dessa två diffusionskonstanter uppfyller följande ekvation:
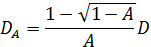
Diffusionskonstanten D omvandlas till den hydrodynamiska radien R h med hjälp av Einstein-Stokes ekvation 4. När A = 1, blir detta förhållande D A = D. I detta fall är dataomvandlingsprocessen densamma som för den gemensamma dynamisk ljusspridning. Den röda linjen som visas i figur 2 (b) motsvarar detta fall. I motsats härtill blir detta förhållande D A = 0,5 D på gränsen för A → 0. Därför är storleken uppskattas vara dubbelt så stor som den verkliga storleken när A är liten (i praktiken mindre än 0,2), såsom visas med den blå linje i figur 2 (b) </sTrong>. Om vi vet att A är signifikant liten, kan den horisontella axeln förskjutas, såsom visas i fig 2 (c). I princip kan vi omvandla D A in D för godtyckligt värde på A. I praktiken är det dock bättre att ställa den initiala amplituden är mindre än 0,2, eftersom enkel approximation D A ~ 0,5 D håller streck.
De framträdande dragen i dynamisk ljusspridning mikroskop teknik visades med hjälp av en PNIPA lösning. Konformation PNIPA under och över LCST har studerats med hjälp av små vinklar neutronspridning 15,18. Däremot har dynamisk ljusspridning inte utnyttjats för analys av PNIPA ovanför LCST på grund av dess turbiditet 19. Detta problem löses genom dynamisk ljusspridning mikroskop, såsom visas i figurerna 3 (a) och (b). Storleken på dessa aggregat är flera &# 181; m, som inte kan erhållas genom antingen liten vinkel X-ray / neutronspridning eller konventionella ljusspridningstekniker. Tidsupplösta mätningar med användning av detta system ger information om aggregering processen under temperaturändring.
Nackdelen med den dynamiska ljusspridningsmikroskop illustreras också i figur 3. För resultatet under LCST är tidskorrelationsfunktion påverkas starkt av den mycket lilla mängden av damm som finns (de svarta linjerna i fig 3). Till exempel ser tidskorrelationsfunktionen inte förfalla helt, även med korrelationstider i storleksordningen 1,0 s. Detta beror på att volymen bestrålas med denna apparat (approximativt 1,0 ^ m) är betydligt mindre än den bestrålade med den vanliga dynamisk ljusspridning apparat (cirka 100 ^ m). I de fall där intensiteten av spritt ljus är svag, signalen skymd av bruset, såsom det som orsakas av sköpcentret mängder damm i lösningen. Därför kan de tre topparna som visas i Figur 3 (b) inte har kvantitativ betydelse även om den allmänna ordningen i storlek är meningsfull. Notera att en sådan svag spridare kan mätas genom en konventionell dynamisk ljusspridning apparat.
Vi har visat att dynamisk ljusspridning mikroskop kan vi mäta både öppna och grumliga prover med samma inställningar. Eftersom den optiska väglängden i proven är kort, kan denna teknik användas till starka ljusabsorberande prover, såsom Nanorör suspensioner 20. Dessutom, på grund av dess höga rumsliga upplösning, denna teknik kan tillämpas på biologiska celler. För dess tillämpning till biologi, kan denna metod också kombineras med andra avbildningstekniker, såsom fluorescens och Raman avbildning. Således tror vi att den dynamiska ljusspridnings mikroskop är ett kraftfullt verktyg för ett brett spektrum av forskningsområden.
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work has been financially supported by Grants-in-Aid for Scientific Research from the Ministry of Education, Culture, Sports, Science, and Technology (No. 25248027 to M.S.).
Materials
| N-isopropylacrylamide, 98% | Tokyo Chemical Industry Co., Ltd. | I0401 | |
| toluene, 99% | Wako Pure Chemical Industries, Ltd. | 201-01876 | |
| petroleum ether, distillation temperature 30 ~ 60 °C | Wako Pure Chemical Industries, Ltd. | 169-22565 | |
| N,N,N',N'-tetramethylethylenediamine, 99% | Sigma | T9281 | |
| ammonium persulfate, 98% | Sigma | 248614 | |
| polystyrene latex suspension, 1 wt% | Duke Scientific Corporation | 3500A | |
| argon | Koike Sanso Kogyo Co., Ltd. | purity > 99.999 vol.% | |
| cavity slide | Matsunami Glass Ind.,Ltd. | 83-0336 | |
| inverted microscope | Nikon Instech Co., Ltd. | ECLIPSE Ti-U | |
| Thermo Plate | Tokai Hit CO.,Ltd | TP-108R-C | |
| Ar-Kr ion laser | Spectra-Physics | Stabilite 2018 | |
| avalanche photodiode | ALV-GmbH | ALV-High Q.E. Avalanche Photo Diode | |
| correlator | ALV-GmbH | ALV-5000/EPP |
References
- Hiroi, T., Shibayama, M. Dynamic Light Scattering Microscope: Accessing Opaque Samples with High Spatial Resolution. Opt. Express. 21, 20260-20267 (2013).
- Barth, H. G., Flippen, R. B. Particle Size Analysis. Anal. Chem. 67, 257-272 (1995).
- Liu, Y., Wang, Z., Zhang, X. Characterization of supramolecular polymers. Chem. Soc. Rev. 41, 5922-5932 (2012).
- Berne, B. J., Pecora, R. . Dynamic Light Scattering with Applications to Chemistry, Biology and Physics. , (2000).
- Phillies, G. D. J. Experimental demonstration of ruultiple-scattering suppression in quasielastic-light-scattering spectroscopy by homodyne coincidence techniques. Phys. Rev. A. 24, 1939-1943 (1981).
- Phillies, G. D. J. Suppression of multiple scattering effects in quasielastic light scattering by homodyne crosscorrelation techniques. J. Chem. Phys. 74, 260-262 (1981).
- Ishii, K., Yoshida, R., Iwai, T. Single-scattering spectroscopy for extremely dense colloidal suspensions by use of a low-coherence interferometer. Opt. Lett. 30, 555-557 (2005).
- Xia, H., Ishi, K., Iwai, T. Hydrodynamic Radius Sizing of Nanoparticles in Dense Polydisperse Media by Low-Coherence Dynamic Light Scattering. Jpn. J. Appl. Phys. 44, 6261-6264 (2005).
- Maret, G., Wolf, P. E. Multiple light scattering from disordered media. The effect of brownian motion of scatterers. Z. Phys. B. 65, 409-413 (1987).
- Pine, D. J., Weitz, D. A., Chaikin, P. M., Herbolzheimer, E. Diffusing wave spectroscopy. Phys. Rev. Lett. 60, 1134-1137 (1988).
- Cerbino, R., Trappe, V. Differential Dynamic Microscopy: ProbingWave Vector Dependent Dynamics with a Microscope. Phys. Rev. Lett. 108, 188102 (2012).
- Lu, P. J., et al. Characterizing Concentrated, Multiply Scattering, and Actively Driven Fluorescent Systems with Confocal Differential Dynamic Microscopy. Phys. Rev. Lett. 108, 218103 (2012).
- Provencher, S. W. A constrained regularization method for investing data represented by linear algebraic or integral equations. Comp. Phys. Comm. 27, 213-227 (1982).
- Provencher, S. W., Stepanek, P. Global analysis of dynamic light scattering autocorrelation functions. Part. Part. Syst. Charact. 13, 291 (1996).
- Takata, S., Norisuye, T., Shibayama, M. Small-angle Neutron Scattering Study on Preparation Temperature Dependence of Thermosensitive Gels. Macromolecules. 35, 4779-4784 (2002).
- Pusey, P. N., van Megen, W. Dynamic Light Scattering by Non-Ergodic Media. Physica A. 157, 705-741 (1989).
- Chu, B. . Laser Light Scattering. 2nd Ed. , (1991).
- Shibayama, M., Tanaka, T., Han, C. C. Small-Angle Neutron-Scattering Study on Poly(N-Isopropyl Acrylamide) Gels near Their Volume-Phase Transition-Temperature. J. Chem. Phys. 97, 6829-6841 (1992).
- Tanaka, T., Sato, E., Hirokawa, Y., Hirotsu, S., Peetermans, J. Critical Kinetics of Volume Phase Transition of Gels. Phys. Rev. Lett. 55, 2455-2458 (1985).
- Hiroi, T., Ata, S., Shibayama, M. Transitions of Aggregation States for Concentrated Carbon Nanotube Dispersion. J. Phys. Chem. C. 120, 5776-5782 (2016).

