非キレート化ガドリニウム(III)のためのアプタマーベースのセンサー
Summary
The use of polydeoxynucleotide (44-mer aptamer) molecules for sensing unchelated gadolinium(III) ion in an aqueous solution is described. The presence of the ion is detected via an increase in the fluorescence emission of the sensor.
Abstract
A method for determining the presence of unchelated trivalent gadolinium ion (Gd3+) in aqueous solution is demonstrated. Gd3+ is often present in samples of gadolinium-based contrast agents as a result of incomplete reactions between the ligand and the ion, or as a dissociation product. Since the ion is toxic, its detection is of critical importance. Herein, the design and usage of an aptamer-based sensor (Gd-sensor) for Gd3+ are described. The sensor produces a fluorescence change in response to increasing concentrations of the ion, and has a limit of detection in the nanomolar range (~100 nM with a signal-to-noise ratio of 3). The assay may be run in an aqueous buffer at ambient pH (~7 – 7.4) in a 384-well microplate. The sensor is relatively unreactive toward other physiologically relevant metal ions such as sodium, potassium, and calcium ions, although it is not specific for Gd3+ over other trivalent lanthanides such as europium(III) and terbium(III). Nevertheless, the lanthanides are not commonly found in contrast agents or the biological systems, and the sensor may therefore be used to selectively determine unchelated Gd3+ in aqueous conditions.
Introduction
技術固有の感度によって制限され、臨床診断、磁気共鳴イメージング(MRI)の重要性の高まりは、新規ガドリニウムベースの造影剤(GBCAs)1の開発の研究の急速な成長をもたらしました。 GBCAsは、画像品質を改善するために投与される分子であり、それらは、典型的には、多座配位子に配位価のガドリニウムイオン(Gdの3+)の化学構造を有します。非キレートのGd 3+は有毒であるように、この複合体形成は極めて重要です。それは、腎疾患または障害2と一部の患者における腎性全身性線維症の発症に関与しています。その結果、水性の遊離イオンを検出することがGBCAsの安全性を確保することに尽力しています。 GBCAソリューションの非キレート化のGd 3+の存在は、多くの場合、リガンドとイオン、複合体の解離、またはdisplacemen間の不完全な反応の結果であります他の生物学的金属カチオン3によってトン。
現在のGd 3+、汎用性および適用4の観点で最も高いクロマトグラフィーおよび/または分析のランクに依存するそれらの存在を決定するために使用されるいくつかの技術のうち。それらの長所の中でも、高感度および精度、(リストを、複数のGd 3+複合体の同時定量(ヒト血清5、尿及び毛髪6、廃水7、及び造影剤配合物8を含む) は 、種々のサンプルマトリックスを分析する能力であります研究の2013年前にはTelgmann ら )4により包括的なレビューに記載されています。唯一の欠点は、これらの方法のいくつかは、いくつかの研究室がアクセス権を持っていないかもしれません(そのような誘導結合プラズマ質量分析など)計測器4を必要とすることです。研究や概念実証レベルでの新たなGBCA発見の文脈の中で、ARelativelyより、便利で迅速、かつ費用対効果の高い分光ベースの方法は、(例えば、UV-可視吸収または蛍光のような)価値のある代替物として機能することができます。心の中でこれらのアプリケーションでは、水のGd 3+のための蛍光アプタマーベースのセンサは9を開発しました。
アプタマー(GD-アプタマー)が指数関数的濃縮(SELEX)9によるリガンドの系統的進化の過程を経て単離した塩基の特定の配列を有する44塩基長の一本鎖DNA分子です。蛍光センサーにアプタマーを適応させるために、フルオロフォアは、その後13相補的塩基( 図1)を介して急冷ストランド(QS)とハイブリダイズされた鎖の5 '末端に結合しています。 QSは、3 '末端ダーククエンチャー分子でタグ付けされています。 Gd 3+の非存在下では、1からなるセンサ(GD-センサー):それぞれのGd-アプタマーとQSの2モル比は、最小の蛍光発光によるTを有していますクエンチャーへのフルオロフォアからOエネルギー移動。水性のGd 3+を添加すると、蛍光発光の増加をもたらす、のGd-アプタマーからQSを置換します。
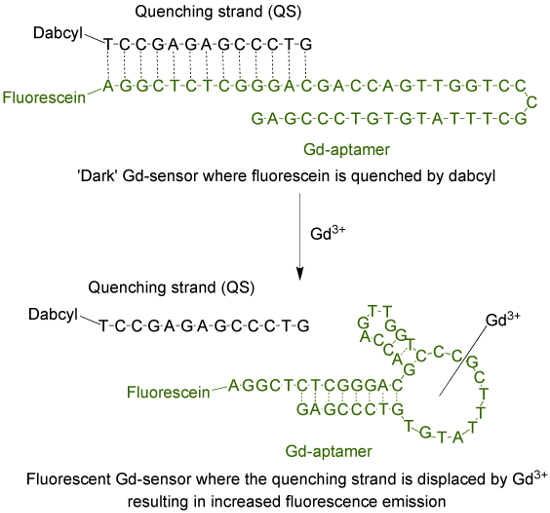
フルオレセイン(蛍光団)とダブシルでタグ付けされた13塩基長の消光ストランド(QS)でタグ付けされた44塩基長のアプタマー(GD-アプタマー)(ダーククエンチャー)で構成され 、図1 のセンサ(GD-センサー) 。非キレート化のGd 3+の非存在下では、センサの蛍光は最小です。 Gd 3+を添加し、QSの変位が発生し、蛍光発光の増加が観察されます。 この図の拡大版をご覧になるにはこちらをクリックしてください。
検出のための1つの一般的に使用される分光ベースの方法は、現在ではあり水性のGd 3+をる。このアッセイは、イオン10にキレート化時に433から573 nmの最大吸収波長のシフトを起こす分子キシレノールオレンジを使用しています。これら二つの吸光度最大値の比率は、非キレート化のGd 3+の量を定量するために使用することができます。 2つの方法は、標的選択性、定量の線形範囲は、検出様式(例えば、pH及び使用する緩衝液の組成など)は、異なる反応条件を有するようにアプタマーセンサーは、キシレノールオレンジアッセイに代わるもの(これも相補的であってもよい)であります9。
Protocol
Representative Results
Discussion
アプタマーベースのGd-センサを用いて、非キレート化のGd 3+の濃度に比例する蛍光発光の増加が観察されます。使用されるサンプルの量を最小にするために、アッセイは、ウェル当たり45μLの全試料体積で384ウェルマイクロプレートで実行されてもよいです。この設計では、フルオレセイン(FAM)およびダブシル(DAB)の選択は、主に、試薬のコストに基づいていました。発光波長、?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We would like to gratefully acknowledge Dr. Milan N Stojanovic from Columbia University, New York, NY for valuable scientific input. This work is supported by funding from the California State University East Bay (CSUEB) and the CSUEB Faculty Support Grant-Individual Researcher. O.E., T.C., and A.L. were supported by the CSUEB Center for Student Research (CSR) Fellowship.
Materials
| Gd-aptamer | IDTDNA | Input sequence and fluorophore modification in the order form | A fluorophore with a different emission wavelength may be used. The aptamer may also be ordered from another company. |
| Quenching strand | IDTDNA | Input sequence and quencher modification in the order form | A different quencher for optimal energy transfer from the fluorophore may be used. The aptamer may also be ordered from another company. |
| Molecular biology grade water | No specific manufacturer, both DEPC or non-DEPC treated work equally well | ||
| Gadolinium(III) chloride anhydrous | Strem | 936416 | Toxic |
| HEPES | Fisher Scientific | BP310-500 | |
| Magnesium chloride anhydrous | MP Biomedicals | 0520984480 – 100 g | |
| Sodium Chloride | Acros Organics | 327300025 | |
| Potassium chloride | Fisher Scientific | P333-500 | |
| Sodium hydroxide, pellets | Fisher Scientific | BP359 | Corrosive |
| Hydrochloric acid | Fisher Scientific | SA49 | Toxic and corrosive |
| 384-well low flange black flat bottom polystyrene NBS plates | Corning | 3575 | Plates which are suitable for fluorescence reading are required. |
| Nalgene Rapid-Flow sterile disposable bottle top filter | Thermo Scientific | 5680020 | The bottle top is fitted with 0.2 micron PES membrane |
| Disposable sterile bottles 250 mL | Corning | 430281 | A larger or smaller bottle may be used |
| 1.5 mL microcentrifuge tubes | No specific manufacturer, as long as they are DNAse and RNAse-free | ||
| 0.2 mL PCR tubes | No specific manufacturer, as long as they are DNAse and RNAse-free | ||
| Micropipets | No specific manufacturer | ||
| Pipet tips (non filter) of appropriate sizes | No specific manufacturer, as long as they are DNAse and RNAse-free | ||
| Name of Equipment | |||
| Plate reader | Biotek Synergy H1 | Plate readers from other manufacturers would work equally well |
References
- Shen, C., New, E. J. Promising strategies for Gd-based responsive magnetic resonance imaging contrast agents. Curr. Opin. Chem. Biol. 17 (2), 158-166 (2013).
- Cheong, B. Y. C., Muthupillai, R. Nephrogenic systemic fibrosis: a concise review for cardiologists. Tex. Heart Inst. J. 37 (5), 508-515 (2010).
- Hao, D., Ai, T., Goerner, F., Hu, X., Runge, V. M., Tweedle, M. MRI contrast agents: basic chemistry and safety. J Magn. Reson. Imaging. 36 (5), 1060-1071 (2012).
- Telgmann, L., Sperling, M., Karst, U. Determination of gadolinium-based MRI contrast agents in biological and environmental samples: a review. Anal. Chim. Acta. 764, 1-16 (2013).
- Frenzel, T., Lengsfeld, P., Schirmer, H., Hütter, J., Weinmann, H. -. J. Stability of gadolinium-based magnetic resonance imaging contrast agents in human serum at 37 degrees C. Invest. Radiol. 43 (12), 817-828 (2008).
- Loreti, V., Bettmer, J. Determination of the MRI contrast agent Gd-DTPA by SEC-ICP-MS. Anal. Bioanal. Chem. 379 (7), 1050-1054 (2004).
- Telgmann, L., et al. Speciation and isotope dilution analysis of gadolinium-based contrast agents in wastewater. Environ. Sci. Technol. 46 (21), 11929-11936 (2012).
- Cleveland, D., et al. Chromatographic methods for the quantification of free and chelated gadolinium species in MRI contrast agent formulations. Anal. Bioanal. Chem. 398 (7), 2987-2995 (2010).
- Edogun, O., Nguyen, N. H., Halim, M. Fluorescent single-stranded DNA-based assay for detecting unchelated gadolinium(III) ions in aqueous solution. Anal. Bioanal. Chem. 408 (15), 4121-4131 (2016).
- Barge, A., Cravotto, G., Gianolio, E., Fedeli, F. How to determine free Gd and free ligand in solution of Gd chelates. A technical note. Contrast Med. Mol. Imaging. 1 (5), 184-188 (2006).
- Johansson, M. K. Choosing reporter-quencher pairs for efficient quenching through formation of intramolecular dimers. Methods Mol. Biol. 335, 17-29 (2006).
- Sherry, A. D., Caravan, P., Lenkinski, R. E. A primer on gadolinium chemistry. J. Magn. Reson. Imaging. 30 (6), 1240-1248 (2009).
- Shakhverdov, T. A. A cross-relaxation mechanism of fluorescence quenching in complexes of lanthanide ions with organic ligands. Opt. Spectrosc. 95 (4), 571-580 (2003).
- Brittain, H. G. Submicrogram determination of lanthanides through quenching of calcein blue fluorescence. Anal. Chem. 59 (8), 1122-1125 (1987).

