バルブ付き多層マイクロ流体デバイスのための多段階可変高さのフォトリソグラフィ
Summary
Multilayer microfluidic devices often involve the fabrication of master molds with complex geometries for functionality. This article presents a complete protocol for multi-step photolithography with valves and variable height features tunable to any application. As a demonstration, we fabricate a microfluidic droplet generator capable of producing hydrogel beads.
Abstract
Microfluidic systems have enabled powerful new approaches to high-throughput biochemical and biological analysis. However, there remains a barrier to entry for non-specialists who would benefit greatly from the ability to develop their own microfluidic devices to address research questions. Particularly lacking has been the open dissemination of protocols related to photolithography, a key step in the development of a replica mold for the manufacture of polydimethylsiloxane (PDMS) devices. While the fabrication of single height silicon masters has been explored extensively in literature, fabrication steps for more complicated photolithography features necessary for many interesting device functionalities (such as feature rounding to make valve structures, multi-height single-mold patterning, or high aspect ratio definition) are often not explicitly outlined.
Here, we provide a complete protocol for making multilayer microfluidic devices with valves and complex multi-height geometries, tunable for any application. These fabrication procedures are presented in the context of a microfluidic hydrogel bead synthesizer and demonstrate the production of droplets containing polyethylene glycol (PEG diacrylate) and a photoinitiator that can be polymerized into solid beads. This protocol and accompanying discussion provide a foundation of design principles and fabrication methods that enables development of a wide variety of microfluidic devices. The details included here should allow non-specialists to design and fabricate novel devices, thereby bringing a host of recently developed technologies to their most exciting applications in biological laboratories.
Introduction
過去15年間、フィールドとしてマイクロフルイディクスは、マイクロメートルスケール1での流体の操作を可能にする新技術の爆発で、急速な成長を遂げています。少量が同時に劇的にスループットが向上し、スケール2、3の経済を活用することでコストを低減しつつ、高速化と感度を実現する可能性を有するので、マイクロ流体システムは、湿式実験室機能の魅力的なプラットフォームです。多層マイクロ流体システムは、単一細胞分析4、5、6、単一分子分析( 例えば、デジタルPCR 7)、タンパク質結晶8、転写因子結合アッセイなどのハイスループット生化学分析の用途において特に重要な影響を作っていますF "> 9、10、及び細胞スクリーニング11。
マイクロフルイディクスの中心となる目標は、総生化学分析12のために、単一のデバイス内で複雑な流体操作を行うことが可能なデバイス「ラボオンチップ」の開発です。多層ソフトリソグラフィ技術の開発は、ミキサー、オンチップバルブの作成を可能にすることによって、この目標を実現する助けと積極的に小さな容積内の流体13、14、15を制御するためのポンプいます。その利点と実証されたアプリケーションにもかかわらず、これらのマイクロ流体技術の多くは、非専門家のユーザーによって大部分が未利用のまま。広く採用が原因微細加工施設へのアクセスが制限さに一部挑戦するだけでなく、製造技術の不十分な通信のためにされています。これは、FO特にそうですRバルブや複雑な形状のための構造を備えた多層マイクロ流体デバイス:重要な設計パラメータと製造技術の詳細、実用的な情報の不足は、多くの場合、これらのデバイスの設計と作成に関わるプロジェクトに着手から新たな研究者を抑止します。
この記事では、バルブ、高さ可変機能を備えた多層マイクロ流体デバイスを製造する設計パラメータから開始し、すべての製造工程を経て移動するための完全なプロトコルを提示することによって、この知識のギャップに対処することを目的とします。製造の最初のフォトリソグラフィ工程に着目し、このプロトコルは、金型からデバイスをキャストし、具体的な実験を実行するの下流の手順を説明し、他のマイクロフルイディクス・プロトコル16を補完します。
モノリシックチップ上の弁を持つマイクロ流体デバイスは、2層で構成されています。興味のある流体は、マイクロに操作される「フロー」層を、チャネル、空気または水を含むマイクロチャネルを選択的流動層14内の流体の流れを調節することができる「制御」層、。これら二つの層は、それぞれのその後呼ばれるプロセスにおいてポリジメチルシロキサン(PDMS)、レプリカ成形に使用される別個のシリコンモールドマスタ上に製造されている「ソフトリソグラフィ17。 "多層デバイスを形成するために、PDMSの各層は、それぞれの成形マスター上にキャストした後、互いに整列し、それにより各層のチャネルを有する複合PDMSデバイスを形成しています。バルブは、フローチャネル及び制御チャネルが互いに交差するだけ薄い膜によって分離された位置に形成されています。コントロールチャネルの加圧は、流路を閉塞し、局所的に流体( 図1)を変位させる、この膜を偏向させます。
アクティブオンチップバルブは、所望の最終用途に応じて、複数の方法で製造することができます。バルブ制御層は、流動層( 図1)15の上または下であるかに応じて、いずれかの「プッシュダウン」または「押し上げる」幾何学で構成することができます。フローチャネルは、貼り合わせ基板と直接接触するようにするための「プッシュダウン」ジオメトリは、基板表面の選択的官能基化またはパターニングの利点を付与する、許可しながら形状は、下の閉鎖圧力および剥離に対する高いデバイスの安定性を可能にする「押し上げ」後で機能18、19用。
バルブはまた、流路の断面形状に応じて、「ふるい」バルブ意図的に漏出性または完全に密閉可能ないずれかになります。篩バルブは、ビーズ、細胞または他のmacroanalytes 1を捕捉するために有用であり、典型的なネガ型フォトレジスト( 例えば、SU-8シリーズ)、HAを使用することにより製造されます長方形のプロファイルをVEの。制御チャネルは、これらの弁の領域の上に加圧されると、制御フロー層とPDMS膜は、角部を封止する流体の流れを許容するが、マクロスケールの粒子( 図1)を捕捉することなく、バルブの矩形プロファイルに等方的に偏向します。逆に、完全に密封可能なマイクロ流体バルブは、バルブの位置で丸みを帯びたフォトレジストの小さなパッチを含むことによって製造されます。この幾何学的形状と、制御チャネルの加圧は、流体の流れを停止、完全にチャネルを密封する丸みを帯びた流動層に対して膜を偏向させます。流動層内の丸みを帯びたプロファイルは、典型的なフォトリソグラフィ工程の後にポジ型フォトレジストの溶融およびリフロー( 例えば、AZ50 XTまたはSPR 220)を介して生成されます。我々は以前に、弁領域のリフロー後の高さは、選択されたフィーチャ寸法21に依存することを実証しました。このプロトコルには、双方のバルブ形状の製造を実証しますビーズ合成装置です。
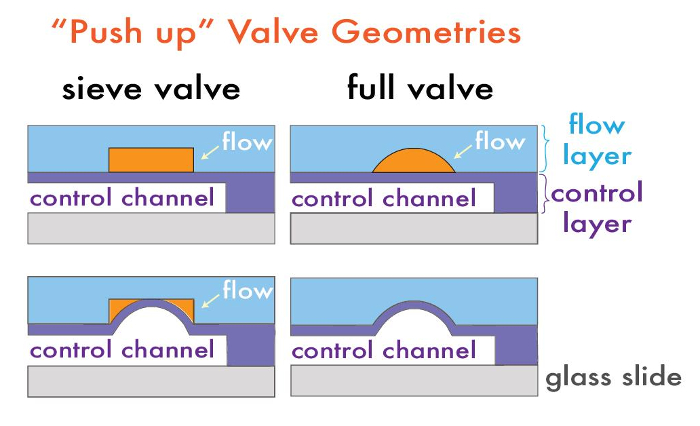
図1:多層マイクロ流体バルブジオメトリ。ふるいのための典型的な「プッシュアップ」デバイスアーキテクチャおよび(上)と後(下)加圧の前に完全に密封可能なバルブ。 この図の拡大版をご覧になるにはこちらをクリックしてください。
デバイスはまた、単一の流れ層内の複数の異なる高さの特徴を必要とするカオスミキサー13及びオンチップ抵抗器20のような複雑な受動的な特徴を含むことができます。可変高フロー層を達成するために、別のグループは、22をエッチングし 、プリント回路基板、多層PDMSレリーフアラインメント23、または多段階Pを含む多くの方法を採用していますhotolithography 24。当社グループは、効果的かつ再現性のある方法であることを、単一の成形マスターに多段階のフォトリソグラフィを発見しました。これを行うために、それぞれの層の適用の間に開発することなく、層に負のフォトレジスト( 例えば、SU-8シリーズのフォトレジスト)の厚さのチャネルを構築する単純なフォトリソグラフィ技術が用いられます。それぞれの層は、シリコンマスター上製造元の指示25を使用して、その厚さに応じてネガ型フォトレジストでスピンされます。この高さの特徴は、特定の透明マスク( 図2)ガラスマスク板に固定され、露光前以前スパン層に位置合わせを使用して層上にパターン化されます。多段階フォトリソグラフィでは、層間の正確な位置合わせは、完全な可変高さの流路を形成するのに重要です。整列後、各層は厚みに依存する露光後ベークに付されます。開発することなく、次の層はシムですilarlyパターン化。このようにして、背の高い機能は、複数のマスクの使用を介して単一の流れウェハ上に層ごとに構築することができます。各ステップの間に開発をスキップすることにより、以前のフォトレジスト層24( すなわち 、2つの 25μmの層が50μmの機能を行うことができる)複合高機能を生成するために使用することができます。さらに、カオスミキサーヘリングボーン溝13とチャネルフロア機能は、以前に露出機能を有する層を用いて作製することができます。最終的な現像工程は、可変の高さ( 図3)の機能を有する単一の流れウェハを作成する処理を終了します。
ここでは、オンチップバルブおよび複数の高さの流路を作製するのに必要なすべての手順の例を含む多段階フォトリソグラフィのための完全なプロトコルが提供されます。この製造プロトコルは、バルブとvariabを必要とする多層マイクロ流体ビーズシンセサイザーの文脈で提示されますル高さは、その機能のために備えています。この装置は、複数の試薬を含む自動化されたワークフローを可能にするためにポアズイユ性、液滴の成分を均質化するためのカオス混合器を制御し、両方が完全に密封し、篩バルブを介して流量を調節するために、油シースに水滴を生成するためのオンチップ抵抗器をTジャンクションを含みます入力。多段階フォトリソグラフィを用いて、これらの機能は、それぞれ高さまたはフォトレジストに応じて別の層の上に製造されます。以下の層は、このプロトコルで構成されている:(1)フローラウンドバルブ層(55μmで、AZ50 XTを)(2)フロー低層(55μmで、SU-8 2050)(3)フローの高層(85μmで、SU- 8 2025年、30μmの添加剤高さ)、および(4)ヘリンボーン溝(125μmで、SU-8 2025、40μmの添加剤高さ)( 図3)。
ヒドロゲルビーズは、下流アッセイのための選択的な表面機能、薬物のカプセル化、ラディなどの様々な用途に使用することができますotracing撮像アッセイ、および細胞取り込み;我々は以前にランタニドナノ蛍光体20を含むスペクトル符号化されたPEGヒドロゲルビーズを製造するために、これらのデバイスのより複雑なバージョンを使用していました。ここで説明する設計が必要であれば、それらの研究努力で使用する任意の研究室のための参考資料に含まれています。私たちは、このプロトコルは、専門家やマイクロフルイディクスのエントリへの障壁を低くし、製造の成功の可能性を高めるために、バルブや複雑な形状で多層マイクロ流体デバイスを製造するのに似て興味非専門家のためのオープンなリソースを提供することを期待しています。
Protocol
Representative Results
Discussion
この作品は、私たちのオンラインツール26と製造元の指示25に基づき、製造パラメータへの簡単な変更を加えて任意のアプリケーションのために調整することができ、バルブと高さが可変ジオメトリーを備えた多層マイクロ流体デバイスのための完全なマルチステップフォトリソグラフィプロトコルを示しています。このプロトコルは、単純なパッシブ1層?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors thank Scott Longwell for helpful comments and edits to the manuscript and Robert Puccinelli for device photography. The authors acknowledge generous support from a Beckman Institute Technology Development Grant. K.B. is supported by a NSF GFRP fellowship and the TLI component of the Stanford Clinical and Translational Science Award to Spectrum (NIH TL1 TR 001084); P.F. acknowledges a McCormick and Gabilan Faculty Fellowship.
Materials
| Materials | |||
| Mylar Transparency Masks, 5" | FineLine Plotting | ||
| 5" Quartz Plates | United Silica | Custom | |
| 4" Silicon Wafers, Test Grade | University Wafer | 452 | |
| SU8 2005, 2025, 2050 photoresist | Microchem | Y111045, Y111069, Y111072 | |
| Az50XT | Integrated Micromaterials | AZ50XT-Q | |
| SU8 Developer | Microchem | Y020100 | |
| AZ400K 1:3 Developer | Integrated Micromaterials | AZ400K1:3-CS | |
| Pyrex 150 mm glass dish | Sigma-Aldrich | CLS3140150-1EA | |
| Wafer Petri Dishes, 150 mm | VWR | 25384-326 | |
| Wafer Tweezers | Electron Microscopy Sciences (EMS) | 78410-2W | |
| Trichloro(1H,1H,2H,2H-perfluorooctyl)silane (PFOTS) | Sigma-Aldrich | 448931-10G | |
| 2" x 3" glass slides | Thomas Scientific | 6686K20 | |
| RTV 615 elastomeric base and curing agent PDMS set | Momentive | RTV615-1P | |
| Tygon Tubing, 0.02" O.D. | Fischer Scientific | 14-171-284 | |
| Capillary PEEK tubing, 510 um OD, 125 um ID | Zeus | Custom | 360 um PEEK is readily available by Idex (catalog number: 1571) |
| Cyro 4 mL tube | Greiner Bio-One | 127279 | |
| Epoxy, 30-minute | Permatex | 84107 | |
| Metal Pins, 0.025" OD, .013" ID | New England Small Tube | NE-1310-02 | |
| Poly(ethylene glycol) diacrylate, Mn 700 | Sigma-Aldrich | 455008-100ML | |
| Lithium Phenyl(2,4,6-trimethylbenzoyl)phosphinate photoinitator | Tokyo Chemical Industry Co. | L0290 | We typically synthesize LAP in-house. |
| HEPES | Sigma-Aldrich | H4034-25G | |
| Light mineral oil | Sigma-Aldrich | 330779-1L | |
| Span-80 | Sigma-Aldrich | 85548 | |
| ABIL EM 90 | UPI Chem | 420095 | |
| Name | Company | Catalog Number | Comments |
| Equipment | Equivalent equiptment or homebuilt setups will work equally as well | ||
| Mask Aligner | Karl Suss | MA6 | |
| Profilometer | KLA-Tencor | Alpha-Step D500 | |
| Spin Coater | Laurell Technologies | WS-650-23 | Any spincoater can be used that accepts 100 mm wafers |
| Vacuum Dessicator, Bell-Jar Style | Bel-Art | 420100000 | |
| Oven | Cole-Palmer | WU-52120-02 | |
| UV Spot Curing System with 3 mm LLG option | Dymax | 41015 | UV LEDs, Xenon Arc Lamps, or other UV sources of the same intensity work equally as well |
| MFCS Microfluidic Fluid Control System | Fluidgent | MFCS-EZ | Syringe pumps, custom pneumatics or other control systems can also be used |
| Automated control scripting | MATLAB | ||
| Hotplate | Tory Pines Scientific | HP30 | Any hotplate with uniform heating (i.e. aluminum or ceramic plates) will suffice. |
References
- Duncombe, T. A., Tentori, A. M., Herr, A. E. Microfluidics: reframing biological enquiry. Nat. Rev. Mol. Cell Bio. 16 (9), (2015).
- Squires, T. M., Quake, S. R. Microfluidics: Fluid physics at the nanoliter scale. Rev.Mod. Phys. 77 (3), (2005).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442 (7101), (2006).
- Kalisky, T., Blainey, P., Quake, S. R. Genomic Analysis at the Single-Cell Level. Ann. Rev. of Genetics. 45 (1), (2011).
- Finkel, N. H., Lou, X., Wang, C., He, L. Peer Reviewed: Barcoding the Microworld. Anal. Chem. 76 (19), (2004).
- Lecault, V., White, A. K., Singhal, A., Hansen, C. L. Microfluidic single cell analysis: from promise to practice. Curr. Opin. in Chem. Bio. 16 (3-4), (2012).
- White, A. K., Heyries, K. A., Doolin, C., VanInsberghe, M., Hansen, C. L. High-Throughput Microfluidic Single-Cell Digital Polymerase Chain Reaction. Anal. Chem. 85 (15), (2013).
- Hansen, C. L., Classen, S., Berger, J. M., Quake, S. R. A Microfluidic Device for Kinetic Optimization of Protein Crystallization and In Situ Structure Determination. J. Am. Chem. Soc. 128 (10), (2006).
- Maerkl, S. J., Quake, S. R. A Systems Approach to Measuring the Binding Energy Landscapes of Transcription Factors. Science. 315 (5809), (2007).
- Fordyce, P. M., Gerber, D., et al. De novo identification and biophysical characterization of transcription-factor binding sites with microfluidic affinity analysis. Nat. Biotech. 28 (9), (2010).
- Fan, R., et al. Integrated barcode chips for rapid, multiplexed analysis of proteins in microliter quantities of blood. Nat. Biotech. 26 (12), (2008).
- Kovarik, M. L., Gach, P. C., Ornoff, D. M., Wang, Y. Micro total analysis systems for cell biology and biochemical assays. Anal. Chem. , (2011).
- Stroock, A. D., Dertinger, S. K. W., Ajdari, A., Mezić, I., Stone, H. A., Whitesides, G. M. Chaotic Mixer for Microchannels. Science. 295 (5555), 647-651 (2002).
- Unger, M. A., Chou, H. -. P., Thorsen, T., Scherer, A., Quake, S. R. Monolithic Microfabricated Valves and Pumps by Multilayer Soft Lithography. Science. 288 (5463), 113-116 (2000).
- Thorsen, T., Maerkl, S. J., Quake, S. R. Microfluidic Large-Scale Integration. Science. 298 (5593), (2002).
- Li, N., Sip, C., Folch, A. Microfluidic Chips Controlled with Elastomeric Microvalve Arrays. JoVE. (8), e296 (2007).
- Kim, P., et al. Soft lithography for microfluidics: a review. Biochip. J. 2 (1), 1-11 (2008).
- Studer, V., Hang, G., Pandolfi, A., Ortiz, M., Anderson, W. F., Quake, S. R. Scaling properties of a low-actuation pressure microfluidic valve. J. Appl. Phys. 95 (1), 393-398 (2004).
- Kartalov, E. P., Scherer, A., Quake, S. R., Taylor, C. R., Anderson, W. F. Experimentally validated quantitative linear model for the device physics of elastomeric microfluidic valves. J. Appl. Phys. 101 (6), 064505 (2007).
- Gerver, R. E., Gómez-Sjöberg, R., et al. Programmable microfluidic synthesis of spectrally encoded microspheres. Lab. Chip. 12 (22), 4716-4723 (2012).
- Fordyce, P. M., Diaz-Botia, C. A., DeRisi, J. L., Gómez-Sjöberg, R. Systematic characterization of feature dimensions and closing pressures for microfluidic valves produced via photoresist reflow. Lab. Chip. 12 (21), 4287-4295 (2012).
- Li, C. -. W., Cheung, C. N., Yang, J., Tzang, C. H., Yang, M. PDMS-based microfluidic device with multi-height structures fabricated by single-step photolithography using printed circuit board as masters. The Analyst. 128 (9), 1137-1142 (2003).
- Romanowsky, M. B., Abate, A. R., Rotem, A., Holtze, C., Weitz, D. A. High throughput production of single core double emulsions in a parallelized microfluidic device. Lab. Chip. 12 (4), 802-807 (2012).
- Mata, A., Fleischman, A. J., Roy, S. Fabrication of multi-layer SU-8 microstructures. JMM. 16 (2), 276 (2006).
- . Rafael’s Microfluidics Site Available from: https://sites.google.com/site/rafaelsmicrofluidicspage/valve-controllers (2016)
- Wanat, S., Plass, R., Sison, E., Zhuang, H., Lu, P. -. H. Optimized Thick Film Processing for Bumping Layers. Proc. SPIE. , 1281-1288 (2003).

