Многоступенчатая переменной высоты фотолитографии для Valved Многослойные микрожидком устройств
Summary
Multilayer microfluidic devices often involve the fabrication of master molds with complex geometries for functionality. This article presents a complete protocol for multi-step photolithography with valves and variable height features tunable to any application. As a demonstration, we fabricate a microfluidic droplet generator capable of producing hydrogel beads.
Abstract
Microfluidic systems have enabled powerful new approaches to high-throughput biochemical and biological analysis. However, there remains a barrier to entry for non-specialists who would benefit greatly from the ability to develop their own microfluidic devices to address research questions. Particularly lacking has been the open dissemination of protocols related to photolithography, a key step in the development of a replica mold for the manufacture of polydimethylsiloxane (PDMS) devices. While the fabrication of single height silicon masters has been explored extensively in literature, fabrication steps for more complicated photolithography features necessary for many interesting device functionalities (such as feature rounding to make valve structures, multi-height single-mold patterning, or high aspect ratio definition) are often not explicitly outlined.
Here, we provide a complete protocol for making multilayer microfluidic devices with valves and complex multi-height geometries, tunable for any application. These fabrication procedures are presented in the context of a microfluidic hydrogel bead synthesizer and demonstrate the production of droplets containing polyethylene glycol (PEG diacrylate) and a photoinitiator that can be polymerized into solid beads. This protocol and accompanying discussion provide a foundation of design principles and fabrication methods that enables development of a wide variety of microfluidic devices. The details included here should allow non-specialists to design and fabricate novel devices, thereby bringing a host of recently developed technologies to their most exciting applications in biological laboratories.
Introduction
В течение последних 15 лет, микрофлюидики как поле претерпела быстрый рост, со взрывом новых технологий , позволяющих манипуляции жидкостей в масштабе 1 микрометра. Микрожидком системы являются привлекательными платформами для мокрой лаборатории функциональных возможностей, поскольку небольшие объемы имеют потенциал , чтобы реализовать повышенную скорость и чувствительность , в то же время значительно увеличивая пропускную способность и сокращение затрат за счет использования эффекта масштаба 2, 3. Многослойные микрофлюидальные системы сделали особенно значительное влияние в высокой пропускной способности приложений биохимического анализа , такие как одного клеточного анализа 4, 5, 6, одного анализа молекулы (например, цифровой ПЦР – 7), кристаллографии белка 8, фактор транскрипции , анализы связыванияе "> 9, 10, и клеточный скрининг 11.
Главной целью микрофлюидики была разработка «лаборатории на чипе" устройств , способных выполнять сложные манипуляции жидкостных в одном устройстве для полного биохимического анализа 12. Разработка многослойных методов мягкой литографии помогла достичь этой цели, обеспечивая возможность создания на чипе клапанов, смесителей и насосов для активного управления жидкостей в небольших объемах 13, 14, 15. Несмотря на свои преимущества и продемонстрировали приложений, многие из этих микрофлюидальных технологий остаются в значительной степени распряг пользователями неспециалистов. Широкое распространение было достаточно сложной задачей отчасти из-за ограниченного доступа к микроструктур объектов, но и из-за недостаточной связи методов изготовления. Это особенно верно, FOг многослойные микрофлюидальные устройства, показывающие структуры для клапанов или сложной геометрией: малочисленность подробную практическую информацию о важных конструктивных параметров и методов изготовления часто отпугивает новых исследователей из приступают к проектам, связанным с дизайном и создание этих устройств.
Эта статья призвана восполнить этот пробел знаний, представив полный протокол для изготовления многослойных микрожидкостных устройств с клапанами и изменяющимися свойствами по высоте, начиная от проектных параметров и перемещение через все шаги изготовления. Сосредоточив внимание на начальных этапах фотолитографии фабрикации, этот протокол дополняет другие протоколы микрофлюидики 16 , которые описывают ниже по течению стадии литья устройств из пресс – форм и выполнения определенных экспериментов.
Микрожидком устройства с монолитными на чипе клапанов состоят из двух слоев: слой "поток", в котором жидкость представляет интерес манипулируют в микро-каналы, и слой "контроль", где микроканалов , содержащих воздух или вода может выборочно модулировать поток жидкости в слое 14 потока. Эти два слоя каждый изготовлены на отдельный мастер кремния для формования, который впоследствии используется для полидиметилсилоксана (ПДМС) реплики литья в процессе , называемом "мягкой литография 17" . Для формирования многослойного устройства, каждый из слоев PDMS отлиты на их соответствующих мастеров формовочных и затем выровнены друг с другом, образуя тем самым составное устройство PDMS с каналами в каждом слое. Клапаны образуются в тех местах, где поток и каналы управления пересекаются друг с другом и отделены друг от друга только тонкой мембраной; герметизация канала управления рикошетом эту мембрану , чтобы закупорить канал потока и локально вытесняет жидкость (рисунок 1).
Активные на кристалле клапаны могут быть изготовлены различными способами, в зависимости от желаемого конечного применения. Клапанымогут быть сконфигурированы либо в "толкать вниз" или "толкать вверх" геометрии, в зависимости от того, выше или ниже слоя потока (рис 1) 15 управления слоем. "Push Up" геометрические формы позволяют более низких давлениях закрытия и более высокой стабильностью устройства от расслаивания, в то время как "толчок вниз" геометрические формы позволяют проточные каналы, чтобы быть в непосредственном контакте с скрепленной подложкой, присуждении преимущество селективного функционализации или структурирование поверхности подложки для последующего функциональных возможностей 18, 19.
Клапаны могут быть либо намеренно негерметичные «сито» клапаны или полностью закрывающийся, в зависимости от профиля поперечного сечения проточного канала. Сетчатые клапаны могут быть использованы для улавливания бусинки, клетки или другие macroanalytes 1, и изготовлены посредством использования типичных негативных фоторезистов (то есть, СУ-8 серии), что гаве прямоугольные профили. Когда канал управления находится под давлением над этими регионами клапана, мембрана PDMS между контролем и слоем потока рикошетом изотропно в прямоугольный профиль клапана без уплотнения углов, что позволяет поток жидкости , но захват макрочастицы масштаба (рисунок 1). С другой стороны, полностью закрывающиеся микрофлюидальные клапаны изготавливаются в том числе небольшой участок округленной фоторезиста на местах клапанов. С помощью этой геометрии, герметизация канала управления рикошетом мембрану на слой округлой потока, чтобы полностью загерметизировать канал, останавливая поток текучей среды. Закругленные профили в слое потока генерируются посредством плавления и оплавления позитивного фоторезиста (например, AZ50 XT или SPR 220) после типичных шагов фотолитографии. Ранее мы показали , что после оплавления высоты областей клапанов зависит от выбранных размеров художественных 21. Этот протокол демонстрирует изготовление обеих геометрий клапанов св устройстве синтеза шарик.
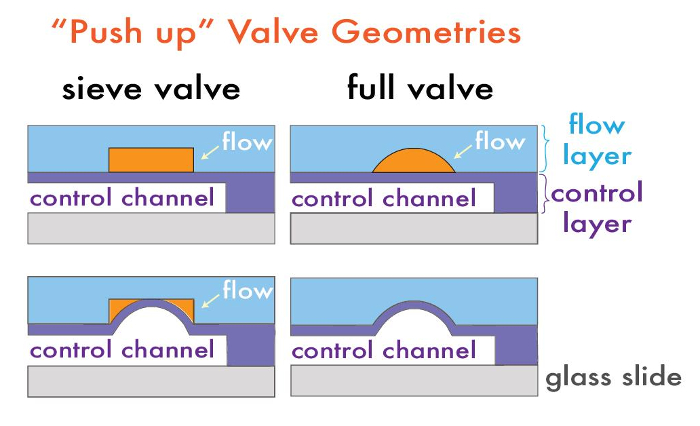
Рисунок 1: Многослойные Микрожидкостных клапан геометрий. Типичные "Push Up" архитектуры устройства для сита и полностью закрывающиеся клапаны до (вверху) и после (внизу) давления. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Устройства также могут включать в себя сложные пассивные функции , такие как хаотические смесителей 13 и на кристалле резисторы 20 , которые требуют особенности нескольких различных высот в пределах одного слоя потока. Для достижения переменной высоты слоя потока, различные группы использовали много методов , в том числе печатной платы травления 22, многослойного PDMS выравнивания рельефа 23 или многоступенчатого рhotolithography 24. Наша группа обнаружила многоступенчатый фотолитографии на одном мастер-формовочного, чтобы быть эффективным и воспроизводимым методом. Чтобы сделать это, простой метод фотолитографии построения толстых каналов негативного фоторезиста (например, фоторезистов серии SU-8) в слоях без развития между нанесением каждого слоя используется. Каждый слой формуют в отрицательном фоторезиста в соответствии с ее толщины , используя инструкции производителя 25 на мастер кремния. Особенности этой высоты, затем с рисунком на слой , используя определенную маску прозрачности (рисунок 2) , прикрепленную к стеклянной маске и выровнена с предварительно формованной слоя перед экспозицией. В многоступенчатом фотолитографии, точное выравнивание между слоями имеет решающее значение при формировании полного проточный канал переменной высоты. После выравнивания, каждый слой подвергается толщины-зависимой постэкспозиционной выпекать. Без развития, следующий слой SIMilarly с рисунком. Таким образом, высокие характеристики могут быть построены на одной пластине потока послойный посредством использования нескольких масок. Пропуская развитие между каждым шагом, предыдущие слои фоторезиста могут быть использованы для создания составных функций высоты (т.е. два 25 мкм слои могут сделать функцию 50 мкм) 24. Кроме того, особенности пола канала , такие как хаотическое смеситель елочка канавок 13 могут быть выполнены с использованием слоев с ранее подвергшимися функциями. Заключительный этап развития завершает процесс, создавая единый поток пластины с признаками переменной высоты (рисунок 3).
Здесь вы сможете найти полный протокол для многоступенчатого фотолитографии, который включает в себя примеры всех процедур, необходимых для изготовления на чипе клапанов и проточных каналов с несколькими высот обеспечивается. Этот протокол изготовление представлен в контексте многослойного микрожидком синтезатора кромочная, который требует клапанов и variabле-высота особенности для его функциональности. Это устройство включает в себя Т-образные перекрестки для генерации капель воды в масляной оболочке, на кристалле резисторы для модуляции скорости потока через управления Пуазейля сопротивление, хаотический смеситель для гомогенизации компонентов капельные, и оба полностью герметизирующие и сетчатым клапаны для того, чтобы автоматизированные рабочие процессы с участием нескольких реагентов входы. Используя многоступенчатый фотолитографии, эти функции друг изготовлены на другом слое в зависимости от высоты или фоторезиста; следующие слои построены в этом протоколе: (1) обтекать слой клапан (55 мкм, AZ50 XT) (2) Расход Низкий слой (55 мкм, СУ-8 2050) (3) потока с высокой слой (85 мкм, ГУ 8 2025, 30 мкм присадка высота), и (4) Шевронные Канавки (125 мкм, СУ-8 2025, 40 мкм присадка высота) (рисунок 3).
Гидрогелевые шарики могут быть использованы для различных применений, включая селективным функционализации поверхности для последующих анализов, инкапсуляция наркотиков, rádiotracing и фотографические анализы, и введение клеток; Ранее мы использовали более сложный вариант этих устройств для получения спектрально кодированные ПЭГ гидрогелевые гранулы , содержащие лантанидов нанолюминофоров 20. Проекты, обсуждаемые здесь включены в дополнительные ресурсы для любой лаборатории, чтобы использовать в своих научно-исследовательских работ, если это необходимо. Мы ожидаем, что этот протокол обеспечит открытый ресурс для специалистов и неспециалистов, так заинтересованных в создании многослойных микрожидкостных устройств с клапанами или сложной геометрией, чтобы снизить барьер для входа в микрофлюидики и повысить шансы на успех изготовления.
Protocol
Representative Results
Discussion
Эта работа демонстрирует полный протокол фотолитографии многоступенчатый для многослойного микрожидком устройства с клапанами и изменяемой геометрией высоты , которые могут быть настроены для любого приложения с помощью простых изменений в параметрах изготовления на основе наших ?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors thank Scott Longwell for helpful comments and edits to the manuscript and Robert Puccinelli for device photography. The authors acknowledge generous support from a Beckman Institute Technology Development Grant. K.B. is supported by a NSF GFRP fellowship and the TLI component of the Stanford Clinical and Translational Science Award to Spectrum (NIH TL1 TR 001084); P.F. acknowledges a McCormick and Gabilan Faculty Fellowship.
Materials
| Materials | |||
| Mylar Transparency Masks, 5" | FineLine Plotting | ||
| 5" Quartz Plates | United Silica | Custom | |
| 4" Silicon Wafers, Test Grade | University Wafer | 452 | |
| SU8 2005, 2025, 2050 photoresist | Microchem | Y111045, Y111069, Y111072 | |
| Az50XT | Integrated Micromaterials | AZ50XT-Q | |
| SU8 Developer | Microchem | Y020100 | |
| AZ400K 1:3 Developer | Integrated Micromaterials | AZ400K1:3-CS | |
| Pyrex 150 mm glass dish | Sigma-Aldrich | CLS3140150-1EA | |
| Wafer Petri Dishes, 150 mm | VWR | 25384-326 | |
| Wafer Tweezers | Electron Microscopy Sciences (EMS) | 78410-2W | |
| Trichloro(1H,1H,2H,2H-perfluorooctyl)silane (PFOTS) | Sigma-Aldrich | 448931-10G | |
| 2" x 3" glass slides | Thomas Scientific | 6686K20 | |
| RTV 615 elastomeric base and curing agent PDMS set | Momentive | RTV615-1P | |
| Tygon Tubing, 0.02" O.D. | Fischer Scientific | 14-171-284 | |
| Capillary PEEK tubing, 510 um OD, 125 um ID | Zeus | Custom | 360 um PEEK is readily available by Idex (catalog number: 1571) |
| Cyro 4 mL tube | Greiner Bio-One | 127279 | |
| Epoxy, 30-minute | Permatex | 84107 | |
| Metal Pins, 0.025" OD, .013" ID | New England Small Tube | NE-1310-02 | |
| Poly(ethylene glycol) diacrylate, Mn 700 | Sigma-Aldrich | 455008-100ML | |
| Lithium Phenyl(2,4,6-trimethylbenzoyl)phosphinate photoinitator | Tokyo Chemical Industry Co. | L0290 | We typically synthesize LAP in-house. |
| HEPES | Sigma-Aldrich | H4034-25G | |
| Light mineral oil | Sigma-Aldrich | 330779-1L | |
| Span-80 | Sigma-Aldrich | 85548 | |
| ABIL EM 90 | UPI Chem | 420095 | |
| Name | Company | Catalog Number | Comments |
| Equipment | Equivalent equiptment or homebuilt setups will work equally as well | ||
| Mask Aligner | Karl Suss | MA6 | |
| Profilometer | KLA-Tencor | Alpha-Step D500 | |
| Spin Coater | Laurell Technologies | WS-650-23 | Any spincoater can be used that accepts 100 mm wafers |
| Vacuum Dessicator, Bell-Jar Style | Bel-Art | 420100000 | |
| Oven | Cole-Palmer | WU-52120-02 | |
| UV Spot Curing System with 3 mm LLG option | Dymax | 41015 | UV LEDs, Xenon Arc Lamps, or other UV sources of the same intensity work equally as well |
| MFCS Microfluidic Fluid Control System | Fluidgent | MFCS-EZ | Syringe pumps, custom pneumatics or other control systems can also be used |
| Automated control scripting | MATLAB | ||
| Hotplate | Tory Pines Scientific | HP30 | Any hotplate with uniform heating (i.e. aluminum or ceramic plates) will suffice. |
References
- Duncombe, T. A., Tentori, A. M., Herr, A. E. Microfluidics: reframing biological enquiry. Nat. Rev. Mol. Cell Bio. 16 (9), (2015).
- Squires, T. M., Quake, S. R. Microfluidics: Fluid physics at the nanoliter scale. Rev.Mod. Phys. 77 (3), (2005).
- Whitesides, G. M. The origins and the future of microfluidics. Nature. 442 (7101), (2006).
- Kalisky, T., Blainey, P., Quake, S. R. Genomic Analysis at the Single-Cell Level. Ann. Rev. of Genetics. 45 (1), (2011).
- Finkel, N. H., Lou, X., Wang, C., He, L. Peer Reviewed: Barcoding the Microworld. Anal. Chem. 76 (19), (2004).
- Lecault, V., White, A. K., Singhal, A., Hansen, C. L. Microfluidic single cell analysis: from promise to practice. Curr. Opin. in Chem. Bio. 16 (3-4), (2012).
- White, A. K., Heyries, K. A., Doolin, C., VanInsberghe, M., Hansen, C. L. High-Throughput Microfluidic Single-Cell Digital Polymerase Chain Reaction. Anal. Chem. 85 (15), (2013).
- Hansen, C. L., Classen, S., Berger, J. M., Quake, S. R. A Microfluidic Device for Kinetic Optimization of Protein Crystallization and In Situ Structure Determination. J. Am. Chem. Soc. 128 (10), (2006).
- Maerkl, S. J., Quake, S. R. A Systems Approach to Measuring the Binding Energy Landscapes of Transcription Factors. Science. 315 (5809), (2007).
- Fordyce, P. M., Gerber, D., et al. De novo identification and biophysical characterization of transcription-factor binding sites with microfluidic affinity analysis. Nat. Biotech. 28 (9), (2010).
- Fan, R., et al. Integrated barcode chips for rapid, multiplexed analysis of proteins in microliter quantities of blood. Nat. Biotech. 26 (12), (2008).
- Kovarik, M. L., Gach, P. C., Ornoff, D. M., Wang, Y. Micro total analysis systems for cell biology and biochemical assays. Anal. Chem. , (2011).
- Stroock, A. D., Dertinger, S. K. W., Ajdari, A., Mezić, I., Stone, H. A., Whitesides, G. M. Chaotic Mixer for Microchannels. Science. 295 (5555), 647-651 (2002).
- Unger, M. A., Chou, H. -. P., Thorsen, T., Scherer, A., Quake, S. R. Monolithic Microfabricated Valves and Pumps by Multilayer Soft Lithography. Science. 288 (5463), 113-116 (2000).
- Thorsen, T., Maerkl, S. J., Quake, S. R. Microfluidic Large-Scale Integration. Science. 298 (5593), (2002).
- Li, N., Sip, C., Folch, A. Microfluidic Chips Controlled with Elastomeric Microvalve Arrays. JoVE. (8), e296 (2007).
- Kim, P., et al. Soft lithography for microfluidics: a review. Biochip. J. 2 (1), 1-11 (2008).
- Studer, V., Hang, G., Pandolfi, A., Ortiz, M., Anderson, W. F., Quake, S. R. Scaling properties of a low-actuation pressure microfluidic valve. J. Appl. Phys. 95 (1), 393-398 (2004).
- Kartalov, E. P., Scherer, A., Quake, S. R., Taylor, C. R., Anderson, W. F. Experimentally validated quantitative linear model for the device physics of elastomeric microfluidic valves. J. Appl. Phys. 101 (6), 064505 (2007).
- Gerver, R. E., Gómez-Sjöberg, R., et al. Programmable microfluidic synthesis of spectrally encoded microspheres. Lab. Chip. 12 (22), 4716-4723 (2012).
- Fordyce, P. M., Diaz-Botia, C. A., DeRisi, J. L., Gómez-Sjöberg, R. Systematic characterization of feature dimensions and closing pressures for microfluidic valves produced via photoresist reflow. Lab. Chip. 12 (21), 4287-4295 (2012).
- Li, C. -. W., Cheung, C. N., Yang, J., Tzang, C. H., Yang, M. PDMS-based microfluidic device with multi-height structures fabricated by single-step photolithography using printed circuit board as masters. The Analyst. 128 (9), 1137-1142 (2003).
- Romanowsky, M. B., Abate, A. R., Rotem, A., Holtze, C., Weitz, D. A. High throughput production of single core double emulsions in a parallelized microfluidic device. Lab. Chip. 12 (4), 802-807 (2012).
- Mata, A., Fleischman, A. J., Roy, S. Fabrication of multi-layer SU-8 microstructures. JMM. 16 (2), 276 (2006).
- . Rafael’s Microfluidics Site Available from: https://sites.google.com/site/rafaelsmicrofluidicspage/valve-controllers (2016)
- Wanat, S., Plass, R., Sison, E., Zhuang, H., Lu, P. -. H. Optimized Thick Film Processing for Bumping Layers. Proc. SPIE. , 1281-1288 (2003).

