En standardiseret metode til måling af det indre lungeoverfladeområde via muspneumonektomi og proteseimplantation
Summary
Det indre lungeoverfladeareal (ISA) er et kritisk kriterium til vurdering af lungemorfologi og fysiologi i lungesygdomme og skadefremkaldt alveolær regenerering. Her beskrives en standardiseret metode, der kan minimere måleforspændingen for ISA i både lungepneumonektomi og protesimplantationsmusemodeller.
Abstract
Pulmonary morphology, physiology, and respiratory functions change in both physiological and pathological conditions. Internal lung surface area (ISA), representing the gas-exchange capacity of the lung, is a critical criterion to assess respiratory function. However, observer bias can significantly influence measured values for lung morphological parameters. The protocol that we describe here minimizes variations during measurements of two morphological parameters used for ISA calculation: internal lung volume (ILV) and mean linear intercept (MLI). Using ISA as a morphometric and functional parameter to determine the outcome of alveolar regeneration in both pneumonectomy (PNX) and prosthesis implantation mouse models, we found that the increased ISA following PNX treatment was significantly blocked by implantation of a prosthesis into the thoracic cavity1. The ability to accurately quantify ISA is not only expected to improve the reliability and reproducibility of lung function studies in injured-induced alveolar regeneration models, but also to promote mechanistic discoveries of multiple pulmonary diseases.
Introduction
Lungens grundlæggende funktion er udvekslingen af ilt og kuldioxid mellem blodkar og atmosfære. Lungesygdomme såsom bronkopulmonær dysplasi (BPD), kronisk obstruktiv lungesygdom (COPD) og akut respiratoriske infektioner resulterer i nedsat ISA 2 . Forskere, der studerer lungesygdomme, har udviklet flere kvantitative metoder til evaluering af morfologiske ændringer i lungerne, herunder MLI, ILV, antal gasudvekslingsenheder, ISA og lungevævsoverensstemmelse 2 , 3 . Banebrydende undersøgelser af Weibel et al. 4 og Duguid et al. 5 fastslog sammen, at ISA kan anvendes som en direkte måling af lungegasudvekslingskapacitet i menneskelige lunger og kan anvendes som et kriterium for at bestemme sværhedsgraden af emfysem. En række undersøgelser udgivet i de sidste fem år har brugt lungemorfologiske parametre ( f.eks. </eM> ISA og MLI) for at vurdere morfologiske og funktionelle ændringer i muskelungen under udvikling 6 og under genopretning fra skade PNX 1 , 7 . ISA beregnes ved anvendelse af ligning 1 8 , 9 :
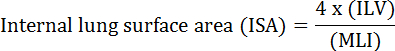
, Hvor ILV er det interne lungemængde, og MLI er en mellemliggende parameter, der repræsenterer den lunge perifere luftrumsstørrelse 10 .
PNX, den kirurgiske fjernelse af en eller flere lungelaber, er blevet rapporteret meget for at inducere alveolær regenerering hos mange arter, herunder mennesker 11 , mus 1 , hunde 12 , rotter 13 og kaniner 14 , 15 . En studY af mus lunger på fjorten dage efter PNX viste, at både ekspansion af eksisterende alveoler og de novo dannelsen af alveoler bidrager til genoprettelsen af ISA, ILV og antallet af alveoler i de resterende lungevæv 1 . Vi og andre har vist, at indsættelse af materialer som svamp, voks eller en brugerdefineret protese i det tomme thoracic cavity efter PNX ( dvs. proteseimplantation) svækker alveolær regenerering. Det er nu klart fastslået, at mekanisk kraft fungerer som en af de vigtigste faktorer for initiering af alveolær regenerering 1 , 16 , 17 . Sådanne undersøgelser har fremhævet effektiviteten af at anvende ISA-værdier fra PNX-behandlede og protese-implanterede lunger som et kriterium for kvantitativt at evaluere alveolær regenerering.
Observer-bias er kendt for at påvirke målt va væsentligtLues for lungemorfologiske parametre ( fx MIL og ILV). Standardiserede protokoller kan bruges til at undgå denne bias ved bestemmelse af både ILV og MLI, som er de to parametre, der anvendes til beregning af ISA. Her giver vi meget detaljerede, standardiserede protokoller til måling af disse lungeparametre. Det er vigtigt, at evnen til nøjagtigt at kvantificere ISA løfter at forbedre pålideligheden og reproducerbarheden af undersøgelser af lungefunktion i skadefremkaldte alveolære regenereringsmodeller og bør lette mekaniske opdagelser i flere lungesygdomme.
Protocol
Representative Results
Discussion
I denne protokol giver vi detaljerede beskrivelser af måling af pulmonale parametre efter musen venstre lunge PNX og protese implantation. ISA anses nu for at være en vigtig metrisk til vurdering af åndedrætsfunktionen i mange lungesygdomme og ved skadefremkaldt alveolær regenerering. Selv om det lungeforskningsmiljø er enig om brugen af ISA som en nyttig metrisk, har der indtil videre været ringe overvejelse om standardiseringen af måling af ILV og MLI, de to parametre, der bruges til at beregne ISA…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Forfatterne vil gerne anerkende National Institute of Biological Sciences, Beijing for at få hjælp. Dette arbejde blev støttet af Beijing Municipal Natural Science Foundation (nr. Z17110200040000).
Materials
| Low cost cautery kit | Fine Science Tools | 18010-00 | |
| Noyes scissors | Fine Science Tools | 15012-12 | |
| Standard pattern forceps | Fine Science Tools | 11000-12 | |
| Castroviejo Micro Needle Holders | Fine Science Tools | 12060-01 | |
| Vessel clips | Fine Science Tools | 18374-44 | |
| I. V. Cannula-20 gauge | Jinhuan Medical Product Co., LTD. | 29P0601 | |
| Surgical suture | Jinhuan Medical Product Co., LTD. | F602 | |
| Mouse intubation platform | Penn-Century, Inc | Model MIP | |
| Small Animal Laryngoscope | Penn-Century, Inc | Model LS-2-M | |
| TOPO Small Animal Ventilator | Kent Scientific | RSP1006-05L | |
| Thermal pad | Stuart equipment | SBH130D | |
| Pentobarbital sodium salt | Sigma | P3761 | |
| Heparin sodium salt | Sigma | H3393 | |
| Hematoxylin Solution | Sigma | GHS132 | |
| Eosin Y solution, alcoholic | Sigma | HT110116 | |
| 10 ml Pipette | Thermo Scientific | 170356 | |
| Paraformaldehyde | Sigma | P6148 | |
| O.C.T Compound | Tissue-Tek | 4583 | |
| cryosection machine | Leica | CM1950 | |
| Disposable Base Molds | Fisher HealthCare | 22-363-553 | |
| 18 gauge needle | Becton Dickinson | 305199 | |
| Povidone iodine | Fisher Scientific | 19-027132 | |
| 70% ethanol | Fisher Scientific | BP82011 | |
| Infusion sets for single use | Weigao | SFDA 2012 3661704 | |
| Phosphate buffered saline | Gibco | 10010023 | |
| Tapes | 3M Scotch | 8915 | |
| Cotton pad | Vinda | Dr.P | |
| Silicone prosthesis | Custom made | ||
| Brightfield microscope | Olympus | VS120 | |
| Ruler tool | Adobe Photoshop |
References
- Liu, Z., et al. MAPK-Mediated YAP Activation Controls Mechanical-Tension-Induced Pulmonary Alveolar Regeneration. Cell Rep. 16 (7), 1810-1819 (2016).
- Thurlbeck, W. M. Internal surface area and other measurements in emphysema. Thorax. 22 (6), 483-496 (1967).
- Knudsen, L., Weibel, E. R., Gundersen, H. J. G., Weinstein, F. V., Ochs, M. Assessment of air space size characteristics by intercept (chord) measurement: an accurate and efficient stereological approach. J Appl Physiol. 108 (2), 412-421 (2010).
- Weibel, E. R. . Morphometry of the Human Lung. , (1963).
- Duguid, J. B., Young, A., Cauna, D., Lambert, M. W. The internal surface area of the lung in emphysema. J Pathol Bacteriol. 88, 405-421 (1964).
- Branchfield, K., et al. Pulmonary neuroendocrine cells function as airway sensors to control lung immune response. Science. 351 (6274), 707-710 (2016).
- Ding, B. -. S., et al. Endothelial-derived angiocrine signals induce and sustain regenerative lung alveolarization. Cell. 147 (3), 539-553 (2011).
- Dunnill, M. S. Quantitative methods in the study of pulmonary pathology. Thorax. 17 (4), 320-328 (1962).
- Weibel, E. R., Gomez, M. Architecture of the human lung. Use of quantitative methods establishes fundamental relations between size and number of lung structures. Science. 137 (3530), 577-585 (1962).
- Thurlbeck, W. M. The internal surface area of nonemphysematous lungs. Am Rev Respir Dis. 95 (5), 765-773 (1967).
- Butler, J. P., et al. Evidence for adult lung growth in humans. N Engl J Med. 367 (16), 244-247 (2012).
- Hsia, C. C. W., Herazo, L. F., Fryder-Doffey, F., Weibel, E. R. Compensatory lung growth occurs in adult dogs after right pneumonectomy. J Clin Invest. 94 (1), 405-412 (1994).
- Thurlbeck, S. W. M. Pneumonectomy in Rats at Various Ages. Am Rev Respir Dis. 120 (5), 1125-1136 (1979).
- Cagle, P. T., Langston, C., Thurlbeck, W. M. The Effect of Age on Postpneumonectomy Growth in Rabbits. Pediatr Pulmonol. 5 (2), 92-95 (1988).
- Langston, C., et al. Alveolar multiplication in the contralateral lung after unilateral pneumonectomy in the rabbit. Am Rev Respir Dis. 115 (1), 7-13 (1977).
- Cohn, R. Factors Affecting The Postnatal Growth of The Lung. Anatomical Record. 75 (2), 195-205 (1939).
- Hsia, C. C., Wu, E. Y., Wagner, E., Weibel, E. R. Preventing mediastinal shift after pneumonectomy impairs regenerative alveolar tissue growth. Am J Physiol Lung Cell Mol Physiol. 281 (5), L1279-L1287 (2001).
- Das, S., MacDonald, K., Chang, H. -. Y. S., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. (73), e50318 (2013).
- Liu, S., Cimprich, J., Varisco, B. M. Mouse pneumonectomy model of compensatory lung growth. J Vis Exp. (94), (2014).
- Silva, M. F. R., Zin, W. A., Saldiva, P. H. N. Airspace configuration at different transpulmonary pressures in normal and paraquat-induced lung injury in rats. Am J Respir Crit Care Med. 158 (4), 1230-1234 (1998).
- Yilmaz, C., et al. Noninvasive quantification of heterogeneous lung growth following extensive lung resection by high-resolution computed tomography. J Appl Physiol. 107 (5), 1569-1578 (2009).
- Voswinckel, R., et al. Characterisation of post-pneumonectomy lung growth in adult mice. Eur Respir J. 24 (4), 524-532 (2004).
- Ravikumar, P., et al. Regional Lung Growth and Repair Regional lung growth following pneumonectomy assessed by computed tomography. J Appl Physiol. 97, 1567-1574 (2004).
- Gibney, B. C., et al. Detection of murine post-pneumonectomy lung regeneration by 18FDG PET imaging. EJNMMI Res. 2 (1), (2012).
- Muñoz-Barrutia, A., Ceresa, M., Artaechevarria, X., Montuenga, L. M., Ortiz-De-Solorzano, C. Quantification of lung damage in an elastase-induced mouse model of emphysema. Int J Biomed Imaging. 2012, (2012).

