Fare Pnömonektomi ve Protez İmplantasyonu ile İç Akciğer Yüzey Alanının Ölçümü için Standart Bir Yöntem
Summary
Akciğer hastalıklarında ve yaralanmaya bağlı alveol rejenerasyonunda akciğer morfolojisi ve fizyolojisini değerlendirmek için iç akciğer yüzey alanı (ISA) kritik bir kriterdir. Burada hem akciğer pnömonektomisinde hem de protez implantasyon fare modellerinde ISA için önyargı önlemeyi en aza indirecek standart bir yöntem açıklanmaktadır.
Abstract
Pulmonary morphology, physiology, and respiratory functions change in both physiological and pathological conditions. Internal lung surface area (ISA), representing the gas-exchange capacity of the lung, is a critical criterion to assess respiratory function. However, observer bias can significantly influence measured values for lung morphological parameters. The protocol that we describe here minimizes variations during measurements of two morphological parameters used for ISA calculation: internal lung volume (ILV) and mean linear intercept (MLI). Using ISA as a morphometric and functional parameter to determine the outcome of alveolar regeneration in both pneumonectomy (PNX) and prosthesis implantation mouse models, we found that the increased ISA following PNX treatment was significantly blocked by implantation of a prosthesis into the thoracic cavity1. The ability to accurately quantify ISA is not only expected to improve the reliability and reproducibility of lung function studies in injured-induced alveolar regeneration models, but also to promote mechanistic discoveries of multiple pulmonary diseases.
Introduction
Akciğerin temel işlevi, kan damarları ile atmosfer arasındaki oksijen ve karbon dioksit değişimidir. Bronkopulmoner displazi (BPD), kronik obstrüktif akciğer hastalığı (COPD) ve akut solunum yolu enfeksiyonları gibi akciğer hastalıkları, ISA 2 azalmasına neden olur. Akciğer hastalığını araştıran araştırmacılar, MLI, ILV, gaz değişim birimi sayısı, ISA ve akciğer dokusu uyumluluğu 2 , 3 dahil olmak üzere akciğerlerdeki morfolojik değişiklikleri değerlendirmek için çeşitli niceliksel yöntemler geliştirmiştir. Weibel ve ark.nın öncü çalışmaları 4 ve Duguid ve ark. 5 , ISA'nın insan akciğerlerindeki akciğer gaz değişim kapasitesinin doğrudan bir ölçümü olarak kullanılabileceğini ve amfizemin ciddiyetini belirlemek için bir kriter olarak kullanılabileceğini birlikte ortaya koymuştur. Son beş yılda yayınlanan bir dizi çalışma, akciğer morfolojik parametrelerini ( örn. </eM> ISA ve MLI) 6 gelişme sırasında ve yaralanma PNX 1 , 7 kurtarma sırasında farelerin akciğerlerinde morfolojik ve fonksiyonel değişiklikleri değerlendirmek için. ISA, Denklem 8 , 9 kullanılarak hesaplanır:
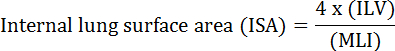
, Burada ILV, iç akciğer hacmi ve MLI, pulmoner periferik hava sahası büyüklüğünü 10 gösteren aracı bir parametredir.
PNX, bir veya daha fazla akciğer lobunun cerrahi olarak çıkarılması, insanlar 11 , fareler 1 , köpekler 12 , sıçanlar 13 ve tavşanlar 14 , 15 dahil olmak üzere birçok türe ait alveol rejenerasyonunu uyardığı yaygın olarak bildirilmiştir. SaplamaOn dört gün sonra fareler, akciğer y sonrası PNX önceden var olan alveoller genişlemesi ve alveollere de novo oluşumu hem ISA, ilv restorasyonu ve kalan akciğer dokularında 1 alveol sayısını katkı göstermiştir. Biz ve diğerleri, PNX'yi takiben boş göğüs boşluğuna sünger, balmumu veya özel şekil verilmiş bir protez gibi materyallerin sokulduğunu ( örn. , Protez implantasyonu) alveol rejenerasyonunu engellediğini gösterdik. Artık mekanik kuvvetin alveol rejenerasyonunu başlatmak için en önemli faktörlerden biri olarak işlev gördüğü tam olarak bilinmektedir 1 , 16 , 17 . Bu tür çalışmalar, alveol rejenerasyonunu kantitatif olarak değerlendirmek için bir kriter olarak PNX ile tedavi edilen ve Protez implante edilen akciğerlerden alınan ISA değerlerinin etkinliğini vurgulamıştır.
Gözlemci önyargılarının ölçülen vayı önemli derecede etkilediği bilinmektedirAkciğer morfolojik parametreleri ( örn. , MIL ve ILV). ISA hesaplamasında kullanılan iki parametre olan hem ILV hem de MLI'yi belirlemede bu önyargıdan kurtulmak için standart protokoller kullanılabilir. Burada, bu akciğer parametrelerini ölçmek için oldukça ayrıntılı ve standartlaştırılmış protokoller sunuyoruz. Daha da önemlisi, ISA'yı doğru bir şekilde ölçebilme özelliği, yaralanmaya bağlı alveolar rejenerasyon modellerinde akciğer fonksiyonlarının güvenilirliğini ve tekrarlanabilirliğini artırmayı ve çoklu pulmoner hastalıklarda mekanik keşifleri kolaylaştırmayı taahhüt eder.
Protocol
Representative Results
Discussion
Bu protokolde, fare sol akciğer PNX ve protez yerleştirildikten sonra pulmoner parametrelerin ölçümü hakkında ayrıntılı açıklamalar sağlarız. ISA, şimdi birçok pulmoner hastalıkta solunum fonksiyonlarının değerlendirilmesi ve yaralanmanın yol açtığı alveol rejenerasyonunda önemli bir metrik olarak düşünülmektedir. Bununla birlikte, pulmoner araştırma topluluğu ISA'nın yararlı bir metriği olarak yararlı olduğu konusunda anlaşmaya rağmen, günümüze kadar ISA hesaplamak için k…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Yazarlar, yardım için Pekin Ulusal Biyolojik Bilimler Enstitüsü'nü kabul etmek istiyorlar. Bu çalışma Pekin Belediye Tabiat Bilimleri Vakfı (No. Z17110200040000) tarafından desteklenmiştir.
Materials
| Low cost cautery kit | Fine Science Tools | 18010-00 | |
| Noyes scissors | Fine Science Tools | 15012-12 | |
| Standard pattern forceps | Fine Science Tools | 11000-12 | |
| Castroviejo Micro Needle Holders | Fine Science Tools | 12060-01 | |
| Vessel clips | Fine Science Tools | 18374-44 | |
| I. V. Cannula-20 gauge | Jinhuan Medical Product Co., LTD. | 29P0601 | |
| Surgical suture | Jinhuan Medical Product Co., LTD. | F602 | |
| Mouse intubation platform | Penn-Century, Inc | Model MIP | |
| Small Animal Laryngoscope | Penn-Century, Inc | Model LS-2-M | |
| TOPO Small Animal Ventilator | Kent Scientific | RSP1006-05L | |
| Thermal pad | Stuart equipment | SBH130D | |
| Pentobarbital sodium salt | Sigma | P3761 | |
| Heparin sodium salt | Sigma | H3393 | |
| Hematoxylin Solution | Sigma | GHS132 | |
| Eosin Y solution, alcoholic | Sigma | HT110116 | |
| 10 ml Pipette | Thermo Scientific | 170356 | |
| Paraformaldehyde | Sigma | P6148 | |
| O.C.T Compound | Tissue-Tek | 4583 | |
| cryosection machine | Leica | CM1950 | |
| Disposable Base Molds | Fisher HealthCare | 22-363-553 | |
| 18 gauge needle | Becton Dickinson | 305199 | |
| Povidone iodine | Fisher Scientific | 19-027132 | |
| 70% ethanol | Fisher Scientific | BP82011 | |
| Infusion sets for single use | Weigao | SFDA 2012 3661704 | |
| Phosphate buffered saline | Gibco | 10010023 | |
| Tapes | 3M Scotch | 8915 | |
| Cotton pad | Vinda | Dr.P | |
| Silicone prosthesis | Custom made | ||
| Brightfield microscope | Olympus | VS120 | |
| Ruler tool | Adobe Photoshop |
References
- Liu, Z., et al. MAPK-Mediated YAP Activation Controls Mechanical-Tension-Induced Pulmonary Alveolar Regeneration. Cell Rep. 16 (7), 1810-1819 (2016).
- Thurlbeck, W. M. Internal surface area and other measurements in emphysema. Thorax. 22 (6), 483-496 (1967).
- Knudsen, L., Weibel, E. R., Gundersen, H. J. G., Weinstein, F. V., Ochs, M. Assessment of air space size characteristics by intercept (chord) measurement: an accurate and efficient stereological approach. J Appl Physiol. 108 (2), 412-421 (2010).
- Weibel, E. R. . Morphometry of the Human Lung. , (1963).
- Duguid, J. B., Young, A., Cauna, D., Lambert, M. W. The internal surface area of the lung in emphysema. J Pathol Bacteriol. 88, 405-421 (1964).
- Branchfield, K., et al. Pulmonary neuroendocrine cells function as airway sensors to control lung immune response. Science. 351 (6274), 707-710 (2016).
- Ding, B. -. S., et al. Endothelial-derived angiocrine signals induce and sustain regenerative lung alveolarization. Cell. 147 (3), 539-553 (2011).
- Dunnill, M. S. Quantitative methods in the study of pulmonary pathology. Thorax. 17 (4), 320-328 (1962).
- Weibel, E. R., Gomez, M. Architecture of the human lung. Use of quantitative methods establishes fundamental relations between size and number of lung structures. Science. 137 (3530), 577-585 (1962).
- Thurlbeck, W. M. The internal surface area of nonemphysematous lungs. Am Rev Respir Dis. 95 (5), 765-773 (1967).
- Butler, J. P., et al. Evidence for adult lung growth in humans. N Engl J Med. 367 (16), 244-247 (2012).
- Hsia, C. C. W., Herazo, L. F., Fryder-Doffey, F., Weibel, E. R. Compensatory lung growth occurs in adult dogs after right pneumonectomy. J Clin Invest. 94 (1), 405-412 (1994).
- Thurlbeck, S. W. M. Pneumonectomy in Rats at Various Ages. Am Rev Respir Dis. 120 (5), 1125-1136 (1979).
- Cagle, P. T., Langston, C., Thurlbeck, W. M. The Effect of Age on Postpneumonectomy Growth in Rabbits. Pediatr Pulmonol. 5 (2), 92-95 (1988).
- Langston, C., et al. Alveolar multiplication in the contralateral lung after unilateral pneumonectomy in the rabbit. Am Rev Respir Dis. 115 (1), 7-13 (1977).
- Cohn, R. Factors Affecting The Postnatal Growth of The Lung. Anatomical Record. 75 (2), 195-205 (1939).
- Hsia, C. C., Wu, E. Y., Wagner, E., Weibel, E. R. Preventing mediastinal shift after pneumonectomy impairs regenerative alveolar tissue growth. Am J Physiol Lung Cell Mol Physiol. 281 (5), L1279-L1287 (2001).
- Das, S., MacDonald, K., Chang, H. -. Y. S., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. (73), e50318 (2013).
- Liu, S., Cimprich, J., Varisco, B. M. Mouse pneumonectomy model of compensatory lung growth. J Vis Exp. (94), (2014).
- Silva, M. F. R., Zin, W. A., Saldiva, P. H. N. Airspace configuration at different transpulmonary pressures in normal and paraquat-induced lung injury in rats. Am J Respir Crit Care Med. 158 (4), 1230-1234 (1998).
- Yilmaz, C., et al. Noninvasive quantification of heterogeneous lung growth following extensive lung resection by high-resolution computed tomography. J Appl Physiol. 107 (5), 1569-1578 (2009).
- Voswinckel, R., et al. Characterisation of post-pneumonectomy lung growth in adult mice. Eur Respir J. 24 (4), 524-532 (2004).
- Ravikumar, P., et al. Regional Lung Growth and Repair Regional lung growth following pneumonectomy assessed by computed tomography. J Appl Physiol. 97, 1567-1574 (2004).
- Gibney, B. C., et al. Detection of murine post-pneumonectomy lung regeneration by 18FDG PET imaging. EJNMMI Res. 2 (1), (2012).
- Muñoz-Barrutia, A., Ceresa, M., Artaechevarria, X., Montuenga, L. M., Ortiz-De-Solorzano, C. Quantification of lung damage in an elastase-induced mouse model of emphysema. Int J Biomed Imaging. 2012, (2012).

