Estabelecimento de um mímico valioso de doença de Alzheimer em modelo Animal de rato por injeção Intracerebroventricular de proteína Beta amiloide compostos
Summary
Este é um protocolo para imitar a doença de Alzheimer em ratos por uma avaliação de imparidade de memória espacial, alterações patológicas neuronais, fardo de proteína (Aβ) beta amyloid neuronal, e agregação neurofibrilares, induzida pela injeção de Aβ25-35 combinado com tricloreto de alumínio e recombinante humano transformando β1-fator de crescimento.
Abstract
A doença de Alzheimer (AD) é uma doença cerebral progressiva, irreversível que lentamente destrói a memória e é acompanhada pela mudança de perda e estrutura do neurônio. Com o aumento de pacientes em todo o mundo, a patologia e o tratamento da doença tornou-se um foco na indústria farmacêutica internacional. Assim, o estabelecimento do modelo animal para imitar AD no laboratório é de grande importância.
Aqui, descrevemos um protocolo detalhado para o estabelecimento de uma mímica do anúncio em um animal de rato modelo embora injeção intracerebroventricular de amiloide beta proteína 25-35 (Aβ25-35) combinado com tricloreto de alumínio (AlCl3) e núcleo talâmica anterodorsal injeção de recombinante humano transformando o fator de crescimento-β1 (RHTGF-β1) para ratos. Os marcadores relacionados de AD foram medidos, incluindo: memória espacial, estrutura neuronal e subestrutura, neuronal Aβ e produção neurofibrilares (NFT). Este modelo de rato demonstra comprometimento de memória espacial, estrutura neuronal e alterações patológicas de subestrutura, fardo Aβ intracelular neurônio e agregação NFT e fornece um mímico perto do transtorno de estrutura e função neuronal ao de clínica Pacientes de AD. Assim, o apresentado AD rato modelprovides uma ferramenta valiosa na vivo para explorar a função neuronal, patologia neuronal e triagem de drogas de AD.
Introduction
É sabido que o anúncio é uma doença neurodegenerativa crónica e progressiva, com perda gradual de memória como a principal síndrome clínica. Na patologia geral, há atrofia do tecido nervoso, neurônio e perda de sinapse, bem como neuronal subcellular distúrbios estrutura e função, que todos estão envolvidos no desenvolvimento e manifestação clínica da AD1,2. É relatado que, quando os animais eram intracerebroventricularly injetado com Aβ, alguns neurotóxicos eventos ocorrem no cérebro envolvendo perda de neurônio, rompimento de homeostase de cálcio, neurônio apoptose e de excesso de produção de espécies reativas de oxigênio3. No entanto, múltiplos fatores estão envolvidos na patogênese da AD e, portanto, é essencial estabelecer um modelo melhor de AD.
Um protocolo detalhado é descrito aqui para estabelecer na vivo imitar AD modelo através de injeção intracerebroventricular de Aβ25-35 e AlCl3, combinado com a injeção de núcleo talâmica anterodorsal de RHTGF-β1 para ratos. Este rato modelhighly imita a função neuronal humana e histopathogenesis do anúncio, incluindo deficiência de memória, perda de neurônio e dano de estrutura, apoptose, fardo Aβ intracelular e NFT agregação4,5,6 , 7 , 8 , 9. o AlCl3 impede que o Aβ depositada formando Aβ solúvel, e o RHTGF-β1 pode promover a produção de Aβ depositada e facilitar a ocorrência de AD10. Este ataque de vários fatores para o neurônio está em conformidade com a patogênese multi da AD.
Todo o experimento durou 86 dias: a Figura 1 mostra um cronograma do projeto experimental, com ponto de tempo de cirurgia animal, triagem de modelo animal, teste de memória espacial animal e preparação da amostra. No primeiro dia de operação, RHTGF-β1 foi injetadas para o núcleo talâmica anterodorsal. No segundo dia da operação, Aβ25-35 e AlCl3 foram injetadas em ventrículo lateral diariamente por 14 dias consecutivos de manhã e 5 dias consecutivos, no período do tarde, respectivamente. Todos os ratos foram autorizados a recuperar durante 45 dias após a operação. O labirinto de água Morris foi usado para a tela para ratos de modelo de sucesso, com comprometimento de memória e para avaliar a memória espacial dos ratos. Os ratos foram submetidos a 4 dias consecutivos de labirinto de água treinando com 2 ensaios por dia, e no dia 4 do treinamento, os ratos foram avaliados com o desempenho de labirinto de Morris água para perda de memória. Todos os ratos continuaram a ser alimentados com 37 dias após a exibição do modelo animal. A memória espacial de ratos foi testada no labirinto de água Morris por 7 dias consecutivos, de 79 de dia para dia 85 após a operação. Todos os ratos foram sacrificados por decapitação no dia 86 para preparação de amostras de cérebro.
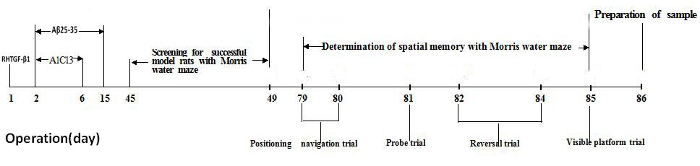
Figura 1. Cronograma do projeto experimental. Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
É sabido que a perda de memória e aprendizagem são principais sintomas clínicos em pacientes2. O procedimento descrito aqui é um método na vivo para estudar AD; Nós adaptamos um protocolo previamente publicado que testou um medicamento para aliviar os déficits de memória e lesões neuronais em um rato modelo4. Nosso protocolo fornece detalhes importantes para obter dados valiosos, bem como uma alta de sobrevida dos animais que o modelo com sucesso a operação, déficits de memória, lesões de neurônio, fardo Aβ e deposição de NFT, para imitar o AD (no presente experimento, a taxa de sobrevivência e taxa de sucesso do modelo de operação são mais de 90%). Estes ratos de modelo de sucesso foram usados para medir a sua memória espacial com o teste de labirinto de água de Morris. O julgamento de navegação posicionamento encontrado que os compostos Aβ pode causar perda de aquisição de memória em ratos; o julgamento de sonda encontrou que os compostos Aβ pode diminuir a retenção da memória de rato; e a julgamento de reversão encontrado que o Aβ composto pode resultar em re-aprendizagem imparidade de rato. Esses dados de teste de labirinto de Morris água mostram que os compostos Aβ pode induzir memória espacial de rato. Em geral, injetando ratos intracerebroventricularly com Aβ25-35, em combinação com AlCl3 e TGF-β1 criou um viável e credível no vivo AD-como modelo animal para o laboratório.
Estudos anteriores mostraram que o volume do cérebro em pacientes AD é 10% inferior de indivíduos saudáveis. Atrofias vários podem ser encontradas no hemisfério cerebral por observação visual. O grau de atrofia cortical está positivamente relacionado com o comprometimento de memória19. A histologia, o grande número de perda de neurônio e grave patologia morfológica perturba diretamente a função de memória em pacientes de AD20. No presente estudo, a observação microscópica de Luz/elétron encontrado que os ratos injetados com compostos Aβ exibido dramáticas alterações neuropatológicas, incluindo perda de neurônio e o rompimento de estrutura neuronal e subcellular. Este resultado corrobora o distúrbio de memória espacial de rato induzido por compostos Aβ e é semelhante ao estado de pacientes.
É sabido que a carga Aβ do cérebro e agregação de NFT são considerados os traços mais importantes do histopathogenic em AD. Eles podem destruir a estrutura neuronal, perturbar a sinalização neural, interromper a função neuronal e resultar em demência avançada17. O presente modelo animal encontrado fardo Aβ e agregação de NFT no cérebro, que de acordo com o estado de paciente de AD. Portanto, as lesões de neurônio presente em ratos induzidos por compostos Aβ podem ser usadas como um modelo para estudar patologia neuronal e estratégia de tratamento de AD.
Os seguintes são exemplos de efeitos de drogas em modelos do rato AD de triagem: Zhao et al, relatada que ambos os flavonoides de Scutellaria caules e folhas (SSF) e Scutellaria barbata (SBF) pode atenuar a perda de memória de rato e apoptose induzida por compostos Aβ8,9. Guo et al, também relataram que SBF pode inibir a agregação de NFT e phosphorylation de excesso da proteína tau no lado Ser199, Ser214, Ser202, Ser404 e Thr231 e diminuir a expressão de proteínas e RNAm GSK-3beta, CDK5 e PKA em ratos tratados com Aβ compostos21 . Simultaneamente, Shang et al, também relataram que SBF pode suprimir a proliferação de astrocyte e micróglia e inferior Aβ1-40, Aβ1-42, e β-site APP fendendo a enzima 1 (BACE1) a expressão de RNAm no cérebro de Aβ composto ratos22. Baseado nos resultados acima, nosso modelo animal é vantajoso sobre outro modelo AD-como, que envolvem mais função neuronal e desordem da estrutura.
Sobre outro modelo AD-como, injeção intracerebroventricular único de Aβ para ratos pode causar déficits de memória de rato, perda de neurônio e proliferação de neurogliocyte, mas pode ou não ter Aβ e NFT deposição23. Ratos expostos a doses elevadas de Al parecem ter uma elevada taxa de sucesso, imitar AD e um econômico modelo animal, com deficiência de memória, perda de neurônio, proliferação de neurogliocyte e placa senil (SP) e agregação de NFT no cérebro. No entanto, a dose alta de Al pode causar lesões do fígado de ratos e anorexia, acompanhado com diminuição de peso24. O rato envelhecido é outro AD-como modelo. Os ratos envelhecidos demonstram déficits de memória, as alterações patológicas da estrutura neuronal/subestrutura, deposição de lipofuscina, mas sem carga Aβ e agregação de NFT. Ratos de mais de 24 meses de idade são considerados idosos para este modelo e, portanto, requer um longo período de alimentação e, assim, o custo é maior de17,25. SAMP8 e APP ratos transgénicos são os imitam mais próximo ao anúncio e eles são o mais ideais modelos para investigar AD. Mas ambos os modelos animais são fixados o preço mais alto e limitam-se a usar na laboratório26,27. Em comparação com os modelos animais acima, nosso modelo de compostos modelo animal Aβ-Tratado tem um custo mais baixo e alto desempenho, tornando-se uma ferramenta ideal para estudar AD.
Em conclusão, injeção intracerebroventricular de Aβ25-35 combinado com AlCl3 e TGF-β1 para ratos oferece um valioso na vivo modelo animal para entender melhor o comprometimento de memória espacial, lesões neuronais, fardo Aβ e deposição de NFT AD subjacente. Este modelo fornece um rápido e relativamente simples protocolo experimental com um animal de alto sobreviver taxa e taxa de sucesso alta modelo de operação, bem como uma alta taxa de duplicação, que mostrou ser mais económico. O presente modelo animal é um modelo eficaz para imitar AD e ainda mais pode validar-se por ser usado para imitar a várias outras doenças.
Disclosures
The authors have nothing to disclose.
Acknowledgements
O projeto foi apoiado pela Fundação de ciência Natural Provincial Hebei (n. º C2009001007, H2014406048), a administração de Hebei Provincial de medicina tradicional chinesa (n. º 05027) e o projeto de construção de chave de assunto da faculdade Provincial de Hebei, China.
Materials
| Sprague-Dawley rat | Beijing Vital River Laboratory Animal Technology Co., Ltd, China | SCXK(Jing) 2012-0001 | 300–350 g |
| Morris water maze | Chinese Academy of Medical Sciences and Peking Union Medical Research Institute, China | No | |
| Movable small animal anesthesi | RWD Life Science Co., Ltd. China | R580 | |
| Brain Stereotaxic Apparatus | RWD Life Science Co., Ltd. China | 68001 | |
| Flexible bone drill | Shanghai Soft Long Technology Development Co., Ltd. China | BW-sD908 | |
| Transmission electron microscope | Japan Co., Ltd. Japan | JEM-1400 | |
| Two channel microinjection pump | RWD Life Science Co., Ltd. China | RWD202 | |
| EM microtome | Hitachi Co., Ltd. China | H-7650 | |
| Dummy cannula | RWD Life Science Co., Ltd. China | 62001 | 0.D.0.64×I.D.0.0.45mm/M3.5 http://www.rwdls.com/English/Product/3985102014.html |
| Guide cannula | RWD Life Science Co., Ltd. China | 62101 | 0.D.0.40mm/M3.5 |
| Internal cannula | RWD Life Science Co., Ltd. China | 62201 | 0.D.0.41×I.D.0.25mm/ M3.5 M3.5 |
| Tighten the nut | RWD Life Science Co., Ltd. China | 62501 | 0.D.5.5mm/L7.5mm/M3.5 |
| Fixing screw | RWD Life Science Co., Ltd. China | 62514 | M1.2×L2.0mm(100BAO) |
| The screwdriver | RWD Life Science Co., Ltd. China | 62999 | 45*1mm |
| PE Tubing | RWD Life Science Co., Ltd. China | 62302 | |
| Amyloid beta 25-35 | Sigma Aldrich Co. USA | SCP0002-5MG | |
| Recombinant human transforming growth factor-β1 | PeproTech Inc. USA | 100-21 | |
| Aluminium trichloride | Tianjin Kemiou Chemical Reagent Co., Ltd. China | 3011080 | |
| Congo red | Tianjin Kemiou Chemical Reagent Co., Ltd. China | 3010016 | |
| Silver nitrate | Sinopharm Chcmical Reagent Co., Ltd. China | 20150720 | |
| Zinc phosphate dental cement | Dental Material of Factory Shanghai Medical Instruments Co., Ltd. China | 201311 |
References
- Robinson, M., Lee, B. Y., Hane, F. T. Recent Progress in Alzheimer’s Disease Research, Part 2: Genetics and Epidemiology. J. Alzheimers. Dis. , (2017).
- Hane, F. T., Lee, B. Y., Leonenko, Z. Recent Progress in Alzheimer’s Disease Research, Part 1: Pathology. J. Alzheimers Dis. , (2017).
- Perl, D. P. Neuropathology of Alzheimer’s disease. Mt. Sinai. J. Med. 77, 32-42 (2010).
- Wu, X. G., Wang, S. S., Miao, H., Cheng, J. J., Zhang, S. F., Shang, Y. Z. Scutellaria barbata flavonoids alleviate memory deficits and neuronal injuries induced by composited Aβ in rats. Behav. Brain Funct. 12, 33-43 (2016).
- Guo, K., Wu, X. G., Miao, H., Cheng, J. J., Cui, Y. D., Shang, Y. Z. Regulation and mechanism of Scutellaria bartata flavonoids on apopotosis of cortical neurons and cytochondriome induced by composited Aβ. Chin Hosp Pharm J. 35, 1994-1999 (2015).
- Guo, K., Miao, H., Wang, S. S., Cheng, J. J., Shang, Y. Z. Scutellaria barbata flavonoids inhibits NFT aggregation and regulatory mechanism in rats induced by composited Aβ. Chin. J. Pathophysio. 32, 2147-2156 (2016).
- Hou, X. C., et al. Scutellaria Barbata flavonoids inhibit the brain’s Aβ and NFT abnormal generation and affect the related enzymes expression in rats induced by composited Aβ. Chin J New Drugs. , (2017).
- Zhao, H. X., Guo, K., Cui, Y. D., Wu, X. G., Shang, Y. Z. Effect of Scutellaria barbata flavonoids on abnormal changes of Bcl-2, Bax, Bcl-xL and Bak protein expression in mitochondrial membrane induced by composite Aβ25-35. Chin J Pathophysiol. 30, 2262-2266 (2014).
- Cheng, J. J., et al. Flavonoid extract from Scutellaria stem and leaf attenuates composited Aβ- induced memory impairment and apoptosis in rats. Chin.J. New Drugs. 25, 2627-2636 (2016).
- Fang, F., Yan, Y., Feng, Z. H., Liu, X. Q., Wen, M., Huang, H. Study of Alzheimer’s disease model induced multiple factors. Chongqing Med. 36, 146-151 (2007).
- . Regulations for the Administration of Affairs Concerning Experimental Animals. The Ministry of Science and Technology of the People’s Republic of China. , 10-31 (1988).
- Bao, X. M., Shu, S. Y. . The stereotaxic atlas of the rat brain. , (1991).
- Morris, R. Developments of a water-maze procedure for studying spatial learning in the rats. J. Neurosic. Methods. 11, 47-60 (1984).
- Nunez, J. Morris Water Maze Experiment. J. Vis. Exp. (19), e897 (2008).
- Yu, J. C., Liu, C. Z., Zhang, X. Z., Han, J. X. Acupuncture improved cognitive impairment caused by multi-infarct dementia in rats. Physiol. & Behav. 86, 434-441 (2005).
- Shang, Y. Z., Miao, H., Cheng, J. J., Qi, J. M. Effects of amelioration of total flavonoids from stems and leaves of Scutellaria baicalensis Georgi on cognitive deficits, neuronal damage and free radicals disorder induced by cerebral ischemia in rats. Biol. Pharm. Bull. 29, 805-810 (2006).
- Song, H. R., Cheng, J. J., Miao, H. J., Shang, Y. Z. Scutellaria flavonoid supplementation reverses ageing-related cognitive impairment and neuronal changes in aged rats. Brain Inj. 23, 146-153 (2009).
- Wang, M., et al. Novel RAS inhibitors Poricoic Acid ZG and Poricoic Acid ZH attenuate renal fibrosis via a Wnt/β-Catenin patheway and targeted phosphorylation of smad3 signaling. J Agric Food Chem. 66, 1828-1842 (2018).
- Pini, L., et al. Brain atrophy in Alzheimer’s Disease and aging. Ageing Res. Rev. 30, 25-48 (2016).
- Ubhi, K., Masliah, E. Alzheimer’s disease: recent advances and future perspectives. J. Alzheimers Dis. 33, 85-94 (2013).
- Guo, K. . Scutellaria barbata flavonoids inhibite NFTs aggregation, tau protein phosphorylation and the regulated mechanism of related enzymes in rats induced by composited Aβ. , (2016).
- Shang, Y. Z. . Effects and Mechanism of Scutellaria Barbata Flavonoids on Rat’s Memory Impairment Induced by Compound Aβ25-35. , (2013).
- Zussy, C., et al. Alzheimer’s disease related markers, cellular toxicity and behavioral deficits induced six weeks after oligomeric amyloid-β peptide injection in rats. PLoS One. 8, 1-20 (2013).
- Walton, J. R. Aluminum involvement in the progression of Alzheimer’s disease. J. Alzheimers Dis. 35, 7-43 (2013).
- Neils-Strunjas, J., Groves-Wright, K., Mashima, P., Harnish, S. Dysgraphia in Alzheimer’s disease: a review for clinical and research purposes. J. Speech Lang Hear Res. 49, 1313-1330 (2006).
- Morley, J. E., Farr, S. A., Kumar, V. B., Armbrecht, H. J. The SAMP8 mouse: a model to develop therapeutic interventions for Alzheimer’s disease. Curr Pharm Des. 18, 1123-1130 (2012).
- Puzzo, D., Gulisano, W., Palmeri, A., Arancio, O. Rodent models for Alzheimer’s disease drug discovery. Expert Opin Drug Discov. 10, 703-711 (2015).

