Um milímetro escala Flexural sistema de testes para medir as propriedades mecânicas de espículas de esponja marinha
Summary
Apresentamos um protocolo para a realização de testes de flexão de três pontos no sub milímetros fibras de escala usando um dispositivo de teste mecânico custom-built. O dispositivo pode medir forças que variam de 20 µN até 10 N e, portanto, pode acomodar uma variedade de tamanhos de fibra.
Abstract
Muitos carga rolamento estruturas biológicas (LBBSs) — como rachises pena e espículas — são pequenas (< 1 mm) mas não microscópicas. Medindo o comportamento à flexão destes LBBSs é importante para compreender as origens de suas funções mecânicas notáveis.
Descreveremos um protocolo para realização de testes de flexão de três pontos usando um dispositivo de teste mecânico personalizado que pode medir forças que variam de 10-5 a 101 N e deslocamentos variando de 10-7 a 10-2 m. A principal vantagem deste dispositivo mecânico de testes é que as capacidades de força e o deslocamento podem ser facilmente ajustadas para LBBSs diferentes. Princípio de funcionamento do dispositivo é semelhante de um microscópio de força atômica. Ou seja, a força é aplicada para a LBBS por um ponto de carga que é anexado ao fim de um cantilever. O deslocamento do ponto de carga é medido por um sensor de deslocamento óptica de fibra e convertido em uma força usando a rigidez cantilever medido. Intervalo de força do dispositivo pode ser ajustado usando cantilevers de diferentes stiffnesses.
Os recursos do dispositivo são demonstrados através da realização de testes de flexão de três pontos sobre os elementos esqueléticos da esponja marinha Euplectella Aspersório. Os elementos esqueléticos — conhecido como espículas — são fibras de sílica que são aproximadamente 50 µm de diâmetro. Descrevemos os procedimentos para calibrar o aparelho de teste mecânico, as espículas de montagem em um dispositivo elétrico flexão de três pontos com uma extensão de mm ≈1.3, e realizando uma flexão de teste. Medem-se a força aplicada para o spicule e sua deflexão no local da força aplicada.
Introduction
Ao estudar as arquiteturas de estruturas biológicas (LBBSs), tais como shell e osso de rolamento da carga, os engenheiros desenvolveram novos materiais compósitos que são forte e duro 1. Ficou demonstrado que as propriedades mecânicas notáveis de LBBSs e os seus homólogos de bio-inspirado estão relacionadas com suas arquiteturas internas intricadas 2. No entanto, as relações entre arquiteturas LBBS e propriedades mecânicas não são totalmente compreendidas. Resposta mecânica de um LBBS de medição é o primeiro passo para entender como sua arquitetura melhora suas propriedades mecânicas.
No entanto, é importante que o tipo de teste usado para medir a resposta mecânica de um LBBS é consistente com a sua função mecânica. Por exemplo, uma vez que as penas devem suportar cargas aerodinâmicas, a principal função de um ráquis pena é fornecer a rigidez à flexão 3. Portanto, um teste de dobrando é preferido a um teste de tensão uniaxial para medir sua resposta mecânica. Na verdade, muitos LBBSs — tais como a pena rachises 3, grama caules 4e espículas 5,6,7,8— principalmente se deforma, dobrando. Isto é porque estes LBBSs são delgadas —ou seja, seu comprimento é muito maior que sua largura ou profundidade. No entanto, realizando testes de flexão nestas LBBSs é um desafio porque as forças e deslocamentos que eles podem suportar antes de falhar variam de 10-2 -102 N e 10-4 a 10-3 m, respectivamente 3 , 4 , 5 , 7 , 8. por conseguinte, o dispositivo usado para realizar esses ensaios mecânicos deve ter força e deslocamento resoluções de ≈10-5 N e ≈10-7 m (ou seja, 0,1% da força máxima mensurável e deslocamento do sensor), respectivamente.
Comercialmente disponível, em grande escala, sistemas de ensaios mecânicos normalmente não se pode medir forças e deslocamentos com esta resolução. Enquanto força atômica baseada em microscópio 9,10 ou Microeletromecânicos baseadas em sistemas 11 dispositivos de teste têm resolução adequada, a força máxima (deslocamento respectiva) podem medir é menor do que o força máxima (deslocamento respectivo) que pode suportar a LBBS. Portanto realizar testes de flexão esses LBBSs, engenheiros e cientistas deve contar com Custom-Built mecânico teste dispositivos 5,7,12,13. A principal vantagem destes dispositivos personalizados é que podem acomodar grandes gamas de forças e deslocamentos. No entanto, a construção e o funcionamento destes dispositivos não está bem documentada na literatura.
Um protocolo é descrito, realizando testes de flexão de três pontos usando um dispositivo de teste mecânico personalizado que pode medir as forças que variam de 10-5 a 101 N e deslocamentos variando de 10-7 a 10-2 m. Desenhos técnicos, incluindo todas as dimensões, os componentes do dispositivo de teste mecânico são fornecidos no Material complementar. A principal vantagem deste dispositivo de testes mecânicos é que os intervalos de força e o deslocamento podem ser facilmente ajustados para se adequar a diferentes LBBSs. Princípio de funcionamento do dispositivo é semelhante de um microscópio de força atômica 9. Neste dispositivo, um espécime é colocado através de uma trincheira cortar em uma placa de aço inoxidável (veja a Figura 1A-C). A extensão da trincheira é medida de micrografias ópticas para ser 1278 ± 3 µm (média ± desvio-padrão; n = 10). As bordas de trincheira apoiar a amostra durante um teste de flexão (ver Figura 1e D). Nesta fase de amostra é anexada a um estágio de tradução de três eixos e posicionada debaixo de uma cunha de alumínio para que a cunha está localizada no meio do caminho em toda a extensão da trincheira (ver Figura 1C). Movendo o palco 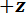 direção (ver figura 1Ae C), a amostra é empurrada para a cunha causando o espécime para dobrar.
direção (ver figura 1Ae C), a amostra é empurrada para a cunha causando o espécime para dobrar.
Nos referimos a cunha como a ponta do ponto de carga (LPT) e o componente do dispositivo que contém a cunha como o ponto de carga (LP). O LP é anexado ao fim de um cantilever cujo deslocamento é medido por um sensor de deslocamento óptica de fibra (FODS). O FODS emite luz infravermelha, que é refletida em um espelho localizado na superfície superior do LP (ver Figura 1B) e recebido por uma fibra óptica no FODS. Uma peça quadrada de uma bolacha de silicone polido ≈5 mm é usada como o espelho de LP e aposição do LP usando epóxi. O FODS mede deslocamentos, comparando a intensidade da luz emitida e refletida. A rigidez do cantilever e deslocamento são usados para calcular a força, 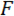 , vividas por Cunha devido à sua interação com a amostra. O deslocamento do cantilever também é usado para calcular o deslocamento de seção transversal do espécime sob a cunha,
, vividas por Cunha devido à sua interação com a amostra. O deslocamento do cantilever também é usado para calcular o deslocamento de seção transversal do espécime sob a cunha, 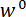 . Sensores de força baseados em cantilever têm sido usados em um número de micro e macroescala mecânica teste estudos 10,11,12,13,14. O design específico apresentado aqui é uma adaptação de um dispositivo mecânico de teste utilizado para a realização de experiências de contato adesivo 14. Um projeto similar também tem sido usado em um micro disponível comercialmente-tribometer 15,16.
. Sensores de força baseados em cantilever têm sido usados em um número de micro e macroescala mecânica teste estudos 10,11,12,13,14. O design específico apresentado aqui é uma adaptação de um dispositivo mecânico de teste utilizado para a realização de experiências de contato adesivo 14. Um projeto similar também tem sido usado em um micro disponível comercialmente-tribometer 15,16.
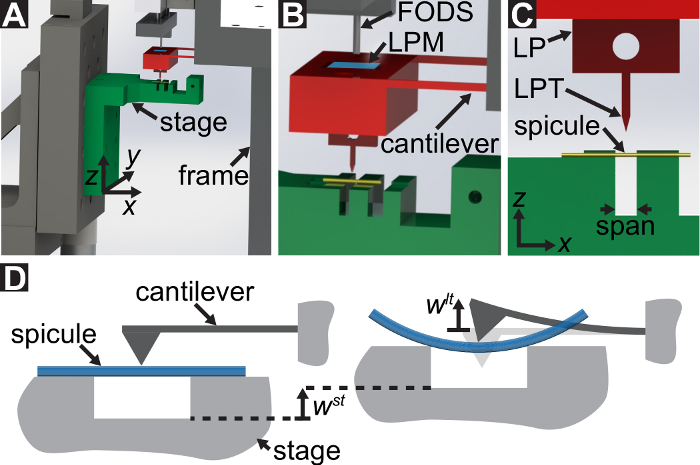
Figura 1: visão geral do dispositivo mecânico Custom-Built teste. (A), A renderização de desenho assistido por computador do dispositivo. Os componentes de fase são destacados em verde. A força de sensoriamento subconjunto (cantilever, ponto de carga (LP)) é destacada em vermelho. (B) uma ampliada vista do (A). O espelho de LP é mostrado em azul na superfície superior do LP sob o FODS e é rotulado LPM. (C) o sistema de coordenadas usado para descrever o movimento da fase de tradução. Por nivelamento thestágio e na etapa 1.9 do protocolo, o 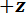 direção feita para coincidir com o vetor normal à superfície do espelho LP. (D), um esquema da configuração de flexão de três pontos mostrando a deformação do spicule e os deslocamentos medidos
direção feita para coincidir com o vetor normal à superfície do espelho LP. (D), um esquema da configuração de flexão de três pontos mostrando a deformação do spicule e os deslocamentos medidos 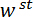 , e
, e 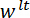 . Clique aqui para ver uma versão maior desta figura.
. Clique aqui para ver uma versão maior desta figura.
Os recursos do dispositivo são demonstrados através da realização de testes de flexão de três pontos sobre os elementos esqueléticos da esponja marinha Euplectella Aspersório6,7. Esqueleto desta esponja é um conjunto de filamentos, chamados espículas (ver Figura 2). As espículas são ≈50 µm de espessura e são compostas principalmente de silicone 6. Espículas baseada em Biosilica são encontradas em esponjas, pertencentes às classes de Demospongiae, Homosclerophorida e Hexactinellida. Esponjas, tais como E. Aspersório, que pertencem à classe Hexactinellida também são conhecidas como “esponjas de vidro”. Enquanto as espículas de esponjas de vidro são compostas principalmente de sílica, tem sido demonstrado que a sílica geralmente contém uma matriz orgânica composta ou colágeno 17,18 ou quitina 19,20 , 21. esta matriz orgânica desempenha um papel importante em sílica biomineralização 18,20. Além disso, em algumas espículas a matriz orgânica também serve como um modelo para a biomineralização de cálcio 22. Além de ser distribuída dentro da sílica, a matriz orgânica também pode formar camadas distintas que particionem sílica do spicule em lamelas concêntricas, cilíndricas 6,23. Tem sido demonstrado que essa arquitetura concêntrica, lamelar pode afetar deformação comportamento 6,7,8,24,25,26 das espículas . Por conseguinte, propriedades mecânicas das espículas são determinadas por uma combinação de sua química (i. e., a estrutura química do composto a sílica-proteína) e sua arquitetura 27. A estrutura química e a arquitetura de espículas de esponja de vidro ainda estão sob investigação de28, 24,29.
A maioria das espículas em Aspersório E. é cimentada juntos para formar uma gaiola esquelética rígida. No entanto, na base do esqueleto… há um tufo de muito tempo nas espículas (≈10 cm) conhecido como as espículas de âncora (ver Figura 2). Descrevemos o protocolo para a realização de testes de flexão de três pontos em pequenas secções de espículas a âncora.
Na etapa 1 do protocolo, é descrito o procedimento para montagem e alinhando os componentes do dispositivo de teste mecânico custom-built. As etapas 2 e 4 do protocolo fornecem instruções para gerar dados de calibração, usados para calcular as forças e deslocamentos no teste de flexão. As medidas tomadas para preparar uma seção de um spicule e montá-lo para o dispositivo de teste são descritas na etapa 3. O procedimento para a realização dos ensaios de flexão na seção spicule é descrito na etapa 5. Finalmente, na seção de Resultados de representante dos dados de calibração obtidos nos passos 2 e 4 são utilizados juntamente com os dados de teste flexão obtidos na etapa 5 para calcular 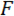 e
e 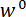 .
.

Figura 2: Procedimento para corte e inspecionando espículas E. Aspersório. (A) o esqueleto de E. Aspersório. O tufo de espículas de âncora autônoma é mostrado na base do esqueleto. Barra de escala é ~ 25 mm. (B) uma spicule única âncora é mantido no lugar em uma corrediça do microscópio usando um pincel de de Marta #00000 vermelho e seccionado usando uma lâmina de barbear. Barra de escala é ~ 12 mm. (C) uma seção de um Aspersório E. spicule colocada do outro lado da trincheira, na fase de amostra. A bordas de trincheira e a trincheira ridge são destacadas em verde-azulado e laranja, respectivamente. O spicule é empurrado contra o cume de trincheira para garantir que seu eixo é perpendicular às bordas da trincheira. (D) A Micrografia de uma spicule que passa o procedimento de inspeção descrito no passo 3.4 do protocolo, que descreve como determinar se uma seção de spicule está danificada e deve ser descartada. (E) A lâmina histológica de um spicule contendo muitas rachaduras e falta de grandes seções de camadas de sílica que falhariam o procedimento de inspeção descrito no passo 3.4 do protocolo. Escala de barras = 250 µm (C), (D) de 100 µm e 100 µm (E). Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
Diversas etapas do protocolo são particularmente importantes para garantir que as forças e deslocamentos são medidos com precisão. Enquanto alguns destes passos críticos são universais para todos os testes de flexão de três pontos, outras são exclusivas para este dispositivo de teste mecânico.
Na etapa 1.2 do protocolo o espelho LP é limpo e inspecionado por arranhões e passo 1.6 do protocolo encontra-se o ganho FODS. É importante para o ganho e a…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Este trabalho foi financiado pela National Science Foundation [mecânica de materiais e estruturas programa, atribuir número de 1562656]; e a sociedade americana de engenheiros mecânicos [Haythornthwaite Young Investigator Award].
Materials
| TMC 36" x 48" isolation table with 4" CleanTop breadboard | TMC | 63-563 | Isolation Table |
| Diffeential Screw Adjuster | Thorlabs | DAS110 | For stage leveling plate |
| 1" Travel Micrometer Head with 0.001" Graduations | Thorlabs | 150-801ME | For stage leveling plate |
| Right-Angle Bracket for PT Series Translation Stages, 1/4"-20 Mounting Holes | Thorlabs | PT102 | For microscope mount |
| 1" Dovetail Translation Stage, 1/4"-20 Taps | Thorlabs | DT25 | For microscope mount |
| 1" Translation Stage with 1/4"-170 Adjustment Screw, 1/4"-20 Taps | Thorlabs | PT1B | For microscope mount |
| 12" Length, Dovetail Optical Rail | Edmund Optics | 54-401 | For microscope mount |
| 2.5" Width, Dovetail Carrier | Edmund Optics | 54-404 | For microscope mount |
| 0.5" Width, Dovetail Carrier | Edmund Optics | 54-403 | For microscope mount |
| InfiniTube Mounting C-Clamp with ¼-20 | Edmund Optics | 57-788 | Microscope component |
| Standard (with no In-Line Attachment), InfiniTube | Edmund Optics | 56-125 | Microscope component |
| Standard In-Line Attachment (Optimized at 2X-10X), InfiniTube | Edmund Optics | 56-126 | Microscope component |
| Mitutoyo/Achrovid Objective Adapter (M26 to M27) | Edmund Optics | 53-787 | Microscope component |
| 5X Infinity Achrovid Microscope Objective | Edmund Optics | 55-790 | Microscope component |
| 0.316" ID, Fiber Optic Adapter SX-6 | Edmund Optics | 38-944 | Microscope component |
| ¼" x 36", Flexible Fiber Optic Light Guide | Edmund Optics | 42-347 | Microscope component |
| 115V, MI-150 Fiber Optic Illuminator w/IR Filter and Holder | Edmund Optics | 55-718 | Microscope component |
| Allied Vision Manta G-223 2/3" Color CMOS Camera | Edmund Optics | 88-452 | Microscope component |
| Power Supply for Manta/ Guppy Pro/ Stingray/ Pike | Edmund Optics | 68-586 | Microscope component |
| 1/4" Travel Single Axis Translation Stage | Thorlabs | MS1S | FODS micrometer |
| Analog Reflectance Dependent Fiber Optic Displacement Sensor | Philtec | D20 | FODS |
| 30V, 3A DC Power Supply | Agilent | U8001A | Power supply for DAQ and FODS |
| 14-Bit, 48 kS/s Low-Cost Multifunction DAQ | National Instruments | USB-6009 | DAQ for FODS |
| Three Axis Motorized Translation Stage | Thorlabs | Thorlabs T25 XYZ-E/M | Translation stage |
| T-Cube DC Servo Motor Controller | Thorlabs | TDC001 | Motor controller for stage |
| T-Cube Power Supply | Thorlabs | TPS001 | Power supply for motor controller |
| National Instruments LabVIEW (2013 SP1) | National Instruments | Used for running software | |
| National Instruments LabVIEW Vision Acquisition Software (2016) | National Instruments | Used for running software | |
| Nikon Eclipse Ci-POL Main Body | MVI | MDA96000 | Polarized light microscope |
| Nikon Pi Intermediate Tube with Analyzer Slider | MVI | MDB45305 | Polarized light microscope |
| Nikon Dia-Polarizer | MVI | MDN11920 | Polarized light microscope |
| Power Cord – 7'6" | MVI | 79035 | Polarized light microscope |
| Nikon P-Amh Mechanical Stage | MVI | MDC45000 | Polarized light microscope |
| Nikon Lwd Achromat Condenser | MVI | MBL16100 | Polarized light microscope |
| Nikon LV-NBD5BD-CH Manual Quint Nosepiece ESD | MVI | MBP60125 | Polarized light microscope |
| Nikon C-TF Trinocular Tube F | MVI | MBB93100 | Polarized light microscope |
| Nikon CFI 10X Eyepiece FN 22mm NC | MVI | MAK10110 | Polarized light microscope |
| Nikon TU Plan Flour BD 10x Objective | MVI | MUE42100 | Polarized light microscope |
| Venus Flower Basket Sponge | Denis Brand | N/A | Sponge skeleton |
| 3.5X Headband Flip-Up Magnifier | McMaster Carr | 1490T5 | Used for spicule sectioning |
| Ø1" Silicon Wafer, Type P / <100> | Ted Pella | 16011 | Used for load point mirror |
| Low Lint Tapered Tip Cotton Swab | McMaster Carr | 71035T31 | Used for cleaning LP mirror |
| Rubber grip precision knife | McMaster Carr | 35575A68 | Used for sectioning spicules |
| Microscope Slides, frosted end, 75 x 25 x 1mm | Ted Pella | 260409 | Used for sectioning spicules |
| Sable Brushes, #00000, 0.08mm W x 4.0mm L | Ted Pella | 11806 | Used for handling spicules |
| PELCO Pro High Precision Tweezers, extra fine tips, superior finish | Ted Pella | 5367-5NM | Used for handling spicules |
| Dual Axis Linear Scale Micrometer | Edmund Optics | 58-608 | Used for calibrating the microscopes |
| FLEX-A-TOP FT-38 CAS | ESD Plastic Containers | FT-38-CAS | Used for storing spicules |
| Plastic Vial Bullseye Level | McMaster Carr | 2147A11 | Used for leveling the stage |
| Analytical Balance | Mettler Toledo | MS105DU | Used to mass calibration weights |
References
- Wegst, U. G., Bai, H., Saiz, E., Tomsia, A. P., Ritchie, R. O. Bioinspired structural materials. Nat. Mater. 14 (1), 23-36 (2015).
- Meyers, M. A., McKittrick, J., Chen, P. Y. Structural biological materials: critical mechanics-materials connections. Science. 339 (6121), 773-779 (2013).
- Bodde, S. G., Meyers, M. A., McKittrick, J. Correlation of the mechanical and structural properties of cortical rachis keratin of rectrices of the Toco Toucan (Ramphastos toco). J. Mech. Behav. Biomed. Mater. 4 (5), 723-732 (2011).
- Gibson, L. J. The hierarchical structure and mechanics of plant materials. J. R. Soc. Interface. , (2012).
- Monn, M. A., Kesari, H. A new structure-property connection in the skeletal elements of the marine sponge Tethya aurantia that guards against buckling instability. Sci. Rep. 7, (2017).
- Monn, M. A., Weaver, J. C., Zhang, T., Aizenberg, J., Kesari, H. New functional insights into the internal architecture of the laminated anchor spicules of Euplectella aspergillum. Proc. Natl. Acad. Sci. U.S.A. 112 (16), 4976-4981 (2015).
- Monn, M. A., Kesari, H. Enhanced bending failure strain in biological glass fibers due to internal lamellar architecture. J. Mech. Behav. Biomed. Mater. , (2017).
- Levi, C., Barton, J. L., Guillemet, C., Bras, E., Lehuede, P. A remarkably strong natural glassy rod: the anchoring spicule of the Monorhaphis sponge. J. Mater. Sci. Letters. 8 (3), 337-339 (1989).
- Kesari, H., Doll, J. C., Pruitt, B. L., Cai, W., Lew, A. J. Role of surface roughness in hysteresis during adhesive elastic contact. Philos. Mag. Lett. 90 (12), 891-902 (2010).
- Croisier, F., et al. Mechanical testing of electrospun PCL fibers. Acta Biomater. 8 (1), 218-224 (2012).
- Haque, M. A., Saif, M. T. A review of MEMS-based microscale and nanoscale tensile and bending testing. Exp. Mech. 43 (3), 248-255 (2003).
- Gudlavalleti, S. . Mechanical testing of solid materials at the micro-scale. , (2002).
- Tohmyoh, H., Ishihara, M., Akanda, M. S., Yamaki, S., Watanabe, T., Iwabuchi, T. Accurate determination of the structural elasticity of human hair by a small-scale bending test. J. Biomech. 44 (16), 2833-2837 (2011).
- Waters, J. F. . Contact mechanics of biologically-inspired interface geometries. , (2009).
- Dai, Z., Gorb, S. N., Schwarz, U. Roughness-dependent friction force of the tarsal claw system in the beetle Pachnoda marginata (Coleoptera, Scarabaeidae). J. Exp. Biol. 205 (16), 2479-2488 (2002).
- Tramacere, F., Kovalev, A., Kleinteich, T., Gorb, S. N., Mazzolai, B. Structure and mechanical properties of Octopus vulgaris suckers. J. R. Soc. Interface. 11 (91), (2014).
- Ehrlich, H., et al. Nanostructural organization of naturally occurring composites: Part I. Silica-Collagen-based biocomposites. J. Nanomater. 53, (2008).
- Ehrlich, H., et al. Mineralization of the meter-long biosilica structures of glass sponges is templated on hydroxylated collagen. Nat. Chem. 2, 1084-1088 (2010).
- Ehrlich, H., et al. First evidence of the presence of chitin in skeletons of marine sponges. Part II. Glass sponges (Hexactinellida: Porifera). J. Exp. Zoo. 308 (4), 473-483 (2007).
- Ehrlich, H. Chitin and collagen as universal and alternative templates in biomineralization. Int. Geol Rev. 52, 661-699 (2010).
- Ehrlich, H., et al. Supercontinuum generation in naturally occurring glass sponge spicules. Adv. Opt. Mater. 4 (10), 1608-1613 (2016).
- Ehrlich, H., et al. Calcite reinforced silica-silica joints in the biocomposite skeleton of deep-sea glass sponges. Adv. Funct. Mater. 21, 3473-3481 (2011).
- Werner, P., Blumtritt, H., Zlotnikov, I., Graff, A., Dauphin, Y., Fratzl, P. Electron microscope analyses of the bio-silica basal spicule from the Monorhaphis chuni sponge. J. Struct. Biol. 191 (2), 165-174 (2015).
- Kolednik, O., Predan, J., Fischer, F. D., Fratzl, P. Bioinspired Design Criteria for Damage-Resistant Materials with Periodically Varying Microstructure. Adv. Funct. Mater. 21 (19), 3634-3641 (2011).
- Weaver, J. C., et al. Unifying design strategies in demosponge and hexactinellid skeletal systems. J. Adhes. 86 (1), 72-95 (2010).
- Walter, S. L., Flinn, B. D., Mayer, G. Mechanisms of toughening of a natural rigid composite. Mater. Sci. Eng. C. 27 (3), 570-574 (2007).
- Ehrlich, H. Silica biomineralization in Sponges. Encyclopedia of Geobiology. , 796-808 (2011).
- Zlotnikov, I., Werner, P., Fratzl, P., Zolotoyabko, E. Eshelby Twist as a possible source of lattice rotation in a perfectly ordered protein/silica structure grown by a simple organism. Small. 11 (42), 5636-5641 (2015).
- Zlotnikov, I., et al. A perfectly periodic three-dimensional protein/silica mesoporous structure produced by an organism. Adv. Mater. 26 (11), 1682-1687 (2014).
- Gere, J. M., Timoshenko, S. P. Chapter 5: Stresses in Beams. Mechanics of materials. , 205-217 (1997).
- Baratta, F. I., Matthews, W. T., Quinn, G. D. . Errors associated with flexure testing of brittle materials. , (1987).
- Quinn, G. D., Sparenberg, B. T., Koshy, P., Ives, L. K., Jahanmir, S., Arola, D. D. Flexural strength of ceramic and glass rods. J. Test. Eval. 37 (3), 1-23 (2009).
- Tattersall, H. G., Tappin, G. The work of fracture and its measurement in metals, ceramics and other materials. J. Mater. Sci. 1 (3), 296-301 (1966).

