SwarmSight: Seguimiento en tiempo real de movimientos de insecto de antena y reflejo de extensión probóscide utilizando una preparación común y Hardware convencional
Summary
Este protocolo describe los pasos para utilizar el nuevo software, SwarmSight, para el rastreo de cuadro por cuadro de insectos antena y proboscis de vídeos de cámara web convencional utilizando equipos convencionales. El software libre, código abierto procesos Marcos cerca de 120 veces más rápido que los seres humanos y se realiza en mejor que la precisión humana.
Abstract
Muchos insectos de importancia agrícola y científico utilizan antenas para detectar la presencia de compuestos químicos volátiles y extiende su probóscide durante la alimentación. La capacidad de rápidamente obtener medidas de alta resolución de movimientos naturales de la antena y la probóscide y evaluar cómo cambian en respuesta a las manipulaciones químicas, genéticas y de desarrollo puede ayudar a la comprensión del comportamiento de insectos. Mediante la ampliación de nuestro anterior trabajo sobre la evaluación agregada enjambre de insectos o movimientos de animales grupo de natural y laboratorio videos utilizando el software de análisis de vídeo SwarmSight, hemos desarrollado un módulo de software nuevo, libre y de código abierto, SwarmSight Apéndice Seguimiento (SwarmSight.org) para el rastreo de cuadro por cuadro de insectos antena y proboscis de vídeos de cámara web convencional con equipos convencionales. El software procesa fotogramas aproximadamente 120 veces más rápidos que los seres humanos, realiza en mejor que la precisión humana y, con 30 fotogramas por segundo videos (fps), puede capturar dinámica antenal hasta 15 Hz. El software fue utilizado para rastrear la respuesta antenal de abejas a dos olores y encontró importantes retracciones antenales media distancia de la fuente de olor 1 s después de la presentación de olor. Observamos calor de densidad de posición de antena significa dependencia del ángulo de concentración de olor y mapa clúster y formación de grupos.
Introduction
La mayoría artrópodos mover antenas u otro apéndice a muestra señales ambientales y las señales en tiempo y espacio. Los animales pueden utilizar las antenas para navegar su entorno mediante la detección de señales sensoriales tales como químicos volátiles y estímulos gustativos y mecánico1,2,3,4. En los insectos, las antenas contienen receptores sensoriales que se unen a químicos volátiles4,5,6 y transmiten esta señal a través de las neuronas sensoriales olfativas al cerebro central regiones1,7 ,8,9. Los insectos pueden ajustar posiciones de antenas para modular la información entrante olores4,10,11. Esta modulación facilita activamente informadas respuestas conductuales a los olores y sus plumas12,13.
Alimentación de muchos insectos, incluyendo agroecosistemas (por ejemplo, miel de abejas y abejorros), lepidópteros (por ejemplo, mariposas) y dípteros (por ej., moscas y mosquitos), entre otros, ampliando su probóscide14 , 15 , 16 , 17 , 18 , 19 , 20 , 21. extensión de la probóscide se ha utilizado confiablemente en el pasado para una variedad de aprendizaje y la memoria las tareas22,23,24,25,26, 2728,de,29,30,31. Del mismo modo, evaluación cuantitativa del movimiento de antenas con alta resolución temporal y espacial podría producir penetración en la relación entre el estímulo, el comportamiento y el estado interno del animal. De hecho anterior trabajo ha mostrado cómo los movimientos antenales contienen una rica cantidad de información acerca del seguimiento de la abeja de miel del medio ambiente y cómo los movimientos cambian con el aprendizaje32,33,34, 35,36,37,38.
En la última década, métodos para observar comportamiento animal han sido grandemente acelerados por los avances en cámaras de video de alta resolución, equipo procesamiento de velocidades y algoritmos de visión de máquina. Tareas como la detección de animales, conteo, seguimiento y análisis de preferencia de lugar han sido ayudadas con software sofisticado que puede procesar vídeos de comportamiento animal y extracto relevante mide39,40, 41,42,43,44,45,46,47.
Estas tecnologías han ayudado también seguimiento de insectos movimientos antena y probóscide. Es posible que evaluadores humanos utilizar un cursor de ratón a seguir manualmente la posición de las antenas. Sin embargo, mientras que este método puede ser exacto, la tarea es desperdiciador de tiempo y fatiga y falta de atención humana pueden resultar en resultados poco fiables. Preparación y el equipo especial pueden utilizarse para reducir la necesidad de software complejo. Por ejemplo, una configuración utiliza una cámara de alta velocidad y pintado de las puntas de las antenas para rastrear el movimiento de antena48. Los usuarios también se le pueden pedir para seleccionar fotogramas clave de videos para ayudar al software en la detección de la ubicación de antena y probóscide49. Otro enfoque detecta los dos grupos de movimiento mayor para identificar antenas, pero no detecta la probóscide ubicación50. Otro paquete de software puede detectar ubicaciones de la antena y probóscide, pero requiere de unos 7.5 s de tiempo de procesamiento por marco51, que podría ser prohibitivo para los estudios de observación en tiempo real o a largo plazo. Finalmente, es posible personalizar paquetes de software comercial (por ejemplo, EthoVision) para realizar la tarea46, pero los gastos de licencias y capacitación pueden ser prohibitivos.
Con el método descrito aquí, hemos ampliado nuestro trabajo anterior sobre el movimiento análisis software41 para rastrear la ubicación de antenas de insectos y probóscide con los siguientes objetivos: (1) no requiere de hardware especial o preparación animal complejo, (2). marco de procesamiento en tiempo real (30 fps o más rápido) en una computadora convencional, (3) facilidad de uso y (4) open-source, código fácilmente extensible.
El novedoso método resultante y software de código abierto, SwarmSight apéndices de seguimiento, no requiere pintura de las puntas de las antenas, puede utilizar una cámara web de consumidor para capturar vídeos y fotogramas de vídeo de procesos en 30-60 fps en un ordenador convencional ( Figura 1). El software toma los archivos de vídeo como entrada. El usuario localiza la posición de la cabeza del insecto en el vídeo y, después de procesar, se produce un archivo de valores separados (CSV) de comas con las ubicaciones de las antenas y la probóscide. El software es capaz de leer cientos de formatos de video (incluidos los formatos producidos por la mayoría de las cámaras digital) a través del uso de la biblioteca FFmpeg del52.
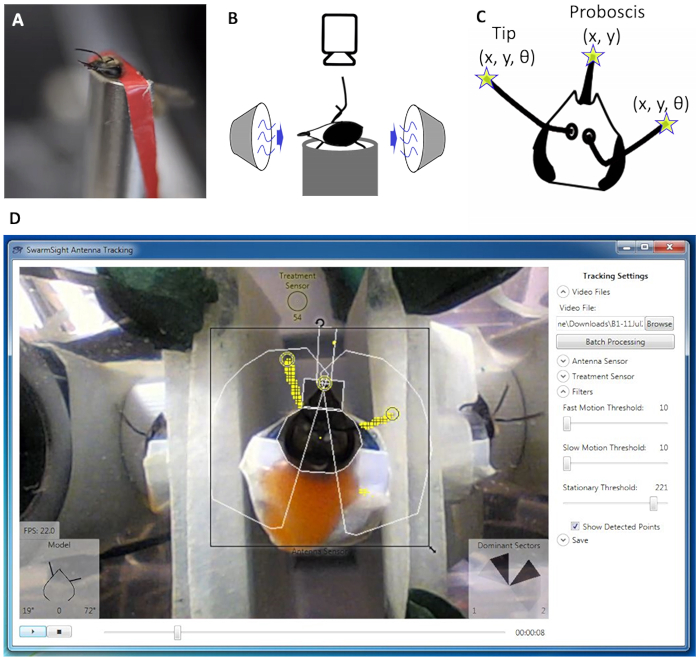
Figura 1: Animal salida de configuración y software. (A) A cazador de abejas de miel con su cabeza y el cuerpo de un arnés. Olor (B) fuente se coloca frente al animal, una cámara de vídeo se coloca por encima, y una fuente de vacío se coloca detrás del animal. (C) la antena punta y probóscide variables detectadas por el software de SwarmSight en el video. (D) el usuario coloca el sensor de antena sobre el animal y ajusta los parámetros del filtro. El software detecta la posición de la antena y probóscide (anillos amarillos).Haga clic aquí para ver una versión más grande de esta figura.
En primer lugar, cuerpo de un insecto y su cabeza se refrenan en un arnés que los movimientos de la antena y la probóscide se observan fácilmente (figura 1A). Una fuente de olor se coloca delante del insecto, con una fuente de vacío colocada detrás, para eliminar los olores del aire y minimizar los efectos potenciales de adaptación sensorial (figura 1B). Una cámara web convencional se coloca encima de la cabeza de los insectos en un trípode. Un LED puede colocarse dentro de la visión de la cámara para indicar cuando se presenta el olor.
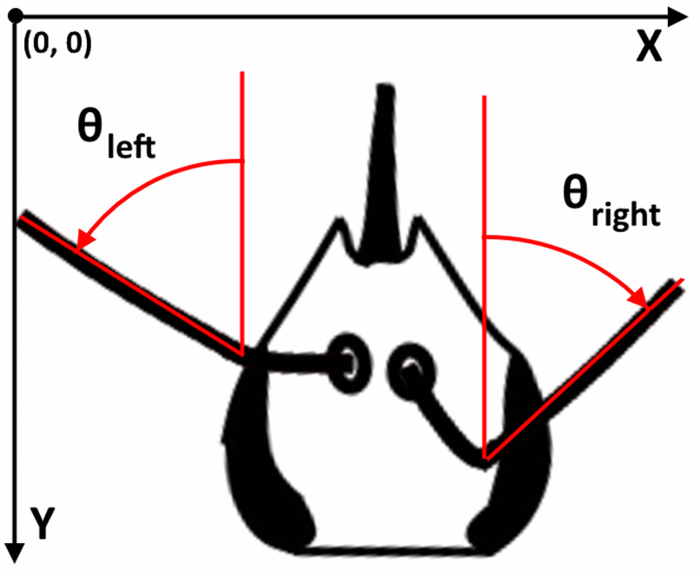
Figura 2: sistema de coordenadas de la antena. X, Y valores utilizan el sistema de coordenadas video donde esquina superior izquierda es el origen y aumento de los valores de X e Y cuando se mueve hacia la esquina inferior derecha. Los ángulos se expresan en grados con respecto a la parte delantera de la cabeza (generalmente la fuente de olor). El valor “0” significa que la línea formada por el flagelo de la antena esté apuntando directamente en frente del animal. Todos los ángulos son positivos, excepto cuando un puntos de antena en la dirección opuesta (por ejemplo, puntos de flagelo derecha a la izquierda). Haga clic aquí para ver una versión más grande de esta figura.
Después de la filmación, se abre el archivo de vídeo con el software de SwarmSight, donde el usuario coloca el widget de antena Sensor (figura 1, cuadro negro) sobre la cabeza del insecto y comienza la reproducción del vídeo. Cuando se guardan los resultados, el archivo .csv contiene la X, consejos Y posiciones de la antena, los ángulos de la antena con respecto a la parte delantera de la cabeza (figura 2) y la probóscide X, Y posición. Además, la métrica de un sector dominante se calcula para cada antena. La métrica muestra que de los cinco sectores de 36 grados que rodean cada antena contiene la mayor cantidad de puntos considera probable que las antenas y puede ser útil si los parámetros de posición/ángulo de la antena no son confiables debido a videos de ruido o de lo contrario problemáticos.
Brevemente, el software funciona mediante el uso de un conjunto de movimiento filtros53 y relajado flood fill algoritmo54. Para encontrar los puntos de la antena posible, se utilizan dos filtros: un filtro de 3 consecutivos marco diferencia41,55 y un filtro de mediana-fondo56 . Un filtro de color distancia umbral se utiliza para la detección del punto de probóscide. El 10% de los puntos de cada filtro se combinan, y un algoritmo de relleno de inundación que inspecciona puntos contiguos con huecos hasta 2 pixeles (px) localiza puntos extremos. Paralelo marco descifrar, procesamiento y tuberías de procesamiento y memoria optimizada alcanza la asignación del flujo de datos de filtro de alto rendimiento. Crudo x los valores de coordenadas y producidos por el software son después procesados con un 3-marco laminado filtro mediana57 (ver discusión). Las instrucciones para descargar el código fuente completo se pueden encontrar en línea58.
A continuación es un protocolo para preparar a una forrajera de abeja de la miel para la antena de seguimiento. Un protocolo similar podría usarse para rastrear los movimientos de la antena/proboscis de cualquier otro insecto. En la sección de resultados, se describe una salida de rastro de antena muestra que es detectada por el software, la comparación de la salida del software al seguimiento realizado por evaluadores humanos y evaluación del movimiento de antenas en respuesta a cinco olores.
Protocol
Representative Results
Discussion
El método presentado aquí permite seguimiento en tiempo real de movimientos de antena y probóscide insectos sin necesidad de preparaciones especiales animales o hardware.
Limitaciones:
A pesar de estas ventajas, existen algunas limitaciones del método. Estos incluyen el requisito de que la cabeza del animal está restringida de movimiento, la necesidad de que el usuario seleccione la ubicación y orientación de los animales para cada video, el requisito para tener acceso a una computadora con Windows e incapacidad del software de seguimiento movimiento en tres dimensiones (3D) y en algunas posiciones del apéndice visualmente ambigua que se describe a continuación.
El software requiere que la cabeza del animal se fija en su lugar y no se mueve durante el video. Esto es similar a las preparaciones del anterior trabajo48,49,50,51. Es posible modificar el software para permitir la detección automática de rotaciones de cabeza, sin embargo, esto consume tiempo de procesamiento adicional e introducir una nueva fuente de error. Si el software modificado debían detectar la rotación de la cabeza de forma incorrecta, esto afectaría los ángulos de antenas, como su cómputo en relación con el ángulo de rotación de la cabeza. Actualmente, el usuario selecciona la orientación principal de una vez por video. Este enfoque, aunque no sin error humano, minimiza los errores de cálculo de ángulo cuando la cabeza no debe moverse durante el video.
El software también requiere un 7 (o posterior) sistema operativo (OS). El objetivo era que el software sea fácil de instalar, configurar y utilizar por usuarios sin conocimientos de administración de computadoras programación o sofisticado. Decidimos destino Windows porque está ampliamente disponible, y en casos donde el acceso es limitado, se pueden crear fácilmente máquinas virtuales (por ejemplo, VirtualBox, VMware, Parallels) con Windows. Esta elección de OS grandemente simplifica la instalación del software mediante el uso de un instalador fácil de usar, libre desde la línea de comandos y evita errores específicos de diferentes OSs.
El software sólo rastrea la posición de los apéndices en el espacio 2D. Insectos son conocidos por mover su antena en 3D, que podría significar que la información importante se pierde cuando sólo 2D coordenadas se miden. Mientras que el uso de múltiples cámaras o espejos podría ayudar en la recolección de la información adicional necesaria para la localización de 3D, es posible calcular, con el uso de relaciones trigonométricas, una posición estimada de la hacia fuera-de-plano por suponer que las antenas son segmentos de línea de longitud constante y movimiento solamente en un lado del plano de cámara. Para miel de abejas, este supuesto es válido para obtener estimaciones aproximadas para la posición en 3D, pero no sería necesariamente el caso para otras especies y situaciones.
El software no detecta correctamente las antenas y probóscide punta localidades en situaciones ambiguas. Si un animal mueve a una antena para que, en el video, que superpone una probóscide extendida, el software detectará probablemente la punta de la antena como la punta de la probóscide. El ángulo de la antena sin embargo, todavía es probable que se le compute correctamente (de la parte no superpuestos). Del mismo modo, si las puntas de la antena se mueven directamente sobre la cabeza del animal (es decir, no en los lados) entonces el software puede solamente detectar la parte de la antena que es visible fuera de la cabeza, asumir la anterior ubicación de la antena o detectar falso ruido de vídeo como ubicación de la antena. En ambas situaciones, incluso humanos calificadores tienen dificultades para discernir la antena de la probóscide o la cabeza. Para mitigar este problema, se recomienda aplicar un filtro de mediana57 balanceo 3-marco, simétrico a raw X e Y coordenadas producción por el software. Este filtro elimina las fluctuaciones grandes transitorios (solo cuadro) posición y conserva más movimientos de posición de antena. Hemos encontrado que el filtro 3-marco realizado mejor que ningún filtro, filtros más amplios (por ejemplo, 5, 11 o 15 fotogramas) redujo exactitud. Ejemplo R de código que utiliza el filtro y un tutorial de vídeo se puede encontrar en línea58.
Valor como una herramienta científica:
La disponibilidad de un método para obtener rápidamente movimientos de apéndice de insecto precisa de una manera rentable tiene el potencial para abrir nuevas áreas de investigación.
Reflejo de extensión probóscide (PER) es una respuesta de comportamiento utilizada para investigar el aprendizaje y la memoria de una gran variedad de insectos59. Estudios previos han dependido generalmente binario extendido o no medida de PER, aunque análisis videos y electromiográficos han demostrado topologías más complejas a probóscide movimientos65,66. El método aquí permite la cuantificación rápida de movimientos de la probóscide en altas resoluciones temporales y espaciales.
Movimientos de la antena del insecto en respuesta a los olores son poco conocidos. Una de las razones es que las antenas tienden a moverse tan rápidamente que un medio rentable y automatizado para obtener datos de movimiento de la antena no ha estado disponible. El método presentado aquí podría utilizarse para obtener rápidamente datos de movimiento de la antena para un gran número de insectos en un gran número de condiciones. Esto podría ayudar, por ejemplo, los investigadores investigaron la correlación entre movimientos de la antena en respuesta a varios estímulos, olores volátiles en particular. Usando cámaras de capturan de fotogramas a 30 Hz, el software puede utilizarse para caracterizar la dinámica de movimiento antenal hasta 15 Hz (límite Nyquist). Si es necesario la caracterización en las frecuencias más altas, podrían utilizarse cámaras con mayores tasas de captura (por ejemplo, 60 ó 120 fps). Sin embargo, un ordenador más rápido puede ser requerido para procesar vídeos de fps más alta en tiempo real. Especulamos que las clases de olores y posiblemente incluso algunos olores individuales, tienen movimientos antenales innatos característicos. Si esas clases o compuestos podrían ser descubierto, desconocido, pudo detectarse olores o su clase de movimiento antenal de insectos. Si existe tal asignación, la combinación de suficientes datos de movimiento de la antena y algoritmos de aprendizaje de la máquina del estado del arte debe empezar a descubrirlo. También, cómo esa asignación cambia en respuesta a aprendizaje, formas durante el desarrollo, o se interrumpe con las intervenciones genéticas podrían ofrecer información sobre las funciones del sistema olfativo.Finalmente, este trabajo podría dar una visión artificial detección de olores si revela métodos de muestreo óptimo para los olores en entornos complejos.
Trabajo futuro:
Aquí, mostramos que antena movimiento rápidamente obtenidos y datos analizados: las respuestas de comportamiento significativos pueden ser detectadas desde los datos generados por nuestro software, y se identificaron varias áreas de mayor investigación.
Los cursos de tiempo de antena sacada de estímulo ángulo recuperación a línea de fondo y las desviaciones de y cualquier efecto de rebote de estímulo-conclusión y su dependencia de concentración de olor pueden ser investigados y modeladas matemáticamente. Además, cualquier cambio de los movimientos de la antena inducida por apetitivo o aversivo acondicionado también puede evaluarse con el software.
También puede explorarse mejor diferenciación de olores. En este estudio, los olores, en puro y 35 x versiones diluidas produce respuestas similares: las antenas, en promedio, aparecieron rápidamente retirar de la fuente de olor y volver a pre-olores instantáneas después de unos segundos. Especulamos que incluso las versiones diluidas pueden haber sido muy fuertes estímulos olfativos para las abejas. Si es cierto, una gama más amplia de concentraciones podría utilizarse para determinar si las respuestas antenales distinguen los olores. Además, análisis más sofisticados mejor pueden revelar diferencias en movimientos antenales en respuesta a diferentes olores. Hemos hecho los archivos de datos para generar figuras en este manuscrito disponible para investigadores interesados en la Página Web de SwarmSight67.
Además, mientras que fuera del alcance de este manuscrito, el software podría extenderse para procesar vídeos de animales colocados en cámaras con dos espejos en ángulo a 45° (ver por ejemplo figura 1 ). Esto podría utilizarse para localizar y rastrear su movimiento en el espacio 3D y los apéndices exactamente. Sin embargo, los algoritmos para el seguimiento 3D exigiría eficiente: (a) eliminar la ambigüedad entre antenas múltiples cuando son visibles en uno de los espejos laterales, (b) correctos para imperfecciones en ángulos de espejo y (c) representan distorsiones debido a la cámara posicionamiento.
Finalmente, aumentos adicionales en la exactitud de la posición puede realizarse mediante el uso de un Kalman filtro68, qué modelos y utiliza la información de estado físico como apéndice velocidad y aceleración para restringir ubicaciones previstas. Sin embargo, cualquier aumento en la precisión debe ser evaluada contra las reducciones en la velocidad debido a cómputos adicionales.
CONCLUSIÓN:
Muchos insectos utilizan antenas para activamente la muestra compuestos volátiles en sus ambientes locales. Patrones de movimientos antenales pueden proporcionar la penetración en la percepción de olor insectos y cómo es afectado por alteraciones genéticas, acondicionado y compuestos tóxicos. Del mismo modo, movimientos de probóscide se han utilizado para evaluar la percepción del olor y su modulación. Sin embargo, ha sido difícil obtener rápidamente grandes cantidades de datos de movimiento de alta resolución de la orejuela. Aquí, un software y Protocolo se describe que automatiza esta tarea. En Resumen, hemos creado y demostró cómo la combinación de hardware barato, una preparación de animales comun y el software de código abierto se pueden utilizar para obtener rápidamente datos de movimiento de alta resolución apéndice de insecto. Se muestra la salida del software, cómo supera calificadores humanos en velocidad y precisión, y cómo se pueden analizar y visualizar los datos de salida.
Disclosures
The authors have nothing to disclose.
Acknowledgements
JB, SMC y RCG apoyados por NIH R01MH1006674 a SMC y R01EB021711 NIH para RCG. CMJ y BHS fueron apoyados por el proyecto de laboratorio de Ideas de NSF en “agrietar el código olfativo” a BHS. Agradecemos a Kyle Steinmetz, Taryn Oboyle y Rachael Halby por su asistencia en la realización de esta investigación.
Materials
| Insect harness | N/A | N/A | Use materials needed for Protocol sections 1-3.1.1 of Smith & Burden (2014) |
| Odor delivery source | N/A | N/A | Use materials needed for Protocol section 3 of Smith & Burden (2014) |
| Vacuum source | N/A | N/A | Use materials needed for Protocol section 3 of Smith & Burden (2014) |
| LED connected to odor delivery source | N/A | N/A | Use materials needed for Protocol section 3 of Smith & Burden (2014) |
| Low Voltage Soldering Iron | Stannol | Low Voltage Micro Soldering Iron 12V, 8W | |
| DC Power Supply | Tekpower | HY152A | |
| White sheet of paper | Georgia-Pacific | 998606 | Any white sheet of paper can be used as alternative |
| Tripod | AmazonBasics | 50-Inch Lightweight Tripod | Optional |
| Camera | Genius | WideCam F100 | FLIR Flea3 or another camera with manual focus can be used. |
| Camera software | Genius | N/A | Software comes with camera. On MacOS, Photo Booth app can be used to record videos. |
| Camera shutter speed software | Genius | N/A | Genius camera software allows shutter speed setting. In Mac OS, iGlasses by ecamm can be used instead: http://www.ecamm.com/mac/iglasses/ |
| Windows Operating System | Microsoft | Windows 7 Professional | Versions 7 or later are compatible. Oracle VirtualBox, Parallels Desktop, or VMWare Fusion can be used to create a Windows virtual machine in MacOS environments. |
| SwarmSight software | SwarmSight | Appendage Tracking | Download from http://SwarmSight.org |
| R software | R Project | R 3.4.0 | Download from: https://cran.r-project.org/bin/windows/base/ |
| R Studio software | RStudio | RStudio Desktop | Download from: https://www.rstudio.com/products/rstudio/download/ |
References
- Hansson, B. S. . Insect Olfaction. , (1999).
- Masson, C., Mustaparta, H. Chemical information processing in the olfactory system of insects. Physiol Rev. 70 (1), 199-245 (1990).
- Firestein, S. How the olfactory system makes sense of scents. Nature. 413 (6852), 211-218 (2001).
- Schneider, D. Insect antennae. Annu Rev Entomol. 9 (1), 103-122 (1964).
- Kaissling, K. Chemo-electrical transduction in insect olfactory receptors. Annu Rev Neurosci. 9 (1), 121-145 (1986).
- Nakagawa, T., Vosshall, L. B. Controversy and consensus: noncanonical signaling mechanisms in the insect olfactory system. Curr Opin Neurobiol. 19 (3), 284-292 (2009).
- Heisenberg, M. What do the mushroom bodies do for the insect brain? An introduction. Learn Memory. 5 (1), 1-10 (1998).
- Zars, T. Behavioral functions of the insect mushroom bodies. Curr Opin Neurobiol. 10 (6), 790-795 (2000).
- Heisenberg, M. Mushroom body memoir: from maps to models. Nature Rev Neurosci. 4 (4), 266-275 (2003).
- Pelletier, Y., McLEOD, C. D. Obstacle perception by insect antennae during terrestrial locomotion. Physiol Entomol. 19 (4), 360-362 (1994).
- Suzuki, H. Antennal movements induced by odour and central projection of the antennal neurones in the honey-bee. J Insect Physiol. 21 (4), 831-847 (1975).
- Wachowiak, M. All in a sniff: olfaction as a model for active sensing. Neuron. 71 (6), 962-973 (2011).
- Bruce, T. J., Wadhams, L. J., Woodcock, C. M. Insect host location: a volatile situation. Trends Plant Sci. 10 (6), 269-274 (2005).
- Lunau, K., Wacht, S. Optical releasers of the innate proboscis extension in the hoverfly Eristalis tenax L.(Syrphidae, Diptera). J Comp Physiol [A]. 174 (5), 575-579 (1994).
- Szucsich, N. U., Krenn, H. W. Morphology and function of the proboscis in Bombyliidae (Diptera, Brachycera) and implications for proboscis evolution in Brachycera. Zoomorphology. 120 (2), 79-90 (2000).
- Harder, L. D. Measurement and estimation of functional proboscis length in bumblebees (Hymenoptera: Apidae). Can J Zool. 60 (5), 1073-1079 (1982).
- Hobbs, G. A. Further studies on the food-gathering behaviour of bumble bees (Hymenoptera: Apidae). Canadian Entomol. 94 (05), 538-541 (1962).
- Krenn, H. W. Functional morphology and movements of the proboscis of Lepidoptera (Insecta). Zoomorphology. 110 (2), 105-114 (1990).
- Krenn, H. W. Feeding mechanisms of adult Lepidoptera: structure, function, and evolution of the mouthparts. Annu Rev Entomol. 55, 307-327 (2010).
- Hepburn, H. R. Proboscis extension and recoil in Lepidoptera. J Insect Physiol. 17 (4), 637-656 (1971).
- Ramírez, G., Fagundez, C., Grosso, J. P., Argibay, P., Arenas, A., Farina, W. M. Odor Experiences during Preimaginal Stages Cause Behavioral and Neural Plasticity in Adult Honeybees. Front Behav Neurosci. 10, (2016).
- Takeda, K. Classical conditioned response in the honey bee. J Insect Physiol. 6 (3), 168-179 (1961).
- Bitterman, M. E., Menzel, R., Fietz, A., Schäfer, S. Classical conditioning of proboscis extension in honeybees (Apis mellifera). J Comp Psychol. 97 (2), 107 (1983).
- Lambin, M., Armengaud, C., Raymond, S., Gauthier, M. Imidacloprid-induced facilitation of the proboscis extension reflex habituation in the honeybee. Arch Insect Biochem Physiol. 48 (3), 129-134 (2001).
- Masterman, R., Smith, B. H., Spivak, M. Brood odor discrimination abilities in hygienic honey bees (Apis mellifera L.) using proboscis extension reflex conditioning. J Insect Behav. 13 (1), 87-101 (2000).
- Rix, R. R., Christopher Cutler, G. Acute Exposure to Worst-Case Concentrations of Amitraz Does Not Affect Honey Bee Learning, Short-Term Memory, or Hemolymph Octopamine Levels. J Econ Entomol. 110 (1), 127-132 (2017).
- Urlacher, E., et al. Measurements of Chlorpyrifos Levels in Forager Bees and Comparison with Levels that Disrupt Honey Bee Odor-Mediated Learning Under Laboratory Conditions. J Chem Ecol. 42 (2), 127-138 (2016).
- Charbonneau, L. R., Hillier, N. K., Rogers, R. E. L., Williams, G. R., Shutler, D. Effects of Nosema apis, N. ceranae, and coinfections on honey bee (Apis mellifera) learning and memory. Sci Rep. 6, (2016).
- Urlacher, E., Devaud, J. -. M., Mercer, A. R. C-type allatostatins mimic stress-related effects of alarm pheromone on honey bee learning and memory recall. PLOS ONE. 12 (3), e0174321 (2017).
- Eiri, D. M., Nieh, J. C. A nicotinic acetylcholine receptor agonist affects honey bee sucrose responsiveness and decreases waggle dancing. J Exp Biol. 215 (12), 2022-2029 (2012).
- Liang, C. -. H., Chuang, C. -. L., Jiang, J. -. A., Yang, E. -. C. Magnetic Sensing through the Abdomen of the Honey bee. Sci Rep. 6, (2016).
- Erber, J., Pribbenow, B., Bauer, A., Kloppenburg, P. Antennal reflexes in the honeybee: tools for studying the nervous system. Apidologie. 24, 283 (1993).
- Erber, J., Kierzek, S., Sander, E., Grandy, K. Tactile learning in the honeybee. J Comp Physiol [A]. 183 (6), 737-744 (1998).
- Erber, J., Pribbenow, B. Antennal Movements in the Honeybee: How Complex Tasks are Solved by a Simple Neuronal System. Prerational Intelligence: Adaptive Behavior and Intelligent Systems Without Symbols and Logic, Volume 1, Volume 2 Prerational Intelligence: Interdisciplinary Perspectives on the Behavior of Natural and Artificial Systems, Volume 3. , 109-121 (2000).
- McAfee, A., Collins, T. F., Madilao, L. L., Foster, L. J. Odorant cues linked to social immunity induce lateralized antenna stimulation in honey bees (Apis mellifera L). Sci Rep. 7, (2017).
- Dötterl, S., Vater, M., Rupp, T., Held, A. Ozone Differentially Affects Perception of Plant Volatiles in Western Honey Bees. J Chem Ecol. 42 (6), 486-489 (2016).
- Wang, Z., et al. Honey Bees Modulate Their Olfactory Learning in the Presence of Hornet Predators and Alarm Component. PLOS ONE. 11 (2), e0150399 (2016).
- Søvik, E., Plath, J. A., Devaud, J. -. M., Barron, A. B. Neuropharmacological Manipulation of Restrained and Free-flying Honey Bees, Apis mellifera. J Vis Exp. (117), e54695 (2016).
- Fang, Y., Du, S., Abdoola, R., Djouani, K., Richards, C. Motion Based Animal Detection in Aerial Videos. Procedia Computer Science. 92, 13-17 (2016).
- Miller, B., Lim, A. N., Heidbreder, A. F., Black, K. J. An Automated Motion Detection and Reward System for Animal Training. Cureus. 7 (12), (2015).
- Birgiolas, J., Jernigan, C. M., Smith, B. H., Crook, S. M. SwarmSight: Measuring the temporal progression of animal group activity levels from natural-scene and laboratory videos. Behav Res Methods. , (2016).
- Stern, U., Zhu, E. Y., He, R., Yang, C. -. H. Long-duration animal tracking in difficult lighting conditions. Sci Rep. 5, 10432 (2015).
- Macrì, S., Mainetti, L., Patrono, L., Pieretti, S., Secco, A., Sergi, I. A tracking system for laboratory mice to support medical researchers in behavioral analysis. Engineering in Medicine and Biology Society (EMBC), 2015 37th Annual International Conference of the IEEE. , 4946-4949 (2015).
- Crall, J. D., Gravish, N., Mountcastle, A. M., Combes, S. A. BEEtag: a low-cost, image-based tracking system for the study of animal behavior and locomotion. PLOS ONE. 10 (9), e0136487 (2015).
- York, J. M., Blevins, N. A., McNeil, L. K., Freund, G. G. Mouse short-and long-term locomotor activity analyzed by video tracking software. J Vis Exp. (76), e50252 (2013).
- Noldus, L. P., Spink, A. J., Tegelenbosch, R. A. EthoVision: a versatile video tracking system for automation of behavioral experiments. Behav Res Methods. 33 (3), 398-414 (2001).
- Egnor, S. E. R., Branson, K. Computational Analysis of Behavior. Annu Rev Neurosci. 39 (1), 217-236 (2016).
- Cholé, H., Junca, P., Sandoz, J. -. C. Appetitive but not aversive olfactory conditioning modifies antennal movements in honeybees. Learn Memory. 22 (12), 604-616 (2015).
- Shen, M., et al. Interactive tracking of insect posture. Pattern Recognit. 48 (11), 3560-3571 (2015).
- Mujagić, S., Würth, S. M., Hellbach, S., Dürr, V. Tactile conditioning and movement analysis of antennal sampling strategies in honey bees (apis mellifera l). J Vis Exp. (70), (2012).
- Shen, M., Szyszka, P., Deussen, O., Galizia, C. G., Merhof, D. Automated tracking and analysis of behavior in restrained insects. J Neurosci Methods. 239, 194-205 (2015).
- Cucchiara, R., Grana, C., Piccardi, M., Prati, A. Detecting moving objects, ghosts, and shadows in video streams. IEE Trans Pattern Anal Mach. 25 (10), 1337-1342 (2003).
- Shaw, J. R. QuickFill: An efficient flood fill algorithm. The Code Project. , (2004).
- Zhang, H., Wu, K. A vehicle detection algorithm based on three-frame differencing and background subtraction. Computational Intelligence and Design (ISCID), 2012 Fifth International Symposium on Computational Intelligence and Design. 1, 148-151 (2012).
- Elgammal, A., Harwood, D., Davis, L. Non-parametric Model for Background Subtraction. Computer Vision – ECCV 2000. , 751-767 (2000).
- Zeileis, A., Grothendieck, G. zoo: S3 infrastructure for regular and irregular time series. arXiv preprint math/0505527. , (2005).
- Smith, B. H., Burden, C. M. A Proboscis Extension Response Protocol for Investigating Behavioral Plasticity in Insects: Application to Basic, Biomedical, and Agricultural Research. J Vis Exp. (91), e51057 (2014).
- How to split a video or audio file with VLC Player. Darktips Available from: https://darktips.com/split-video-audio-file/ (2012)
- Team, R. s. . RStudio: integrated development for R. , (2015).
- Venables, W. N., Ripley, B. D. . Modern Applied Statistics with S-PLUS. , (2013).
- Smith, B. H., Menzel, R. An Analysis of Variability in the Feeding Motor Program of the Honey Bee; the Role of Learning in Releasing a Modal Action Pattern. Ethology. 82 (1), 68-81 (1989).
- Smith, B. H. An analysis of blocking in odorant mixtures: an increase but not a decrease in intensity of reinforcement produces unblocking. Behavioral neuroscience. 111 (1), 57 (1997).
- . SwarmSight Antenna Tracking CSV files Available from: https://github.com/JustasB/SwarmSight/tree/master/Examples/Appendage%20Tracking/Birgiolas%20et.%20al.%20(2015) (2017)
- Kalman, R. E. A New Approach to Linear Filtering and Prediction Problems. J Basic Eng. 82 (1), 35-45 (1960).

