Un protocole pour la Production de vecteurs LENTIVIRAUX intégrase déficient pour CRISPR/Cas9-mediated Gene Knockout dans les cellules en Division
Summary
Nous décrivons la stratégie de production de vecteurs LENTIVIRAUX intégrase déficient (IDLVs) comme des véhicules de livraison CRISPR/Cas9 aux cellules. Avec une capacité de médiation rapide et robuste de gène d’édition dans les cellules, IDLVs présentent une plus sûre et plateforme vector tout aussi efficaces pour la livraison de gène par rapport aux vecteurs capables d’intégrase.
Abstract
Vecteurs LENTIVIRAUX sont un choix idéal pour la prestation des modules d’édition de gène aux cellules en raison de leur capacité pour stablement transduction une vaste gamme de cellules et de médiation de hauts niveaux d’expression de gène. Cependant, leur capacité à s’intégrer dans le génome de la cellule hôte augmente le risque de mutagénicité insertional soulève des questions de sécurité et limite leur utilisation en milieu clinique. En outre, l’expression persistante de gène-montage de composants livrés par ces hausses de vecteurs LENTIVIRAUX capables d’intégration (ICLVs) la probabilité de ciblage de gènes ubiquistes. Comme alternative, une nouvelle génération de vecteurs LENTIVIRAUX intégrase déficient (IDLVs) a été développée qui aborde un grand nombre de ces préoccupations. Le protocole de production d’une plateforme jusque nouvel et améliorée pour les gènes CRISPR montage et liste les étapes de la purification et de concentration de ces vecteurs est décrite ici transduction et leurs efficacité édition de gène à l’aide de HEK-293 t cellules a été démontrée. Ce protocole est facilement évolutif et peut être utilisé pour générer des IDLVs de titre élevé qui sont capables de faire des cellules in vitro et in vivo. En outre, le présent protocole peut être facilement adapté pour la production de ICLVs.
Introduction
Gène précis édition constitue la pierre angulaire des grandes avancées biomédicales qui impliquent le développement de nouvelles stratégies pour lutter contre les maladies génétiques. À l’avant-garde des technologies de modification génétique est la méthode en s’appuyant sur l’utilisation de la clustered regularly –jenterspaced short palindromic repeats (CRISPR) / système de Cas9 qui a été initialement identifié dans le cadre de l’immunité contre l’invasion virale matériel génétique (révisé dans les références1,2) bactérienne. Un avantage majeur du système CRISPR/Cas9 autres gène-montage des outils, tels que les nucléases de doigt de zinc (ZFNs) et les nucléases d’effecteur comme activateur de transcription (TAPS) (révisés en référence3), est la relative simplicité de conception de plasmide et construction des composants de CRISPR — une caractéristique qui a alimenté l’expansion du gène-montage de quelques laboratoires spécialisés à une communauté de recherche beaucoup plus large. En outre, la simplicité de programmation CRISPR/Cas9 et sa capacité de reconnaissance de cible multiplexé ont alimenté plus sa popularité comme une technologie rentable et facile à utiliser. Parmi les diverses méthodes disponibles aux chercheurs de livrer ces composantes de l’édition de gène aux cellules, vecteurs viraux demeurent de loin le plus populaire et efficace système.
Vecteurs LENTIVIRAUX (LVs) sont apparus comme le véhicule de choix pour fournir les composants de CRISPR/Cas9 système in vivo pour diverses applications4,5,6,7. Les principales fonctionnalités font LVs un choix populaire pour ce processus, y compris leur capacité à infecter des cellules en division et non de division, faible immunogénicité tant minime toxicité cellulaire (revu en référence8). Ainsi, la thérapie génique induite par le LV a été employée dans le traitement de maladies infectieuses comme le VIH-1 et HSV-1, HBV, ainsi que dans la correction des défauts sous-jacents des maladies héréditaires humaines, telles que la fibrose kystique et la dégénérescence maculaire neo-vasculaire 4 , 5 , 7 , 9 , 10 , 11. par ailleurs, LVs ont été effectivement modifiées pour effectuer des retouches de gène multiplex locus génomiques distincts à l’aide d’un vecteur unique système12.
Cependant, la propriété inhérente de LVs à intégrer dans le génome hôte peut être mutagène et handicape souvent leur utilité comme vecteurs de transgène, notamment dans les milieux cliniques. En outre, depuis intégrée de façon stable LVs expriment leur transgènes durablement élevés, ce système est inadapté pour la livraison de gène-montage de composants tels que les CRISPR/Cas9 ; la surexpression de l’ARN Cas9-guide (gRNA) et des protéines semblables tels que ZFNs, sont associées à des niveaux élevés d’effets hors cible, incluent des mutations indésirables13,14,15,16 , 17 et peut potentiellement améliorer la cytotoxicité18. Par conséquent, pour atteindre précis édition de gène avec des effets minimes hors cible, il est impératif de concevoir des systèmes qui permettent l’expression transitoire du gène montage des composants.
Ces dernières années, une variété de plates-formes de diffusion ont été développés pour exprimer transitoirement CRISPR/Cas9 dans cellules16,19,20,21 (revu en référence22). Il s’agit de méthodes qui dépendent directement introduire Cas9 purifiée ainsi que le guide approprié ARN dans des cellules, qui s’est avéré plus efficace à l’édition de gène ciblé par rapport à médiation plasmidique transfection16. Des études ont démontré que la ribonucléoprotéine (RNP) complexes comprenant guident RNA/Cas9 particules sont rapidement remis après médiation de clivage de l’ADN à leurs cibles, ce qui suggère que l’expression à court terme de ces composants est suffisante pour atteindre gène robuste édition16. En théorie, sans intégration des plates-formes de vecteurs viraux tels que les vecteurs viraux adéno-associés (AAVs) peuvent fournir une alternative viable pour livrer les machines édition de gène aux cellules. Malheureusement, les capsides AAV possèdent significativement plus faible capacité de l’emballage que LVs (< 5 Ko), qui entrave gravement leur aptitude pour empaqueter le toolkit CRISPR multicomposants au sein d’un unique vecteur (revu en référence8). Il est à noter qu’ajout de composés qui inhibent les histones désacétylases (p. ex., le butyrate de sodium23) ou entraver le cycle cellulaire (p. ex., caféine24) ont été montré pour augmenter des titres des gènes. Malgré les progrès récents, les systèmes d’expression transitoire développés jusque sont encore entravés par plusieurs défauts, tels que l’efficacité de la production plus faible, conduisant à des titres viraux réduits et efficacité faible transduction des vicitimes du virus ces approches25.
Vecteurs LENTIVIRAUX intégrase déficient (IDLVs) représentent une avancée majeure dans le développement de véhicules de livraison-gène, car ils combinent la capacité de l’emballage de LVs avec l’avantage supplémentaire d’entretien épisomiques AAV-comme dans les cellules. Ces fonctionnalités permettent IDLVs de contourner en grande partie les principaux enjeux rattachés à l’intégration des vecteurs, surexpression continue vis-àvis des éléments potentiellement génotoxiques et mutagénicité induite par l’intégration. Il a été précédemment démontré que IDLVs peuvent être modifiées avec succès pour améliorer l’expression de gène épisomiques26,27. En ce qui concerne la livraison de médiation jusque CRISPR/Cas9, titres de production faible et plus faible expression des génomes épisomes-la charge par rapport aux systèmes des gènes intégrase-proficient limite leur utilité comme outils de bona fide pour la livraison du génome-montage constructions transgéniques. Nous avons récemment démontré que transgene expression tant des titres viraux associés à production jusque sont considérablement renforcés par l’inclusion de sites pour le facteur de transcription Sp1 dans l’expression virale cassette28de liaison. Les IDLVs mis à jour le fermement appuyé gènes CRISPR édition aussi bien in vitro (dans les cellules HEK-293 t) et in vivo (dans les neurones du cerveau post-mitotiques), tout en induisant des mutations hors cible minimales par rapport à la médiation ICLV correspondant 28de systèmes. Dans l’ensemble, nous avons développé un roman, compact, tout-en-un toolkit CRISPR exploite une plateforme jusqu’et décrit les divers avantages d’utiliser un tel véhicule de livraison pour l’édition de gène amélioré.
Ici, le protocole de production du système jusque-CRISPR/Cas9 est décrit, y compris les différentes étapes impliquées dans l’Assemblée, purification, concentration et titrage de IDLVs, ainsi que des stratégies pour valider l’efficacité de gène-édition de ces vecteurs. Ce protocole est facilement évolutif pour répondre aux besoins des différents enquêteurs et est conçu pour générer avec succès les vecteurs LV avec des titres dans l’ordre de 1 x 1010 unités (TU) de transduction / mL. Les vecteurs des vicitimes du présent protocole peuvent être utilisés pour infecter efficacement plusieurs types de cellules différentes, y compris de difficile-à-transduce les cellules souches embryonnaires, les cellules hématopoïétiques (les cellules T et les macrophages) et mis en culture et en vivo– neurones injectés. En outre, le protocole est également bien adapté pour la production de vecteurs LENTIVIRAUX intégrase-compétente en quantités similaires.
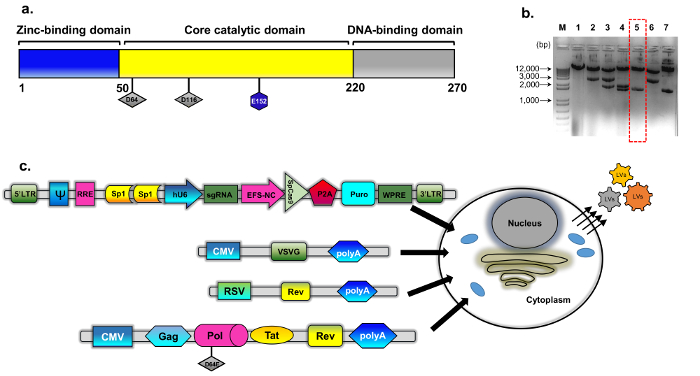
Figure 1 : emballage jusque. (a) schéma du type sauvage intégrase protéine (b) le plasmide modifié a été dérivé de psPAX2 (voir méthodologie, construction plasmidique pour plus de détails). Image de gel d’agarose représentant des clones sélectionnés pour les clones de l’intégrase muté. Des échantillons d’ADN préparés à l’aide d’un mini-kit isolement ADN plasmidique standard ont été analysés par digestion avec EcoRV et SphI. Le clone correctement digérés (numéro 5, boîte rouge en pointillés) a été davantage vérifié par séquençage direct (Sanger) pour la substitution de D64E en INT. La cassette de l’intégrase déficients en emballage s’appelait pBK43. (c) schéma du protocole de transfection transitoire utilisées pour générer des vecteurs jusque-CRISPR/Cas9, montrant des cellules 293 t transfectées avec VSV-G, emballage et cassettes transgène (Sp1-CRISPR/Cas9 tout-en-un plasmide). Les particules virales qui bourgeonnent en dehors de la membrane cellulaire contiennent l’ARN pleine longueur du vecteur (exprimé de la cassette du transgène). La deuxième génération du système d’emballage jusqu’a été utilisée, qui comprend les protéines régulatrices Tat et expression Rev Rev. est complétée d’une cassette séparée (RSV-REV-plasmide). ABBREV: virus de répéter, VSV-G, la stomatite vésiculeuse LTR-Long-terminal G-protéine, promoteur du CMVp-cytomégalovirus ; Promoteur de sarcome de Rous de virus (VRS) ; RRE-(élément de réponse de Rev). Autres éléments régulateurs sur la cassette d’expression comprennent des sites de liaison du Sp1, élément Rev Response (RRE), Woodchuck Hepatitis Virus post-transcriptionnel réglementation élément (WPRE), un promoteur de 1α facteur core-élongation (EFS-NC), l’emballage de vecteur élément ψ (lb/po2), promoteur de cytomégalovirus (hCMV) humain et humain promoteur U6. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Protocol
Representative Results
Discussion
IDLVs ont commencé à émerger en tant que véhicule de choix pour l’in vivo gene-édition, en particulier dans le contexte des maladies génétiques, due en grande partie au faible risque de mutagenèse associée à ces vecteurs par rapport à l’intégration de plateformes de livraison22 , 28. dans le manuscrit actuel, nous avons cherché à détailler le protocole lié à la production de l’all-in-one jusque-CRISPR/Cas9 système amélioré qui a…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Nous tenons à remercier le département de neurobiologie, Duke University School of Medicine et Décanat en sciences fondamentales, Université Duke. Nous remercions également les membres du noyau Duke vecteur Viral pour commentaires sur le manuscrit. Plasmide pLenti CRISPRv2 était le cadeau de Feng Zhang (Broad Institute). Le système de LV-emballage, y compris le psPAX2 de plasmides, VSV-G, pMD2.G et pRSV-Rev était un gentil cadeau de Didier Trono (EPFL, Suisse). Soutien financier à ce travail a été fourni par l’Université d’école de médecine en Caroline du Sud, accorder RDF18080-E202 (BA).
Materials
| Equipment | |||
| Optima XPN-80 Ultracentrifuge | Beckman Coulter | A99839 | |
| Allegra 25R tabletop centrifuge | Beckman Coulter | 369434 | |
| xMark Microplate Absorbance plate reader | Bio-Rad | 1681150 | |
| BD FACS | Becton Dickinson | 338960 | |
| Inverted fluorescence microscope | Leica | DM IRB2 | |
| 0.45-μm filter unit, 500mL | Corning | 430773 | |
| Conical bottom ultracentrifugation tubes | Seton Scientific | 5067 | |
| Conical tube adapters | Seton Scientific | PN 4230 | |
| SW32Ti swinging-bucket rotor | Beckman Coulter | 369650 | |
| 15 mL conical centrifuge tubes | Corning | 430791 | |
| 50mL conical centrifuge tubes | Corning | 430291 | |
| High-binding 96-well plates | Corning | 3366 | |
| 150 mm TC-Treated Cell Culture dishes with 20 mm Grid | Corning | 353025 | |
| 100mm TC-Treated Culture Dish | Corning | 430167 | |
| 0.22 μM filter unit, 1L | Corning | 430513 | |
| QIAprep Spin Miniprep Kit (50) | Qiagen | 27104 | |
| Tissue culture pipettes, 5 mL | Corning | 4487 | |
| Tissue culture pipettes, 10 mL | Corning | 4488 | |
| Tissue culture pipettes, 25 mL | Corning | 4489 | |
| Hemacytometer with cover slips | Cole-Parmer | UX-79001-00 | |
| Name | Company | Catalog Number | Comments |
| Cell culture reagents | |||
| Human embryonic kidney 293T (HEK 293T) cells | ATCC | CRL-3216 | |
| 293FT cells | Thermo Fisher Scientific | R70007 | |
| DMEM, high glucose media | Gibco | 11965 | |
| Cosmic Calf Serum | Hyclone | SH30087.04 | |
| Antibiotic-antimycotic solution, 100X | Sigma Aldrich | A5955-100ML | |
| Sodium pyruvate | Sigma Aldrich | S8636-100ML | |
| Non-Essential Amino Acid (NEAA) | Hyclone | SH30087.04 | |
| RPMI 1640 media | Thermo Fisher Scientific | 11875-085 | |
| GlutaMAX | Thermo Fisher Scientific | 35050061 | |
| Trypsin-EDTA 0.05% | Gibco | 25300054 | |
| BES (N, N-bis (2-hydroxyethyl)-2-amino-ethanesulfonic acid) | Sigma Aldrich | B9879 – BES | |
| Gelatin | Sigma Aldrich | G1800-100G | |
| Name | Company | Catalog Number | Comments |
| p24 ELISA reagents | |||
| Monoclonal anti-p24 antibody | NIH AIDS Research and Reference Reagent Program | 3537 | |
| HIV-1 standards | NIH AIDS Research and Reference Reagent Program | SP968F | |
| Polyclonal rabbit anti-p24 antibody | NIH AIDS Research and Reference Reagent Program | SP451T | |
| Goat anti-rabbit horseradish peroxidase IgG | Sigma Aldrich | 12-348 | Working concentration 1:1500 |
| Normal mouse serum, Sterile, 500mL | Equitech-Bio | SM30-0500 | |
| Goat serum, Sterile, 10mL | Sigma | G9023 | Working concentration 1:1000 |
| TMB peroxidase substrate | KPL | 5120-0076 | Working concentration 1:10,000 |
| Name | Company | Catalog Number | Comments |
| Plasmids | |||
| psPAX2 | Addgene | 12260 | |
| pMD2.G | Addgene | 12259 | |
| pRSV-Rev | Addgene | 12253 | |
| lentiCRISPR v2 | Addgene | 52961 | |
| Name | Company | Catalog Number | Comments |
| Restriction enzymes | |||
| BsrGI | New England Biolabs | R0575S | |
| BsmBI | New England Biolabs | R0580S | |
| EcoRV | New England Biolabs | R0195S | |
| KpnI | New England Biolabs | R0142S | |
| PacI | New England Biolabs | R0547S | |
| SphI | New England Biolabs | R0182S |
References
- Horvath, P., Barrangou, R. CRISPR/Cas, the immune system of bacteria and archaea. Science. 327 (5962), 167-170 (2010).
- Marraffini, L. A., Sontheimer, E. J. CRISPR interference: RNA-directed adaptive immunity in bacteria and archaea. Nat Rev Genet. 11 (3), 181-190 (2010).
- Kim, H., Kim, J. S. A guide to genome engineering with programmable nucleases. Nat Rev Genet. 15 (5), 321-334 (2014).
- Bellec, J., et al. CFTR inactivation by lentiviral vector-mediated RNA interference and CRISPR-Cas9 genome editing in human airway epithelial cells. Curr Gene Ther. 15 (5), 447-459 (2015).
- Kennedy, E. M., et al. Suppression of hepatitis B virus DNA accumulation in chronically infected cells using a bacterial CRISPR/Cas RNA-guided DNA endonuclease. Virology. 476, 196-205 (2015).
- Roehm, P. C., et al. Inhibition of HSV-1 Replication by Gene Editing Strategy. Sci Rep. 6, 23146 (2016).
- Wang, W., et al. CCR5 gene disruption via lentiviral vectors expressing Cas9 and single guided RNA renders cells resistant to HIV-1 infection. PLoS One. 9 (12), e115987 (2014).
- Kantor, B., Bailey, R. M., Wimberly, K., Kalburgi, S. N., Gray, S. J. Methods for gene transfer to the central nervous system. Adv Genet. 87, 125-197 (2014).
- Lebbink, R. J., et al. A combinational CRISPR/Cas9 gene-editing approach can halt HIV replication and prevent viral escape. Sci Rep. 7, 41968 (2017).
- Xu, L., et al. CRISPR/Cas9-Mediated CCR5 Ablation in Human Hematopoietic Stem/Progenitor Cells Confers HIV-1 Resistance In Vivo. Mol Ther. , (2017).
- Yiu, G., Tieu, E., Nguyen, A. T., Wong, B., Smit-McBride, Z. Genomic Disruption of VEGF-A Expression in Human Retinal Pigment Epithelial Cells Using CRISPR-Cas9 Endonuclease. Invest Ophthalmol Vis Sci. 57 (13), 5490-5497 (2016).
- Kabadi, A. M., Ousterout, D. G., Hilton, I. B., Gersbach, C. A. Multiplex CRISPR/Cas9-based genome engineering from a single lentiviral vector. Nucleic Acids Res. 42 (19), e147 (2014).
- Fu, Y., Sander, J. D., Reyon, D., Cascio, V. M., Joung, J. K. Improving CRISPR-Cas nuclease specificity using truncated guide RNAs. Nat Biotechnol. 32 (3), 279-284 (2014).
- Hsu, P. D., et al. DNA targeting specificity of RNA-guided Cas9 nucleases. Nat Biotechnol. 31 (9), 827-832 (2013).
- Kim, S., Kim, D., Cho, S. W., Kim, J., Kim, J. S. Highly efficient RNA-guided genome editing in human cells via delivery of purified Cas9 ribonucleoproteins. Genome Res. 24 (6), 1012-1019 (2014).
- Pattanayak, V., et al. High-throughput profiling of off-target DNA cleavage reveals RNA-programmed Cas9 nuclease specificity. Nat Biotechnol. 31 (9), 839-843 (2013).
- Shalem, O., et al. Genome-scale CRISPR-Cas9 knockout screening in human cells. Science. 343 (6166), 84-87 (2014).
- Schaefer, K. A., et al. Unexpected mutations after CRISPR-Cas9 editing in vivo. Nat Methods. 14 (6), 547-548 (2017).
- Choi, J. G., et al. Lentivirus pre-packed with Cas9 protein for safer gene editing. Gene Ther. 23 (7), 627-633 (2016).
- Platt, R. J., et al. CRISPR-Cas9 knockin mice for genome editing and cancer modeling. Cell. 159 (2), 440-455 (2014).
- Truong, D. J., et al. Development of an intein-mediated split-Cas9 system for gene therapy. Nucleic Acids Res. 43 (13), 6450-6458 (2015).
- Nelson, C. E., Gersbach, C. A. Engineering Delivery Vehicles for Genome Editing. Annu Rev Chem Biomol Eng. 7, 637-662 (2016).
- Jaalouk, D. E., Crosato, M., Brodt, P., Galipeau, J. Inhibition of histone deacetylation in 293GPG packaging cell line improves the production of self-inactivating MLV-derived retroviral vectors. Virol J. 3, 27 (2006).
- Ellis, B. L., Potts, P. R., Porteus, M. H. Creating higher titer lentivirus with caffeine. Hum Gene Ther. 22 (1), 93-100 (2011).
- Hoban, M. D., et al. Delivery of Genome Editing Reagents to Hematopoietic Stem/Progenitor Cells. Curr Protoc Stem Cell Biol. 36, 1-10 (2016).
- Bayer, M., et al. A large U3 deletion causes increased in vivo expression from a nonintegrating lentiviral vector. Mol Ther. 16 (12), 1968-1976 (2008).
- Kantor, B., Ma, H., Webster-Cyriaque, J., Monahan, P. E., Kafri, T. Epigenetic activation of unintegrated HIV-1 genomes by gut-associated short chain fatty acids and its implications for HIV infection. Proc Natl Acad Sci U S A. 106 (44), 18786-18791 (2009).
- Ortinski, P. I., O’Donovan, B., Dong, X., Kantor, B. Integrase-Deficient Lentiviral Vector as an All-in-One Platform for Highly Efficient CRISPR/Cas9-Mediated Gene Editing. Mol Ther Methods Clin Dev. 5, 153-164 (2017).
- Kantor, B., et al. Notable reduction in illegitimate integration mediated by a PPT-deleted, nonintegrating lentiviral vector. Mol Ther. 19 (3), 547-556 (2011).
- Berkhout, B., Verhoef, K., van Wamel, J. L., Back, N. K. Genetic instability of live, attenuated human immunodeficiency virus type 1 vaccine strains. J Virol. 73 (2), 1138-1145 (1999).
- Gomez-Gonzalo, M., et al. The hepatitis B virus X protein induces HIV-1 replication and transcription in synergy with T-cell activation signals: functional roles of NF-kappaB/NF-AT and SP1-binding sites in the HIV-1 long terminal repeat promoter. J Biol Chem. 276 (38), 35435-35443 (2001).
- Kim, Y. S., et al. Artificial zinc finger fusions targeting Sp1-binding sites and the trans-activator-responsive element potently repress transcription and replication of HIV-1. J Biol Chem. 280 (22), 21545-21552 (2005).
- Ortinski, P. I., Lu, C., Takagaki, K., Fu, Z., Vicini, S. Expression of distinct alpha subunits of GABAA receptor regulates inhibitory synaptic strength. J Neurophysiol. 92 (3), 1718-1727 (2004).
- Van Lint, C., et al. Transcription factor binding sites downstream of the human immunodeficiency virus type 1 transcription start site are important for virus infectivity. J Virol. 71 (8), 6113-6127 (1997).
- Van Lint, C., Ghysdael, J., Paras, P., Burny, A., Verdin, E. A transcriptional regulatory element is associated with a nuclease-hypersensitive site in the pol gene of human immunodeficiency virus type 1. J Virol. 68 (4), 2632-2648 (1994).
- Xu, W., Russ, J. L., Eiden, M. V. Evaluation of residual promoter activity in gamma-retroviral self-inactivating (SIN) vectors. Mol Ther. 20 (1), 84-90 (2012).
- . Testing for Replication Competent Retrovirus (RCR)/Lentivirus (RCL) in Retroviral and Lentiviral Vector Based Gene Therapy Products – Revisiting Current FDA Recommendations Available from: https://sites.duke.edu/dvvc/files/2016/05/FDA-recommendation-for-RCR-testing.pdf (2017)
- . Biosafety in Microbiological and Biomedical Laboratories Available from: https://www.cdc.gov/biosafety/publications/bmbl5/bmbl.pdf (2017)
- Dull, T., et al. A third-generation lentivirus vector with a conditional packaging system. J Virol. 72 (11), 8463-8471 (1998).
- Liu, X. S., et al. Editing DNA Methylation in the Mammalian Genome. Cell. 167 (1), 233-247 (2016).
- Ran, F. A., et al. In vivo genome editing using Staphylococcus aureus Cas9. Nature. 520 (7546), 186-191 (2015).
- Zetsche, B., et al. Cpf1 is a single RNA-guided endonuclease of a class 2 CRISPR-Cas system. Cell. 163 (3), 759-771 (2015).

