Procedimiento optimizado para la determinación de la adsorción de los fosfonatos en hidróxido férrico Granular utilizando un método de determinación de fósforo miniaturizados
Summary
Este trabajo presenta un procedimiento para investigar la adsorción de los fosfonatos en materiales filtrantes que contienen hierro, hidróxido férrico particularmente granular, con poco esfuerzo y alta confiabilidad. En una solución tamponada, el fosfonato es traído en contacto con el adsorbente utilizando un agitador y analiza a través de un método de determinación de fósforo miniaturizados.
Abstract
Este trabajo presenta un procedimiento para investigar la adsorción de los fosfonatos en materiales filtrantes que contienen hierro, hidróxido férrico particularmente granular (GFH), con poco esfuerzo y alta confiabilidad. El fosfonato, por ejemplo, nitrilotrimethylphosphonic ácido (NTMP), se pone en contacto con el GFH en un rotor en una solución tamponada con un ácido orgánico (p. ej., ácido acético) o un buen almacenador intermediario (por ejemplo, 2-(N– morfolino) ácido (n-2-hidroxietilpiperazina-N’-2-ácido) [MES] y N– cyclohexyl-2-hidroxil-3-aminopropanesulfonic ácido [CAPSO]) en una concentración de 10 mM para un momento concreto en tubos de centrífuga de 50 mL. Posteriormente, después de la filtración de membrana (0,45 μm tamaño del poro), la total concentración de fósforo (P total) se mide utilizando un método de determinación específicamente desarrollados (ISOmini). Este método es una modificación y simplificación del método ISO 6878: una muestra de 4 mL con H2para4 y K2S2O8 en un tapón del frasco, calienta a 148-150 ° C por 1 h y luego se mezcla con NaOH , ácido ascórbico y el molibdato acidificado con oxidotartrato (volumen final de 10 mL) para producir un complejo azul. La intensidad del color, que es linealmente proporcional a la concentración de fósforo, se mide espectrofotométricamente (880 nm). Está demostrado que la concentración de tampón utilizada no tiene ningún efecto significativo sobre la adsorción de fosfonato entre pH 4 y 12. Los amortiguadores, por lo tanto, no compiten con el fosfonato de sitios de adsorción. Además, la relativamente alta concentración de la memoria intermedia requiere una mayor concentración de la dosificación de agente oxidante (K2S2O8) para la digestión que la especificada en ISO 6878, que, junto con la dosis de NaOH, se en cada búfer. A pesar de la simplificación, el método demini ISO no pierde ninguna de su exactitud en comparación con el método estandarizado.
Introduction
Motivación
Los esfuerzos para reducir los nutrientes en las aguas superficiales, que son necesarias, entre otras cosas, en el contexto de la aplicación de la Directiva marco del agua Europea1, requieren un examen más detallado de las emisiones de fósforo. El grupo de la sustancia de los fosfonatos (figura 1), que se utilizan como estabilizadores de blanqueo en las industrias textil y de papel, como antiincrustante para tratamiento de agua potable, como estabilizadores de la dureza del agua de enfriamiento y en detergentes y productos de limpieza, es particularmente relevante en términos de cantidad y relevancia ambiental2. Los fosfonatos son sospechosos de contribuir a la eutrofización a largo plazo de cuerpos de agua2,3,4. Por ejemplo, debido a la radiación UV del sol o en presencia de MnII y oxígeno disuelto, los fosfonatos pueden ser degradados en fosfatos microbiológicamente disponibles5,6. El exceso de fosfato es una característica esencial de los cuerpos de agua ecológicamente desequilibrada, que hace el fósforo sustancia objetivo importante para la mejora sostenible de la situación ecológica de los cuerpos de agua.
Fosfonatos pueden eliminarse de las aguas residuales precipitación/floculación cuando usando hierro o aluminio sales7,8,9,10. En este proceso, los metales se transforman en hidróxidos de metal difícilmente solubles. Estos rebaños polar con una relativamente grande superficie específica sirven como adsorbentes para fosfonatos cargados negativamente. Sin embargo, el proceso de floculación puede tener dos inconvenientes principales. Dependiendo de las aguas residuales, volúmenes de lodo de hasta un 30% del volumen de muestra pueden ocurrir11. Este lodo debe ser separados, tratados y eliminados en una etapa de filtro o posterior sedimentación. Además, los fosfonatos pueden complejo los Floculantes añadidos y así evitan la formación de rebaños, sobre todo en aguas con baja dureza. Este efecto puede ser compensado por mayores cantidades de floculante. Sin embargo, esto lleva a valores de mayor β (β = fracción molar de floculante al fósforo en aguas residuales)11,12. Una matriz compleja de aguas residuales, por lo tanto, puede complicar el control de una dosis óptima de floculante.
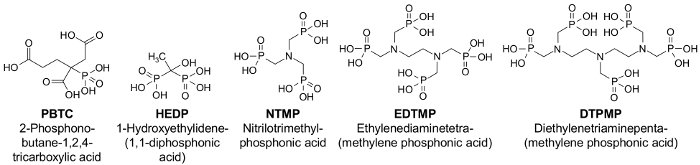
Figura 1: fórmulas estructurales de los fosfonatos importante11. Haga clic aquí para ver una versión más grande de esta figura.
Una posible alternativa que aprovecha la afinidad de adsorción alta de fosfonatos a las superficies que contienen metal y que no tiene el mencionado desventajas son filtro materiales basados en óxidos de hierro (hidr). De dicho material de filtro, la literatura presenta principalmente las investigaciones sobre la eliminación de fosfato13,14,15,16. Este trabajo presenta un procedimiento que permite la investigación de la capacidad de adsorción de los materiales de filtro selectivo de granulado, en este trabajo en particular con hidróxido férrico granular (GFH), con respecto a los fosfonatos con poca carga de trabajo y significativo ahorro de costes. El estudio de la capacidad de adsorción se puede dividir en los siguientes pasos: preparación de la solución de fosfonato, prueba de adsorción (contacto de la solución de fosfonato con el granulado) y análisis de fosfonato. Todas las medidas deberán estar perfectamente coordinadas.
Concepto para la prueba de adsorción y el uso de buffers adecuados
Para el estudio de capacidad de adsorción, pruebas por lotes o columna pueden llevarse a cabo. Para determinar las isotermas de adsorción o pH-dependencias de adsorbente, el enfoque de lote es preferible ya que muchos resultados pueden obtenerse en un período corto de tiempo por la posibilidad de variar varios parámetros. El valor del pH es uno de los factores más importantes que influyen en la adsorción. Cumplimiento o ajuste del valor de pH es un gran desafío para el técnico de laboratorio, como el simple ajuste del valor de pH en la solución de la muestra previamente al contacto con el adsorbente no suele ser suficiente. Cada material adsorbente generalmente se esfuerza por aproximar el pH alrededor de su punto de carga cero (PZC). Por consiguiente, es posible que una solución acuosa, por ejemplo, ajustada a pH 3, cambia a un valor de pH de 8 cuando en contacto inmediato con el adsorbente. Aguas residuales en su mayoría tiene una natural capacidad de almacenamiento en búfer, que atenúa este efecto. Si, sin embargo, sólo la eliminación de una sustancia objetivo particular debe investigarse con un adsorbente particular, se debe utilizar agua residual sintética, es decir, agua pura, que específicamente se enriquecieron con la sustancia objetivo o, por ejemplo, competitivo aniones. Por el contrario adsorbentes a en polvo, donde el valor de pH se puede mantener fácilmente en el rango deseado mediante la adición de ácidos y bases en el recipiente de agitación abierto, sin ajuste de pH en esta forma se pueden hacer en forma de lote con granulados. Para mantener gránulos homogéneamente suspendidos, velocidades de agitación muy elevadas se necesitan, que resultaría en muy rápida abrasión del material. Si tal abrasión es involuntaria, el método suave es girar los tubos de centrífuga cerrada para evitar que los gránulos mezclados continuamente en la solución. La única manera de mantener el pH constante en este caso es usar tampones.
Deben cumplir los siguientes requisitos para los búferes para poder investigar la adsorción de fosfatos y fosfonatos en materiales filtrantes que contienen hierro: libre de fósforo; descolorido; soluble; en el mejor, sin agentes complejantes; no hay competencia con fosfonatos sobre adsorción sobre materiales del filtro polar; estructura similar de los diferentes buffers utilizados; y tampones o sus productos de degradación no deben tener un efecto negativo sobre la absorbancia espectral del color complejo después de la digestión para la determinación de P total. Para el campo de la investigación bioquímica, supuestos buenos almacenadores intermediarios eran desarrollados17,18,19, que tienen exactamente estas propiedades. Así, para las investigaciones de este trabajo, se seleccionaron los buffers en la tabla 1 . El pK el valor cada búfer indica el rango que se puede mantener constante por el búfer. Para el rango de pH < 5, sin embargo, ácidos orgánicos como el ácido cítrico (CitOH) y ácido acético (AcOH) deben usarse. El ácido cítrico es un agente complejante, pero almacena en un rango de pH donde más hierro-que contienen filtro materiales se convierten en inestables de todas formas. Ácido acético y fregonas fueron utilizadas ya por Nowack y piedra7 investigar la adsorción de NTMP sobre Goethita de mezcla (α-FeOOH) a pH 4.6 y 7.2. Sin embargo, sus experimentos en la dependencia de pH de adsorción ocurrieron sin almacenamiento en búfer.
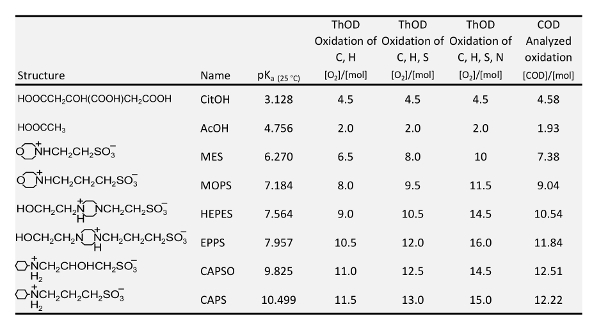
Tabla 1: pK un valores 20 , demanda teórica de oxígeno (DTO) y analizada real demanda química de oxígeno (DQO) de tampones utilizados en este estudio.
Determinación del P total (ISOmini) adaptado a la solución tampón
Después de cada prueba de adsorción, cada solución debe ser analizado para determinar la concentración residual de fosfonato. Recientemente, se introdujo un método para la determinación de los fosfonatos en muestras ambientales con los límites de cuantificación en la gama de 0.1 μg/L. Se basa en el método de IC-ICP-MS y el uso de intercambiadores de cationes (para la conversión de los fosfonatos en ácidos fosfónicos «libres») y aniones intercambiadores de calor (para la concentración previa de los fosfonatos)21. Además, ya en 1997 un método de Nowack22 fue introducido con límites más altos de detección de 15-100 μg/L, que se basa en la pre-complejación de fosfonatos con FeIII, retención con HPLC y detección fotométrica de estos complejos. Sin embargo, estos métodos son muy lentos y costosos. En estudios con aguas residuales sintéticas en las que el único compuesto que contiene fósforo es un fosfonato, es suficiente para determinar la concentración de fosfonato determinando la concentración total de P. La determinación de fosfato inorgánico presenta al experimentador con muchos menos problemas que la determinación del P total, ya que este último requiere digestión previa. La cantidad de químicos que hay que añadir anulan debe coincidir precisamente con los compuestos presentes en la muestra.
La determinación de fosfato en la actualidad se realiza usando principalmente el método introducido por Murphy y Riley23. Este método se basa en la detección espectrofotométrica de un azul intenso color phosphomolybdenum complejo ([PSb2Mo12O40]− con λmax a 880 nm) que se forma en presencia de fosfato y molibdato acidificado con ácido ascórbico y oxidotartrato como agentes reductores24. En otros estudios, la relación óptima de [H+]: [Mo] fue determinada para ser 60-8025,26. Para determinar P total, la digestión, es decir, la ruptura del P-O-P, C-O-P y C P bonos contiene fósforo en compuestos y la oxidación de fósforo fosfato debe llevarse a cabo antes de la formación de azul de phosphomolybdenum24 . EISENREICH et al. 27 presentó un método simplificado basado en el uso del peroxodisulfato de agente oxidante (K2S2O8) en el medio ácido. Muchos de estos hallazgos se han incorporado en el desarrollo de ISO 687828, que explica sistemáticamente el procedimiento para la determinación de fosfato P y concentraciones de P total en muestras de agua (aguas residuales y agua de mar).
La determinación del P total según ISO 6878 (figura 2) requiere la muestra para ser digerido en un matraz de Erlenmeyer por K2S2O8 a un pH ácido (uso de ácido sulfúrico) para por lo menos 30 minutos. Después de la digestión, el valor de pH se establece en 3-10 utilizando NaOH y el contenido de lo Erlenmeyer matraz se transfiere a un matraz aforado de 50 mL. En este frasco, ácido ascórbico y una solución ácida que contiene molibdato y antimonio son añadidos a la muestra y luego con agua. Después de 10-30 minutos, se mide la intensidad de esta coloración azul a una longitud de onda de 880 nm. En el caso de la determinación de fosfato, se omite la digestión. Esto significa que la muestra se mezcla en un matraz aforado de 50 mL con ácido ascórbico y una solución que contiene molibdato así como antimonio, y se mide la intensidad de la coloración azul en el fotómetro.
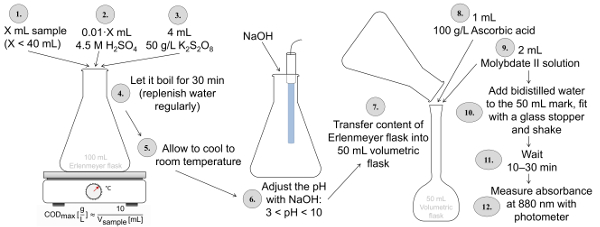
Figura 2 : Procedimiento de determinación del P total según ISO 6878 aplicando digestión con ácido sulfúrico y Potasio peroxodisulfato, un ajuste del pH posterior coloración con ácido ascórbico y que contiene molibdato y NaOH soluciones. Haga clic aquí para ver una versión más grande de esta figura.
El procedimiento de determinación de P total es muy complejo ya que durante la digestión que se debe siempre ser atendido no desborde la muestra y el ajuste de la muestra a pH 3-10 lleva mucho tiempo. Con el fin de ser capaces de analizar tantas muestras como sea posible en un tiempo muy corto, una forma miniaturizada del P total y determinación de Orto fosfato fue desarrollada basándose en este método ISO. Figura 3 resume los pasos individuales de este método. En este método de determinación miniaturizados (ISOmini), el volumen final de la solución de color es de 10 mL (en el método de la ISO, se trata de 50 mL). Por consiguiente, el método demini ISO reduce la cantidad de las soluciones que se utilizarán para la quinta parte. En el método demini ISO, se lleva a cabo la digestión en un termostato (en contraste con el método ISO, donde la digestión se propone en un matraz de Erlenmeyer sobre una plancha) en 148-150 ° C para obtener la mayor oxidación posible. NaOH es añadido después de la digestión junto con la solución ácida de molibdato y ácido ascórbico.
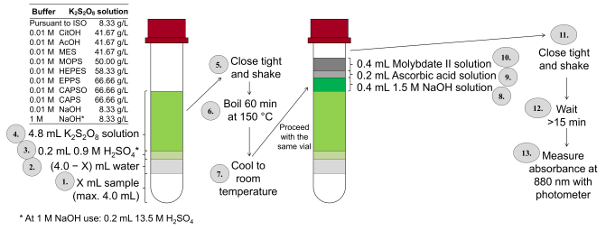
Figura 3 : Procedimiento de determinación del P total según una forma modificada y miniaturizada de ISO 6878 (ISOmini) frascos de uso de tapón de rosca de 10 mL, concentraciones de potasio dependiente del búfer peroxodisulfato, calefacción en un termostato y adición de reactivos a la muestra digerida de color sin la transferencia previamente. Haga clic aquí para ver una versión más grande de esta figura.
Los buffers orgánicos contenidos en las muestras deben estar presentes en concentraciones relativamente altas (10 mM) en comparación con el fosfonato (5-30 μm) para mantener el pH efectivamente. Estos buffers deben ser digeridas para el análisis de la P total después de la prueba de adsorción. Por consiguiente, la cantidad dosificada de agente oxidante debe coincidir con cada memoria intermedia, teniendo en cuenta que demasiado oxidante no debe interferir en la formación del complejo de color formada después de la digestión. Para poder estimar la K2S2O8 cantidad necesaria para la digestión de cada buffer en la determinación de P total basada en el análisis demanda química de oxígeno (DQO), una comparación de cuántos electrones puede convertirse durante el reducción de O2 y K2S2O8 es necesaria:
O2 + 4 H+ + 4 e– → 2 H2O
S2O82 – + 2 e– → 2 así42-
Así, la oxidación de una molécula particular requiere dos veces más moléculas de peroxodisulfato como moléculas de O2 . Por consiguiente, en el caso de un volumen de muestra de 20 mL, el bacalao de la muestra no debe exceder 500 mg/L cuando se utiliza el método ISO. Sin embargo, incluso en el caso del MES, el buen almacenador intermediario con la masa molar más pequeña de la tabla 1, un bacalao de 2,4 g/L está ya presente en una concentración de 10 mM. Además del protocolo paso a paso de la prueba de adsorción y métodomini ISO, este papel, por lo tanto, investiga la concentración del almacenador intermediario necesario, la influencia de los buffers en adsorción de fosfonato y K2S2O8 cantidad y dosis de NaOH requerido para su digestión en el método demini ISO.
Modelo de adsorción de Freundlich
Isotermas de adsorción, es decir, carga q (p. ej., en el adsorbente de P/g de mg) aplicado sobre el c concentración disuelto (en mg/L P) del adsorbente después de un tiempo de contacto específico, pueden ser modelados usando la ecuación propuesta por Freundlich29:
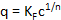
Si los valores obtenidos experimentalmente q y c se trazan en forma de una función ln(q) en ln(c), la pendiente de esta función determinada por regresión lineal corresponde a 1/n y el intercepto del eje y para el valor de KF 30.
Resumen del procedimiento
Todo el proceso para determinar la capacidad de adsorción de hidróxido férrico granular con respecto a los fosfonatos se divide en varios pasos y se describe en la sección de protocolo. Para el análisis, es necesario preparar una cantidad suficiente de reactivo de soluciones (sección 1 del Protocolo). Estas son duraderas durante varias semanas. Luego se prepara la solución de fosfonato que contienen (sección 2), seguido de la prueba de adsorción (contacto de la solución con el material granular de fosfonato) (sección 3) y el análisis de la P total según el método ISO miniaturizado (sección 4).
Protocol
Representative Results
Discussion
La importancia creciente de los fosfonatos requiere investigación de métodos confiables de la eliminación de estos compuestos de aguas residuales para proteger las plantas de tratamiento de aguas residuales o cuerpos de agua receptores. En la actualidad, ha realizado muy pocos estudios sobre la eliminación de los fosfonatos de aguas residuales industriales5,11,12,13,14,16. El procedimiento presentado aquí demuestra que las investigaciones sobre la eliminación de los fosfonatos por adsorción en polar óxido de hierro que contengan hidróxido férrico granular en particular, pueden ser llevado a cabo rápida y confiable cuando de acuerdo con la Protocolo dado.
El punto decisivo en la realización de estudios de la adsorción es el mantenimiento del valor de pH. Esto no puede hacerse en tubos de centrífuga de rotación sin usar un búfer. En este artículo, fue demostrado que buenos buffers permiten un ajuste de pH aceptables sólo en una concentración de 0.01 M e incluso a esta concentración no tienen ninguna influencia significativa sobre la adsorción de los fosfonatos a GFH. El uso de buffers buena es también la razón por qué el procedimiento aquí presentado no puede utilizarse para estudios de adsorción de fosfonatos en algo no-polar materiales tales como carbón activado. Buenos buffers competiría con fosfonatos gratis sitios de adsorción.
Puesto que el análisis directo de los fosfonatos mediante HPLC22 o21 de IC-ICP-MS es muy complejo y costoso, el método presentado sugiere que el fosfonato después del contacto con el adsorbente debe medirse indirectamente mediante la determinación el p total. Un método estandarizado (ISO 687828) se utiliza generalmente para la determinación de P total, en que se realiza una digestión hacia fuera por medio de H2tan4 y K2S2O8 sobre una placa, el valor de pH está entonces establecido en 3-10 por medio de NaOH y un complejo de color azul (la intensidad del color que es linealmente proporcional a la concentración de fosfato) se forma con la ayuda de solución de molibdato y ácido ascórbico. Este método estandarizado es muy trabajo y mucho tiempo, razón por la cual una variante rápida del método ISO (ISOmini) fue desarrollado. El método demini ISO reduce el volumen total a una quinta parte. La digestión lleva a cabo cómodamente en un termostato y la dosis de NaOH después de digestión es fija. Este método permite a un gran número de determinaciones de fósforo a llevarse a cabo dentro de muy poco tiempo y no comprometa la precisión en comparación con el método ISO.
Cada tampón tiene un bacalao diferentes. Además, la concentración relativamente alta de búfer necesario de 0.01 M significa que, para garantizar suficiente digestión de los componentes de la muestra, cantidades considerablemente mayores de agente oxidante deben ser dosificada que se estipula en el método ISO. Si la dosis de K2S2O8 es demasiado baja o demasiado alta, incorrecto ocurren resultados de medición. En el método demini ISO, esta dosis de K2S2O8 es así coincide con cada memoria intermedia individual. Otro punto crítico es la dosis de NaOH. Como regla general, soluciones de regeneración tienen concentraciones de > 0,1 M de NaOH. Para evitar que la+[H]: cociente [Mo] necesaria para la formación de los complejos25,color del26 no se adhiere a un ajuste adecuado de la H24 cantidad antes de la digestión es, por tanto, necesario. El problema surge cuando la solución de regeneración se reutiliza varias veces, cambiando así su valor de pH y el bacalao. Puesto que no es posible una medición de pH confiable y simple en frascos de tapón de rosca y no dispone de un ajuste de pH apropiado, el método demini ISO presentado aquí, así, alcanza sus límites para las muestras con valores de pH muy alto. Para soluciones de regeneración por lo tanto se recomienda utilizar el método ISO.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Los autores están agradecidos por el apoyo financiero por Willy-Hager-Stiftung, Stuttgart. También nos gustaría agradecer a los empleados de Zschimmer & Schwarz Mohsdorf GmbH & Co KG por proveer muestras de fosfonato.
Materials
| Sulfuric acid (H2SO4) | Merck (Darmstadt, Germany) | 1120802510 | 98% (p.a.) |
| Hydrochloric acid (HCl) | VWR Chemicals (Fontenay-sous-Bois, France) | 20254.401 | 32% (AnalaR NORMAPUR, p.a.) |
| Sodium hydroxide (NaOH) | Merck (Darmstadt, Germany) | 1064981000 | ≥99% (p.a.) |
| Citric acid monohydrate (CitOH∙OH) | VWR Chemicals (Fontenay-sous-Bois, France) | 20276.292 | 99.9% (AnalaR NORMAPUR, p.a.) |
| Acetic acid (AcOH) | VWR Chemicals (Fontenay-sous-Bois, France) | 20104.334 | 100% (p.a.) |
| 2-(N-morpholino)ethanesulfonic acid (MES) | SigmaAldrich (St. Louis, MO, USA) | M3671-250G | ≥99% |
| 3-(N-morpholino)propanesulfonic acid (MOPS) | SigmaAldrich (St. Louis, MO, USA) | M1254-250G | ≥99.5% |
| 4-(2-Hydroxyethyl)-1-piperazineethanesulfonic acid (HEPES) | SigmaAldrich (St. Louis, MO, USA) | H3375-250G | ≥99.5% |
| 4-(2-Hydroxyethyl)-1-piperazinepropanesulfonic acid (EPPS) | SigmaAldrich (St. Louis, MO, USA) | E9502-250G | ≥99.5% |
| N-cyclohexyl-2-hydroxyl-3-aminopropanesulfonic acid (CAPSO) | SigmaAldrich (St. Louis, MO, USA) | C2278-100G | ≥99% |
| N-cyclohexyl-3-aminopropanesulfonic acid (CAPS) | SigmaAldrich (St. Louis, MO, USA) | C2632-250G | ≥98% |
| 2-Phosphonobutane-1,2,4-tricarboxylic acid (PBTC) | Zschimmer & Schwarz (Mohsdorf, Germany) | CUBLEN P 50 | 50 % technical |
| 1-Hydroxyethane 1,1-diphosphonic acid monohydrate (HEDP·H2O) | SigmaAldrich (St. Louis, MO, USA) | 54342-50G | ≥95,0 % |
| Nitrilotris(methylene phosphonic acid) (NTMP) | SigmaAldrich (St. Louis, MO, USA) | 72568-50G | ≥97,0 % |
| Ethylenediamine tetra(methylene phosphonic acid) (EDTMP·1.4H2O) | Zschimmer & Schwarz (Mohsdorf, Germany) | – | |
| Diethylenetriamine penta(methylene phosphonic acid) (DTPMP·6H2O) | Zschimmer & Schwarz (Mohsdorf, Germany) | – | |
| Potassium dihydrogen phosphate (KH2PO4) | Merck (Darmstadt, Germany) | 1048731000 | ≥99.5% (p.a.) |
| Potassium peroxodisulfate (K2S2O8) | Merck (Darmstadt, Germany) | 1050920250 | ≥99.0% (p.a.) |
| L(+)-Ascorbic acid (C6H8O6) | Merck (Darmstadt, Germany) | 1004680500 | ≥99.7% (p.a.) |
| Ammonium heptamolybdate tetrahydrate ((NH4)6Mo7O24·4H2O) | Merck (Darmstadt, Germany) | 1011800250 | ≥99.0% (p.a.) |
| Potassium antimony-(III) oxide tartrate hemihydrate (K(SbO)C4H4O6∙½H2O) | Merck (Darmstadt, Germany) | 1080920250 | ≥99.5% (p.a.) |
| Granular ferric hydroxide (GFH) | Hego BioTec (Berlin, Germany) | – | FerroSorp RW |
| Syringe membrane filters | Sartorius Stedim Biotech GmbH (Göttingen, Germany) | 17765———-Q | Minisart RC Hydrophilic 25 mm 0.45 μm pore size |
| Single-use syringes for membrane filtration | Henke Sass Wolf (Tuttlingen, Germany) | 5200.X00V0 | 3-part Soft-Ject Luer 20 mL |
| Rotator | LLG Labware (Meckenheim, Germany) | 6.263 660 | uniROTATOR2 |
| Clamp for rotator | LLG Labware (Meckenheim, Germany) | 6.263 664 | Clamp for uniROTATOR2 |
| Screw cap vial | Glasgerätebau Ochs (Bovenden, Germany) | 135215 | Präparatenglas Duran, 16×100 mm, thread GL18, cap with PTFE seal |
| Micropipette | Eppendorf (Hamburg, Germany) | 3123000047 | eppendorf Research plus 10–100 µL |
| Micropipette | Eppendorf (Hamburg, Germany) | 3123000063 | eppendorf Research plus 100–1000 µL |
| Micropipette | Eppendorf (Hamburg, Germany) | 3123000071 | eppendorf Research plus 0.5–5 mL |
| Precision balance | Precisa Gravimetrics (Dietikon, Switzerland) | – | Precisa LX 220 A SCS |
| Thermostat | Hach (Berlin, Germany) | LTV077 | HT200S High Temperature Thermostat |
| Thermostat | Merck (Darmstadt, Germany) | 1712000001 | Spectroquant TR 320 |
| Spectrophotometer | Jasco Labor- u. Datentechnik (Groß-Umstadt, Germany) | – | UV/VIS Spectrophotometer Jasco V-550 |
| Centrifuge tube | Sarstedt (Nümbrecht, Germany) | 62.559.001 | Tube 50 mL, 115×28 mm, flat/conical base PP, assembled cap |
| pH probe | WTW (Weilheim, Germany) | 103635 | WTW pH-Electrode SenTix 41 |
| pH device | WTW (Weilheim, Germany) | – | WTW Multi 350i |
| COD determination | Hach (Berlin, Germany) | LCK514 | 100–2000 mg/L O2 |
| Sieve | Retsch (Haan, Germany) | 60.131.000500 | Test sieve 0.5 mm mesh (ISO 3310/1) stainless steel |
| Drying cabinet | Memmert (Schwabach, Germany) | – | Modell 600 |
References
- . Directive 2000/60/EC of the European Parliament and of the Council of 23 October 2000 establishing a framework for Community action in the field of water policy. Official Journal of the European Communities. , 327 (2000).
- Rott, E., Steinmetz, H., Metzger, J. W. Organophosphonates: A review on environmental relevance, biodegradability and removal in wastewater treatment plants. Science of the Total Environment. 615, 1176-1191 (2018).
- Grohmann, A., Der Horstmann, B. . Der Einsatz von Phosphonaten unter umwelttechnischen Gesichtspunkten (The use of phosphonates under environmental aspects). , (1989).
- Studnik, H., Liebsch, S., Forlani, G., Wieczorek, D., Kafarski, P., Lipok, J. Amino polyphosphonates-chemical features and practical uses, environmental durability and biodegradation. New Biotechnology. 32 (1), 1-6 (2015).
- Matthijs, E., de Oude, N. T., Bolte, M., Lemaire, J. Photodegradation of ferric ethylenediaminetetra(methylenephosphonic acid) (EDTMP) in aqueous solution. Water Research. 23 (7), 845-851 (1989).
- Nowack, B., Stone, A. T. Degradation of nitrilotris(methylenephosphonic acid) and related (amino)phosphonate chelating agents in the presence of manganese and molecular oxygen. Environmental Science & Technology. 34 (22), 4759-4765 (2000).
- Nowack, B., Stone, A. T. Adsorption of phosphonates onto goethite-water interface. J. Colloid Interface Science. 214 (1), 20-30 (1999).
- Nowack, B., Stone, A. T. The influence of metal ions on the adsorption of phosphonates onto goethite. Environmental Science & Technology. 33 (22), 3627-3633 (1999).
- Nowack, B., Stone, A. T. Competitive adsorption of phosphate and phosphonates onto goethite. Water Research. 40 (11), 2201-2209 (2006).
- Zenobi, M. C., Hein, L., Rueda, E. The effects of 1-hydroxyethane-(1,1-diphosphonic acid) on the adsorptive partitioning of metal ions onto γ-AlOOH. Journal of Colloid and Interface Science. 284 (2), 447-454 (2005).
- Rott, E., Minke, R., Steinmetz, H. Removal of phosphorus from phosphonate-loaded industrial wastewaters via precipitation/flocculation. Journal of Water Process Engineering. 17, 188-196 (2017).
- Klinger, J., Sacher, F., Brauch, H. J., Maier, D., Worch, E. Behaviour of phosphonic acids during drinking water treatment. Vom Wasser. 91, 15-27 (1998).
- Boels, L., Tervahauta, T., Witkamp, G. J. Adsorptive removal of nitrilotris(methylenephosphonic acid) antiscalant from membrane concentrates by iron-coated waste filtration sand. Journal of Hazardous Materials. 182 (1-3), 855-862 (2010).
- Boels, L., Keesman, K. J., Witkamp, G. J. Adsorption of phosphonate antiscalant from reverse osmosis membrane concentrate onto granular ferric hydroxide. Environmental Science & Technology. 46 (17), 9638-9645 (2012).
- Martínez, R. J., Farrell, J. Understanding Nitrilotris(methylenephosphonic acid) reactions with ferric hydroxide. Chemosphere. 175, 490-496 (2017).
- Chen, Y., Baygents, J. C., Farrell, J. Removing phosphonate antiscalants from membrane concentrate solutions using granular ferric hydroxide. Journal of Water Process Engineering. 19, 18-25 (2017).
- Good, N. E., Winget, G. D., Winter, W., Connolly, T. N., Izawa, S., Singh, R. M. M. Hydrogen ion buffers for biological research. Biochemistry. 5 (2), 467-477 (1966).
- Good, N. E., Izawa, S. Hydrogen ion buffers. Methods in Enzymology. 24, 53-68 (1972).
- Ferguson, W. J., et al. Hydrogen ion buffers for biological research. Analytical Biochemistry. 104 (2), 300-310 (1980).
- Goldberg, R. N., Kishore, N., Lennen, R. N. Thermodynamic quantities for the ionization reactions of buffers. Journal of Physical and Chemical Reference Data. 31 (2), 231-370 (2002).
- Schmidt, C. K., Raue, B., Brauch, H. J., Sacher, F. Trace-level analysis of phosphonates in environmental waters by ion chromatography and inductively coupled plasma mass spectrometry. International Journal of Environmental Analytical Chemistry. 94 (4), 385-398 (2014).
- Nowack, B. Determination of phosphonates in natural waters by ion-pair high-performance liquid chromatography. Journal of Chromatography A. 773 (1-2), 139-146 (1997).
- Murphy, J., Riley, J. P. A modified single solution method for the determination of phosphate in natural waters. Analytica Chimica Acta. 27, 31-36 (1961).
- Worsfold, P., McKelvie, I., Monbet, P. Determination of phosphorus in natural waters: A historical review. Analytica Chimica Acta. 918, 8-20 (2016).
- Going, J. E., Eisenreich, S. J. Spectrophotometric studies of reduced molybdoantimonylphosphoric acid. Analytica Chimica Acta. 70, 95-106 (1974).
- Pai, S. C., Yang, C. C., Riley, J. P. Effects of acidity and molybdate concentration on the kinetics of the formation of the phosphoantimonylmolybdenum blue complex. Analytica Chimica Acta. 229, 115-120 (1990).
- Eisenreich, S. J., Bannerman, R. T., Armstrong, D. E. A simplified phosphorus analysis technique. Environmental Letters. 9 (1), 43-53 (1975).
- . . ISO 6878:2004. Water quality-Determination of phosphorus-Ammonium molybdate spectrometric method. , (2004).
- Freundlich, H. Über die Adsorption in Lösungen (About the adsorption in solutions). Z. Physical Chemistry. 57, 385-470 (1907).
- Ho, Y. S., Porter, J. F., McKay, G. Equilibrium isotherm studies for the sorption of divalent metal ions onto peat: Copper, nickel and lead single component systems. Water Air & Soil Pollution. 141 (1-4), 1-33 (2002).
- Li, L., Zhang, S., Li, G., Zhao, H. Determination of chemical oxygen demand of nitrogenous organic compounds in wastewater using synergetic photoelectrocatalytic oxidation effect at TiO2 nanostructured electrode. Analytica Chimica Acta. 754, 47-53 (2012).

