Potentiation Antineoplastic 약물으로 항 암 항 체 효능: 조합 인덱스 방정식을 사용 하 여 항 체-마약 성분의 검출
Summary
이 프로토콜 Chou와 Talalay 조합 인덱스 방정식을 사용 하 여 항 암 항 체와 전 임상 모델에서 antineoplastic 마약 성분 평가 하는 방법을 설명 합니다.
Abstract
적대적 단일 클론 항 체 (mAb) 화학요법 에이전트에 의해 potentiation 암에 대 한 효과적이 고 안전한 치료 설계를 위한 중요 한 전략을 구성 합니다. 여기 우리는 전 임상 단계에서 합리적인 조합을 식별 하는 프로토콜을 제공 합니다. 첫째, 우리는 Chou와 Talalay1의 조합 인덱스 방정식을 사용 하 여 항 암 제 mAb 및 세포 독성 약물 사이 성분 평가 셀 기반 분석 결과 설명 합니다. 측정의 종양 세포 약물 및 항 체-감도 MTT 분석 결과, 다음 조합 색인 (CI) 값을 계산 하는 자동화 된 컴퓨터 분석을 사용 하 여 포함 됩니다. CI 값 < 1 성분 테스트 mAbs와 세포 독성 대리인1사이 나타냅니다. 생체 외에서 연구 결과 vivo에서승산이 더이 종이 식 종양 모델에서 조합 처방 효능을 평가 하는 방법을 설명 합니다. 이 모델에서 결합 된 처방 크게 종양의 성장, 단일 에이전트 컨트롤에 비해 상당한 확장된 생존에 어떤 결과 지연 합니다. 중요 한 것은, vivo에서 실험 보여 조합 식이요법 잘 용납입니다. 이 프로토콜에는 항 암 약물 조합 전 임상 모델에서의 효과적인 평가 임상 시험에서 평가 하는 합리적인 조합 식별 수 있습니다.
Introduction
많은 암 종류의 치료에 접근 하는 기존의 방식은 monotherapy에 근거 했다. 경우에 그것은 여전히 많은 경우에 사용 하 고,이 방법이 결합된 요법2선택에 지도 하는 몇 가지 장애물을 만났다. 특히, 암 세포 개발 대안 생존 메커니즘3, 치료 실패 환자4결과 유도 하 여 단일 약물으로 치료 하면 저항을 더 따르게 됩니다. 또한, monotherapy에 약은 높은 복용량에서 관리 일반적으로. 이 상황을 자주 참을 수 의사 치료2중지를 강제로 수 있는 강한 복용량 의존 부작용의 발생에 발생 합니다. 이러한 이유로 항 암 분자의 협회는 지금 monotherapy 선호.
이상적인 약물 조합 정상 세포에 대 한 증가 독성 없이 종양 세포에 대 한 시너지에 행동 하는 그 것입니다. 성분 치료 효과 별도로 행동 하는 각 개별 약물의 합계 보다 큰 두 개 이상의 약물의 상호 작용을 말합니다. 이러한 상호 작용은 향상 된 임상 치료 효능2발생할 수 있습니다. 그것은 치료 저항을 제한, 효능, 증가 하 고 또한 독성2를 줄일 수 있습니다. 사실, 다른 경로 대상으로 그들의 부작용을 낮은 각 약물의 복용량을 줄일 수 있습니다. 또한, 분자의 하나 또한 암 세포에 대하여 sensitizing 요원으로 사용할 수 있습니다. 적은 복용량 사용된5수 그리고 두 번째 약물의 효과 민감하게 셀에 향상 될 수 있습니다.
결합된 치료는 화학요법 약물 및 생물 의약품, 단일 클론 항 체6등 두 개 이상 포함할 수 있습니다. 이러한 mAbs 특별히 대상으로 관심과 항 체 의존 세포 매개 세포 독성 (ADCC)를 포함 하 여 면역 경로 통해 종양 세포를 죽 일 수의 세포 표면 항 원 표출 세포 면역 효과 기 세포의 참여와 7, 그리고 보완 의존 세포 독성 (CDC)6. 그들은 또한 메커니즘을 통해 비 면역학 apoptosis8,9,,1011중재 역할 수 있습니다. 이 경우에, 프로그램 된 세포 죽음의 과정의 유도 고 수 있습니다 암 세포를 민감하게, 그들의 기능을 약하게 관련된 화학요법 약물 더 효과적인 낮은 복용량에. 이와 같이, proapoptotic mAb antineoplastic 약물 조합 식이요법을 디자인을 위한 좋은 후보자 이다.
다른 수학적 모델 마약 성분; 평가 설명 되었습니다. 그들 중 하나는 결합 인덱스 방법1을 기반으로 합니다. 이 방법은 추1에 의해 개발 된 중간값 효과 원리를 기반으로 합니다. 중간값 효과 방정식 상관 약 복용량 및 약물 효과 다음과 같이 한다.
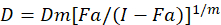
여기서, D 는 약 복용량; Dm 은 중간값 효과 복용량; Fa 는 분수; 복용량에 의해 영향을 m 복용량 효과 플롯1의 모양을 의미 하는 지 수입니다. 중간값 효과 복용량은 dx 를 억제 또는 셀의 “x” % 죽이고 약물의 복용량을 계산 하는 데 사용 됩니다. CI 값1을 다음과 같이 약물 조합의 첨가제 효과 평가 하기 위해 다음 계산 됩니다.
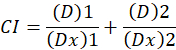
CI 값 1 나타냅니다 첨가제 효과 CI 값 의 CI 값 하면서 시너지 효과 나타냅니다 1 적개심1나타냅니다. 이 방법의 응용 프로그램은 컴퓨터 프로그램, CompuSyn, 성분 및 모든 복용량에서 적개심 결정 하는의 가용성에 의해 촉진 추가 또는 효과 레벨 시뮬레이션 자동으로12.
우리의 그룹 오 틸 g d 2 ganglioside (OAcGD2) 신경 항 원13 mAb 8B6 특정 개발과이 mAb는 apoptosis11의 특성을 가진 세포 죽음을 유도 수 입증 했다. MAb 8B6 antineoplastic 요원 topotecan 신경 세포를 민감하게 할 수 있는지 여부를 테스트 하려면 우리는 위에서 언급 한 방법 추1에 의해 개발 된 적응. 첫째, 우리는 mAb 8B6 및 topotecan의 효과적인 복용량 50 (에 드50) 값을 결정합니다. 다음,에 드50 값에 따라 두 화합물의 equipotent 비율 신경 세포 위에서 언급 한 시뮬레이션 소프트웨어를 사용 하 여 CI 값을 결정 하기 위해 노출 됩니다. 이 방법은 mAb 8B6 및 topotecan 시험관사이 성분 설명 수 있습니다. 다음, 우리는 더이 조합은 처방에서 vivo에서의 안전과 효능을 평가 하기 위해 프로토콜을 설명 합니다. 이 프로토콜은 전 임상 연구에서 강력 하 고 안전한 항 암 mAb 및 화학요법 에이전트 조합 선택에 쉽게 적용할 수 있습니다. 이 연구의 도식 대표는 그림 1에 제공 됩니다.
Protocol
Representative Results
Discussion
약물 상호 작용의 효과 예측, 세 가지 방법을 사용할 수 있습니다: isobologram 방법론17, 비선형 혼합 모형18그리고 조합 색인1. 결합 인덱스 분석은 그것의 응용 사용자 컴퓨터 프로그램의 가용성에 의해 간단 하 게 하기 때문에 가장 일반적으로 사용 됩니다. 이 위해 우리는 먼저 MTT 분석 결과19를 수행 하 여 단독으로 또는 조합?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
부여 지원: Fondation 드 Projet 드 L ‘대학교 드 낭트, 레 Bagouz’ 일품 마 농, 라 리그 죄수 르 암 위원회 회의 드 루아르-아 틀 랑 티크, 위원회 회의 뒤 모 르 비 앙, 및 위원회 회의 드 Vendée, 한 장미 S.A.R.A.H, 별미 드 마틴과 라 사회 프랑세즈 데 루 테 순이 레 부 어 암 외 레 leucémies 드 랑팡은 동부 표준시 드 L’adolescent (SFCE). M.B. 및 J.F. 라 리그 죄수 르 암에 의해 지원 됩니다. 저자는 UTE-시설 구조 Fédérative 드 검색 프랑수아 Bonamy의 감사합니다. 저자는 또한 그녀의 기술 지원 제공 하는 IMR5 세포에 대 한 박사 S. Suzin (Inserm, 파리)와 양 H. Estéphan 감사 합니다.
Materials
| Cell Proliferation kit (MTT) | Roche | 11-465-007-001 | |
| CompuSyn software | ComboSyn | Combosyn can be downloaded for free at http://www.combosyn.com | |
| Electric shaver | Bioseb | BIO-1556 | |
| Fetal calf serum | Eurobio | CVFSVFF00-01 | 10% heat-inactivated fetal calf serum in RPMI 1640 |
| Firefox | Mozilla Corporation | Firefox can be downloaded for free at http://www.mozilla.org/en-US/firefox/ | |
| Heat lamp | Verre&Quartz | 4003/1R | |
| Human neuroblastoma IMR-5 cell line | Accegen Biotechnology | ABC-TC0450 | IMR-5 is a clone of the human neuroblastoma cell line IMR32 5459762. IMR-5 cells were generously provided by Dr. Santos Susin (U.872, Paris, France) |
| L-glutamine | Gibco | 25030-024 | 2 mM in RPMI 1640 |
| Lysis solution | Roche | 11-465-007-001 | |
| mAb 8B6 | University of Nantes | N/A | |
| Matrigel | Corning | 354248 | |
| Multiskan FC | Thermofischer Scientific | N08625 | |
| Needle 21G 1 ½ | BD Microlance | 304432 | |
| Needle 25G 1 | Terumo | NN-2525R | |
| NSG mice | Charles River Laboratories | 5557 | |
| Nunc MicroWell 96-well microplates | Thermofisher | 167008 | |
| PBS | VWR | L182-10 | |
| PBS, 0,05% EDTA | Sigma-Aldrich | E9884 | |
| PC that runs windows 7 | Microsoft | Windows 7 can be purchased at http://www.microsoft.com/en-gb/software-download/windows7 | |
| Penicillin-Streptomycin | Gibco | 15140-122 | 100 units/mL penicillin and 100 mg/mL streptomycin in RPMI 1640 |
| Reagent reservoir | Thermofischer Scientific | 8094 | |
| Rodent restrainer | Bioseb | TV-150-SM | |
| RPMI 1640 | Gibco | 31870-025 | |
| Syringe 1 mL | Henke Sass Wolf | 5010.200V0 | |
| Topotecan | Sigma-Aldrich | T2705 |
References
- Chou, T. C. Theoretical basis, experimental design, and computerized simulation of synergism and antagonism in drug combination studies. Pharmacological Reviews. 58 (3), 621-681 (2006).
- Bayat Mokhtari, R., et al. Combination therapy in combating cancer. Oncotarget. 8 (23), 38022-38043 (2017).
- Zahreddine, H., Borden, K. L. Mechanisms and insights into drug resistance in cancer. Frontiers in Pharmacology. 4, 28 (2013).
- Martin, T. P., Baguley, D., et al. Re: “Postoperative validation of bone-anchored implants in the single-sided deafness population.” Snapp et al. Otol Neurotol 2012: 33;291-6. Otol Neurotol. 34 (4), 777-778 (2013).
- Choi, B., et al. Sensitization of lung cancer cells by altered dimerization of HSP27. Oncotarget. 8 (62), 105372-105382 (2017).
- Weiner, L. M., Surana, R., Wang, S. Monoclonal antibodies: versatile platforms for cancer immunotherapy. Nature Reviews Immunology. 10 (5), 317-327 (2010).
- Mellor, J. D., Brown, M. P., Irving, H. R., Zalcberg, J. R., Dobrovic, A. A critical review of the role of Fc gamma receptor polymorphisms in the response to monoclonal antibodies in cancer. Journal of Hematology & Oncology. 6, 1 (2013).
- Kowalczyk, A., et al. The GD2-specific 14G2a monoclonal antibody induces apoptosis and enhances cytotoxicity of chemotherapeutic drugs in IMR-32 human neuroblastoma cells. Cancer Letters. 281 (2), 171-182 (2009).
- Retter, M. W., et al. Characterization of a proapoptotic antiganglioside GM2 monoclonal antibody and evaluation of its therapeutic effect on melanoma and small cell lung carcinoma xenografts. Cancer Research. 65 (14), 6425-6434 (2005).
- Nakamura, K., et al. Apoptosis induction of human lung cancer cell line in multicellular heterospheroids with humanized antiganglioside GM2 monoclonal antibody. Cancer Research. 59 (20), 5323-5330 (1999).
- Cochonneau, D., et al. Cell cycle arrest and apoptosis induced by O-acetyl-GD2-specific monoclonal antibody 8B6 inhibits tumor growth in vitro and in vivo. Cancer Letters. 333 (2), 194-204 (2013).
- Chou, T. C., Martin, N. . CompuSyn for drug combinations: PC software and user’s guide: a computer program for quantitation of synergism and antagonism in drug combinations, and the determination of IC50 and ED50 and LD50 values. , (2005).
- Alvarez-Rueda, N., et al. A monoclonal antibody to O-acetyl-GD2 ganglioside and not to GD2 shows potent anti-tumor activity without peripheral nervous system cross-reactivity. PLoS One. 6 (9), e25220 (2011).
- Faraj, S., et al. Neuroblastoma chemotherapy can be augmented by immunotargeting O-acetyl-GD2 tumor-associated ganglioside. Oncoimmunology. 7 (1), e1373232 (2017).
- Ishikawa, F., et al. Development of functional human blood and immune systems in NOD/SCID/IL2 receptor {gamma} chain(null) mice. Blood. 106 (5), 1565-1573 (2005).
- Ullman-Cullere, M. H., Foltz, C. J. Body condition scoring: a rapid and accurate method for assessing health status in mice. Laboratory Animal Science. 49 (3), 319-323 (1999).
- Teicher, B. A. Assays for in vitro and in vivo synergy. Methods in Molecular Medicine. 85, 297-321 (2003).
- White, D. B., Slocum, H. K., Brun, Y., Wrzosek, C., Greco, W. R. A new nonlinear mixture response surface paradigm for the study of synergism: a three drug example. Current Drug Metabolism. 4 (5), 399-409 (2003).
- Mosmann, T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods. 65 (1-2), 55-63 (1983).
- Huyck, L., Ampe, C., Van Troys, M. The XTT cell proliferation assay applied to cell layers embedded in three-dimensional matrix. Assay and Drug Development Technologies. 10 (4), 382-392 (2012).
- Thompson, J., et al. Synergy of topotecan in combination with vincristine for treatment of pediatric solid tumor xenografts. Clinical Cancer Research. 5 (11), 3617-3631 (1999).
- Tan, M., Fang, H. B., Tian, G. L., Houghton, P. J. Experimental design and sample size determination for testing synergism in drug combination studies based on uniform measures. Statistic in Medicine. 22 (13), 2091-2100 (2003).
- Tang, X. X., et al. Implications of EPHB6, EFNB2, and EFNB3 expressions in human neuroblastoma. Proceding of the National Academy of Sciences of the United States of America. 97 (20), 10936-10941 (2000).
- Mehta, R. R., Graves, J. M., Hart, G. D., Shilkaitis, A., Das Gupta, T. K. Growth and metastasis of human breast carcinomas with Matrigel in athymic mice. Breast Cancer Research and Treatment. 25 (1), 65-71 (1993).
- Mullen, P., Ritchie, A., Langdon, S. P., Miller, W. R. Effect of Matrigel on the tumorigenicity of human breast and ovarian carcinoma cell lines. International Journal of Cancer. 67 (6), 816-820 (1996).
- Feng, C., Tang, S., Wang, J., Liu, Y., Yang, G. Topotecan plus cyclophosphamide as maintenance chemotherapy for children with high-risk neuroblastoma in complete remission: short-term curative effects and toxicity. Nan Fang Yi Ke Da Xue Xue Bao. 33 (8), 1107-1110 (2013).
- Cheung, N. K., et al. Ganglioside GD2 specific monoclonal antibody 3F8: a phase I study in patients with neuroblastoma and malignant melanoma. Journal of Clininical Oncology. 5 (9), 1430-1440 (1987).
- Nair, A. B., Jacob, S. A simple practice guide for dose conversion between animals and human. Journal of Basic Clinical Pharmacy. 7 (2), 27-31 (2016).
- Dayde, D., et al. Tumor burden influences exposure and response to rituximab: pharmacokinetic-pharmacodynamic modeling using a syngeneic bioluminescent murine model expressing human CD20. Blood. 113 (16), 3765-3772 (2009).
- Racki, W. J., et al. NOD-scid IL2rgamma(null) mouse model of human skin transplantation and allograft rejection. Transplantation. 89 (5), 527-536 (2010).
- Sherif, A., Winerdal, M., Winqvist, O. Immune Responses to Neoadjuvant Chemotherapy in Muscle Invasive Bladder Cancer. Bladder Cancer. 4 (1), 1-7 (2018).

