Potentiering av Anticancer antikropp effekt av antineoplastiska läkemedel: Påvisande av antikropp-drogen Synergism med kombination Index formel
Summary
Det här protokollet beskriver hur man skall bedöma synergier mellan en anticancer antikropp och antineoplastiska läkemedel i prekliniska modeller med hjälp av kombination index ekvation av Chou och Talalay.
Abstract
Potentiering av fientliga monoklonala antikroppar (mAb) av kemoterapeutiska medel utgör en värdefull strategi för att utforma effektivare och säkrare behandling mot cancer. Här tillhandahåller vi ett protokoll för att identifiera en rationell kombination vid prekliniska steg. Först beskriver vi en cell-baserad analys för att bedöma den synergism mellan anticancer mAb och cytostatika, som använder kombination index ekvationen av Chou och Talalay1. Detta inkluderar mätning av tumör cell drog – och antikropp-känslighet med en MTT-analys, följt av en automatiserad dator analys att beräkna kombination index (CI) värdena. CI värden av < 1 indikerar synergier mellan testade mAbs och cytotoxiska medel1. För att bekräfta den in vitro- fynd i vivo, beskriver vi ytterligare en metod för att bedöma kombination regim effekten i en xenograft tumör modell. I denna modell fördröjer den kombinera behandlingen avsevärt tumörtillväxt, vilket resulterar i en signifikant förlängd överlevnad jämfört med monoterapi kontroller. Allt avslöjar i vivo experimenterandet att kombinationsbehandlingen tolereras väl. Detta protokoll tillåter effektiv utvärdering av anticancer läkemedelskombinationer i prekliniska modeller och identifiering av rationella kombination att utvärdera i kliniska prövningar.
Introduction
Den konventionella metoden för behandling av ett stort antal olika typer av cancer var baserad på monoterapi. Även om det används fortfarande i många fall, träffade denna metod flera hinder som leder till valet av kombinerade behandlingar2. Särskilt, är cancerceller mer mottagliga att utveckla motstånd när de behandlades med en enda drog genom att inducera alternativa överlevnad mekanismer3, vilket resulterar i terapeutiska misslyckande i patienter4. Dessutom i monoterapi administreras läkemedel vanligtvis vid höga doser. Denna situation ofta resulterar i förekomsten av starka dosberoende biverkningar som kan vara outhärdlig och tvinga läkarna att stoppa den behandling2. Av dessa skäl föreningen anticancer molekyler är nu föredrog att monoterapi.
Perfekt läkemedelskombinationer skulle vara de som agerar i samverkan mot tumörceller, utan ökad toxicitet mot normala celler. Synergism avser samverkan mellan två eller flera läkemedel som ger en terapeutisk effekt som är större än summan av varje enskilt läkemedel som agerar separat. Sådana interaktioner kan resultera i förbättrad klinisk terapeutiska effekt2. Den begränsar behandlingsresistens, ökar effekten och kan också minska toxicitet2. I själva verket kan doseringen av varje läkemedel sänkas för att sänka deras biverkningar genom att rikta olika vägar. Dessutom kan en av molekylerna också fungera som en sensibiliserande agent mot cancerceller. Effekten av andra läkemedel kan förstärkas på sensibiliserade celler och färre doser kan vara används5.
Kombinerad terapi kan innehålla två eller fler cytostatika och/eller biologiska läkemedel, såsom monoklonala antikroppar6. Dessa mAbs specifikt inrikta celler som uttrycker en cell ytantigen av intresse och kan döda tumörceller via immunologiska vägar, inklusive antikroppsberoende cellmedierad cytotoxicitet (ADCC), med deltagande av immun effektor celler 7och komplementberoende cytotoxicitet (CDC)6. De kan också agera via en icke-immunologiska mekanism medierad av apoptos8,9,10,11. I detta fall kan induktionen av processen för programmerad celldöd medvetandegöra cancerceller försvaga deras funktion och effektivisera det associerade kemoterapeutiska läkemedlet vid en lägre dos. Som sådan, proapoptotiska mAb är bra kandidater för att utforma kombinationsregimer med antineoplastiska läkemedel.
Olika matematiska modeller har beskrivits för att bedöma drog synergier; en av dem är baserad på kombinationen index metod1. Denna metod är baserad på principen om median-effekt utvecklats av Chou1. Median-effekt ekvationen korrelerar till läkemedelsdos och drogen effekt enligt följande.
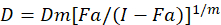
Här, är D läkemedelsdos; DM är den median-effekt dosnivåer; FA är det bråk som påverkas av dosen; m är en exponent som betecknar formen av dos-effekt tomt1. Den median-effekt dosnivåer används för att beräkna dosen Dx av ett läkemedel som hämmar eller dödar ”x” procent av cellerna. CI värdet beräknas sedan för att bedöma de additiv effekten av kombinationen drog, enligt följande1.
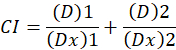
CI värdet 1 anger en additiv effekt och CI värdet 1 indikerar antagonism1. Tillämpningen av denna metod underlättas ytterligare av tillgången till ett datorprogram, CompuSyn, som bestämmer synergier och antagonism vid alla doser eller effekt nivåer simulerade automatiskt12.
Vår grupp har utvecklat den mAb 8B6 specifikt för O-acetyl-GD2 ganglioside (OAcGD2) neuroblastom antigen13 och ytterligare visat att denna mAb skall kunna inducera celldöd med attribut av apoptos11. För att testa om mAb 8B6 kan medvetandegöra neuroblastomceller till den antineoplastiska agent topotekan, anpassade vi den ovannämnda metoden som utvecklats av Chou1. Först, vi fastställa effektiva dosen 50 (ED50) värdena för mAb 8B6 och topotecan. Därefter utsätts neuroblastomceller med ekvipotenta nyckeltal av de två substanserna baserat på ED50 värden för att bestämma CI värdena med de ovannämnda simuleringsprogram. Denna metod tillåter oss att Visa synergier mellan mAb 8B6 och topotecan in vitro. Därefter beskriver vi ett protokoll för att ytterligare bedöma styrkan och säkerheten i denna kombination regim i vivo. Detta protokoll kan appliceras enkelt markera potent och säker mot cancer mAb och kemoterapeutiska agent kombinationer i prekliniska studier. En schematisk representation av denna studie ges i figur 1.
Protocol
Representative Results
Discussion
För att förutsäga effekten av läkemedelsinteraktioner, tre metoder kan användas: den isobologram metod17, ickelinjära blandning modell18och kombinationen index1. Kombination index analys används ofta eftersom dess tillämpning är förenklad av tillgången till ett användarvänligt datorprogram. För detta ändamål kännetecknas vi första dos-effekt svar varje agent används ensamt eller i kombination, genom att utföra en MTT assay<sup cla…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Bevilja stöd: Fondation de Projet de L ‘Université de Nantes, les Bagouz’ à Manon, La Ligue contre le Cancer comité de Loire-Atlantique, comité du Morbihan och comité de Vendée, une ros Häll S.A.R.A.H, L’Etoile de Martin och la Société Française de Lutte contre les Cancerformer et les leucémies de L’Enfant et de L’adolescent (SFCE). M.B. och J.F. stöds av La Ligue Contre Le Cancer. Författarna vill tacka UTE-anläggningen av den struktur Fédérative de Recherche François Bonamy. Författarna också tacka Dr S. Suzin (Inserm, Paris) för att tillhandahålla de IMR5 cellerna och Ms. H. Estéphan för hennes tekniskt bistånd.
Materials
| Cell Proliferation kit (MTT) | Roche | 11-465-007-001 | |
| CompuSyn software | ComboSyn | Combosyn can be downloaded for free at http://www.combosyn.com | |
| Electric shaver | Bioseb | BIO-1556 | |
| Fetal calf serum | Eurobio | CVFSVFF00-01 | 10% heat-inactivated fetal calf serum in RPMI 1640 |
| Firefox | Mozilla Corporation | Firefox can be downloaded for free at http://www.mozilla.org/en-US/firefox/ | |
| Heat lamp | Verre&Quartz | 4003/1R | |
| Human neuroblastoma IMR-5 cell line | Accegen Biotechnology | ABC-TC0450 | IMR-5 is a clone of the human neuroblastoma cell line IMR32 5459762. IMR-5 cells were generously provided by Dr. Santos Susin (U.872, Paris, France) |
| L-glutamine | Gibco | 25030-024 | 2 mM in RPMI 1640 |
| Lysis solution | Roche | 11-465-007-001 | |
| mAb 8B6 | University of Nantes | N/A | |
| Matrigel | Corning | 354248 | |
| Multiskan FC | Thermofischer Scientific | N08625 | |
| Needle 21G 1 ½ | BD Microlance | 304432 | |
| Needle 25G 1 | Terumo | NN-2525R | |
| NSG mice | Charles River Laboratories | 5557 | |
| Nunc MicroWell 96-well microplates | Thermofisher | 167008 | |
| PBS | VWR | L182-10 | |
| PBS, 0,05% EDTA | Sigma-Aldrich | E9884 | |
| PC that runs windows 7 | Microsoft | Windows 7 can be purchased at http://www.microsoft.com/en-gb/software-download/windows7 | |
| Penicillin-Streptomycin | Gibco | 15140-122 | 100 units/mL penicillin and 100 mg/mL streptomycin in RPMI 1640 |
| Reagent reservoir | Thermofischer Scientific | 8094 | |
| Rodent restrainer | Bioseb | TV-150-SM | |
| RPMI 1640 | Gibco | 31870-025 | |
| Syringe 1 mL | Henke Sass Wolf | 5010.200V0 | |
| Topotecan | Sigma-Aldrich | T2705 |
References
- Chou, T. C. Theoretical basis, experimental design, and computerized simulation of synergism and antagonism in drug combination studies. Pharmacological Reviews. 58 (3), 621-681 (2006).
- Bayat Mokhtari, R., et al. Combination therapy in combating cancer. Oncotarget. 8 (23), 38022-38043 (2017).
- Zahreddine, H., Borden, K. L. Mechanisms and insights into drug resistance in cancer. Frontiers in Pharmacology. 4, 28 (2013).
- Martin, T. P., Baguley, D., et al. Re: “Postoperative validation of bone-anchored implants in the single-sided deafness population.” Snapp et al. Otol Neurotol 2012: 33;291-6. Otol Neurotol. 34 (4), 777-778 (2013).
- Choi, B., et al. Sensitization of lung cancer cells by altered dimerization of HSP27. Oncotarget. 8 (62), 105372-105382 (2017).
- Weiner, L. M., Surana, R., Wang, S. Monoclonal antibodies: versatile platforms for cancer immunotherapy. Nature Reviews Immunology. 10 (5), 317-327 (2010).
- Mellor, J. D., Brown, M. P., Irving, H. R., Zalcberg, J. R., Dobrovic, A. A critical review of the role of Fc gamma receptor polymorphisms in the response to monoclonal antibodies in cancer. Journal of Hematology & Oncology. 6, 1 (2013).
- Kowalczyk, A., et al. The GD2-specific 14G2a monoclonal antibody induces apoptosis and enhances cytotoxicity of chemotherapeutic drugs in IMR-32 human neuroblastoma cells. Cancer Letters. 281 (2), 171-182 (2009).
- Retter, M. W., et al. Characterization of a proapoptotic antiganglioside GM2 monoclonal antibody and evaluation of its therapeutic effect on melanoma and small cell lung carcinoma xenografts. Cancer Research. 65 (14), 6425-6434 (2005).
- Nakamura, K., et al. Apoptosis induction of human lung cancer cell line in multicellular heterospheroids with humanized antiganglioside GM2 monoclonal antibody. Cancer Research. 59 (20), 5323-5330 (1999).
- Cochonneau, D., et al. Cell cycle arrest and apoptosis induced by O-acetyl-GD2-specific monoclonal antibody 8B6 inhibits tumor growth in vitro and in vivo. Cancer Letters. 333 (2), 194-204 (2013).
- Chou, T. C., Martin, N. . CompuSyn for drug combinations: PC software and user’s guide: a computer program for quantitation of synergism and antagonism in drug combinations, and the determination of IC50 and ED50 and LD50 values. , (2005).
- Alvarez-Rueda, N., et al. A monoclonal antibody to O-acetyl-GD2 ganglioside and not to GD2 shows potent anti-tumor activity without peripheral nervous system cross-reactivity. PLoS One. 6 (9), e25220 (2011).
- Faraj, S., et al. Neuroblastoma chemotherapy can be augmented by immunotargeting O-acetyl-GD2 tumor-associated ganglioside. Oncoimmunology. 7 (1), e1373232 (2017).
- Ishikawa, F., et al. Development of functional human blood and immune systems in NOD/SCID/IL2 receptor {gamma} chain(null) mice. Blood. 106 (5), 1565-1573 (2005).
- Ullman-Cullere, M. H., Foltz, C. J. Body condition scoring: a rapid and accurate method for assessing health status in mice. Laboratory Animal Science. 49 (3), 319-323 (1999).
- Teicher, B. A. Assays for in vitro and in vivo synergy. Methods in Molecular Medicine. 85, 297-321 (2003).
- White, D. B., Slocum, H. K., Brun, Y., Wrzosek, C., Greco, W. R. A new nonlinear mixture response surface paradigm for the study of synergism: a three drug example. Current Drug Metabolism. 4 (5), 399-409 (2003).
- Mosmann, T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods. 65 (1-2), 55-63 (1983).
- Huyck, L., Ampe, C., Van Troys, M. The XTT cell proliferation assay applied to cell layers embedded in three-dimensional matrix. Assay and Drug Development Technologies. 10 (4), 382-392 (2012).
- Thompson, J., et al. Synergy of topotecan in combination with vincristine for treatment of pediatric solid tumor xenografts. Clinical Cancer Research. 5 (11), 3617-3631 (1999).
- Tan, M., Fang, H. B., Tian, G. L., Houghton, P. J. Experimental design and sample size determination for testing synergism in drug combination studies based on uniform measures. Statistic in Medicine. 22 (13), 2091-2100 (2003).
- Tang, X. X., et al. Implications of EPHB6, EFNB2, and EFNB3 expressions in human neuroblastoma. Proceding of the National Academy of Sciences of the United States of America. 97 (20), 10936-10941 (2000).
- Mehta, R. R., Graves, J. M., Hart, G. D., Shilkaitis, A., Das Gupta, T. K. Growth and metastasis of human breast carcinomas with Matrigel in athymic mice. Breast Cancer Research and Treatment. 25 (1), 65-71 (1993).
- Mullen, P., Ritchie, A., Langdon, S. P., Miller, W. R. Effect of Matrigel on the tumorigenicity of human breast and ovarian carcinoma cell lines. International Journal of Cancer. 67 (6), 816-820 (1996).
- Feng, C., Tang, S., Wang, J., Liu, Y., Yang, G. Topotecan plus cyclophosphamide as maintenance chemotherapy for children with high-risk neuroblastoma in complete remission: short-term curative effects and toxicity. Nan Fang Yi Ke Da Xue Xue Bao. 33 (8), 1107-1110 (2013).
- Cheung, N. K., et al. Ganglioside GD2 specific monoclonal antibody 3F8: a phase I study in patients with neuroblastoma and malignant melanoma. Journal of Clininical Oncology. 5 (9), 1430-1440 (1987).
- Nair, A. B., Jacob, S. A simple practice guide for dose conversion between animals and human. Journal of Basic Clinical Pharmacy. 7 (2), 27-31 (2016).
- Dayde, D., et al. Tumor burden influences exposure and response to rituximab: pharmacokinetic-pharmacodynamic modeling using a syngeneic bioluminescent murine model expressing human CD20. Blood. 113 (16), 3765-3772 (2009).
- Racki, W. J., et al. NOD-scid IL2rgamma(null) mouse model of human skin transplantation and allograft rejection. Transplantation. 89 (5), 527-536 (2010).
- Sherif, A., Winerdal, M., Winqvist, O. Immune Responses to Neoadjuvant Chemotherapy in Muscle Invasive Bladder Cancer. Bladder Cancer. 4 (1), 1-7 (2018).

