クラスターによる脱着/イオン化質量分析による、表面上の複雑分子とその反応の解析
Summary
低運動エネルギーの中性SO2クラスター(<0.8 eV/構成要素)は、イオントラップ質量分析計を用いた質量分析によるさらなる分析のために、ペプチドや脂質などの複雑な表面分子を脱ソーブするために使用されます。特別なサンプル調製は不要で、反応のリアルタイム観察が可能です。
Abstract
中性SO2クラスター(DINeC)によって誘導される脱離/イオン化は、複雑な分子の質量分析(MS)および表面上の反応のための非常に柔らかく効率的な脱離/イオン化技術として採用されています。DINeCは、低クラスターエネルギーでサンプル表面に影響を与えるSO2クラスターのビームに基づいています。クラスター表面衝撃の間、表面分子の一部は、衝撃性クラスター内の分解によって脱着され、イオン化されます。この解決媒介脱着機構の結果として、低クラスターエネルギーが十分であり、脱着プロセスは極めてソフトである。表面が吸着し、表面が構成されている分子の両方を解析することができます。ペプチドやタンパク質などの複雑な分子から、透明で断片化のないスペクトルが得られます。DINeCは特別なサンプル調製を必要とせず、特にマトリックスを適用する必要はありません。この方法は、サンプルの組成に関する定量的な情報を生成します。単層の0.1%という低い表面の範囲の分子を検出することができる。H/D交換や熱分解などの表面反応はリアルタイムで観察でき、反応の動態を推定することができます。クラスタビーム生成用のパルスノズルを使用して、DINeCをイオントラップ質量分析と効率的に組み合わせることができます。DINeCプロセスのマトリックスフリーでソフトな性質は、イオントラップのMSn機能と組み合わせて、複雑な有機サンプルの化学組成と表面上の有機吸引の非常に詳細かつ明確な分析を可能にします。
Introduction
表面に敏感な解析技術は、多くの場合、固体試料と強く相互作用する低エネルギー電子、原子、またはイオンなどの粒子プローブに基づいています。結果として、それらは高い表面感受性を示し、表面構造の詳細な情報は1得ることができる。しかし、化学情報は多くの場合、限られています。例として、X線光電子分光法は、原子組成および特定の種の平均化学環境(例えば、表面2に吸着された有機分子中の炭素原子)に関する定量的情報を与えることができる。しかし、その詳細な構造や結合部位など、複雑で表面吸着した分子に関するより詳細な情報は、標準的な表面分析技術では得られにくい。一方、このような情報の必要性は、有機分子による表面機能化への関心の高まりとともに増大している。生体分子4,5の付着による表面合成3または表面官能化の分野の拡大は、2つの顕著な例である。これらの分野において、システムをよりよく理解するために、基質吸引および吸引吸引相互作用に関する基本的な質問が調査される。これらの調査のためには、吸着分子に関する情報の最大値が望ましい。
一部では、二次イオン質量分析(SIMS)は、このような情報を与えることができます。まず、SIMS は表面に非常に敏感です。第二に、スパッタをした側がMSによってその断片を吸引し、その断片が検出されると、原子組成をはるかに超えた情報が得られる。表面に吸着される化学種の性質に応じて、質量スペクトル6で観察されたその分子質量およびフラグメントパターンによって同定することができる。一次イオンによって誘導される断片は、分析された材料の同定に役立ちます。一方、試料の一次イオン誘導修飾(断片化、イオン誘導反応、混合)が強すぎると、サンプルの元の状態に関する情報が殆して失われる。したがって、SIMSの断片化を減らすために主要な努力がなされている(例えば、一次イオンとして荷電した分子クラスターを使用して7、8、9)。しかし、断片化は依然として大きな巨大分子と生物学的サンプル10のSIMSスペクトルを支配し、様々な分野でのSIMSの適用を制限している。
代替として、中性クラスター(DINeC)によって誘導される脱離/イオン化は、複雑分子11、12、13、14、15、16、17の質量分析にうまく用いられた柔らかくマトリックスフリーのイオン化法であることを示した。DINeCは、10 3〜104個のSO2分子からなる分子クラスターのビームに基づいています(図1)。クラスターがサンプルに影響を与えると、クラスターの運動エネルギーの一部が再分配され、脱着が活性化され、表面の分子とさまざまな方法で相互作用します。同様に重要な点は、脱着分子がクラスター表面衝撃11、18、19の間にクラスターに溶解される(図1および図2)。つまり、SO2の高双極モーメントに基づいて、クラスターは極性アナライトの非定常行列として非常に効率的に機能する。その結果、アナライト分子の脱離は、1 eV/分子以下のクラスターエネルギーで行われます。脱着プロセスの柔らかい性質は、表面衝撃11、19の間および後にSO2クラスタが粉々になったときにシステムの急速冷却によってさらに支えられている。これらの様々な側面の結果として、ペプチド、タンパク質、脂質、および色素などの複雑な分子のクラスター誘発脱着は、脱離分子11、15の断片化なしで進行する。典型的な質量スペクトルは、インタクト分子のm/z値([M+H]または[M-H]-、図3)のm/z値で支配的なピークを示します。分子中の官能基の数および性質に応じて、複数の荷電カチオンの形態[M+n·」H]n+は11、15、18が観察される。生体分子の場合、イオン化は、通常、塩基性または酸性官能基でのプロトンの取り込みまたは抽象化を介して行われ、それぞれ11である。試料中に水分子が存在する場合、クラスタ由来のSO2分子は、亜硫酸18を形成するこれらの水分子と反応し得る。後者は、プロトン取り込み(正イオンモード)13、18を介したイオン化の場合のイオン化プロセスをさらに促進する効率的なプロトン源として作用することができる。
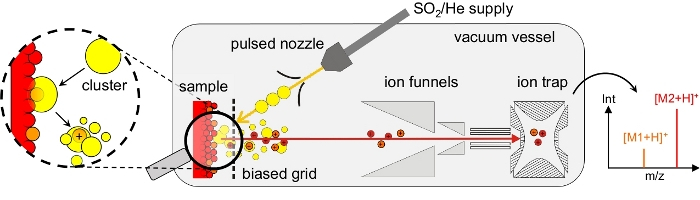
図1:クラスター誘発脱着/イオン化と実験的なセットアップの概略図クラスター誘導脱離/イオン化は、高真空容器で行われます。SO2クラスター(黄色のドット)のビームは、パルスノズルからのSO2/Heガス混合物の超音速膨張によって生成される。クラスター表面衝撃の間、表面分子は脱着され、イオン化されます。分子イオン(赤/オレンジドット)は、バイアスされたグリッド、デュアルイオン漏斗の入口、およびオクトポーライオンガイドを介して質量分析用のイオントラップに送られます。典型的な質量スペクトルは、インタクト分子のm/z値で優勢なピークを示し、ここではM1(オレンジ)およびM2(赤色)を正イオンモードで示します。爆破: クラスター表面衝撃時に、脱着分子が衝撃クラスターまたはそのフラグメントの 1 つに溶解します。さらにSO2分子の粉砕および蒸発は、質量分析計で検出されたように、裸の無傷の分子イオンに至る。図2も参照してください。この図の大きなバージョンを表示するには、ここをクリックしてください。
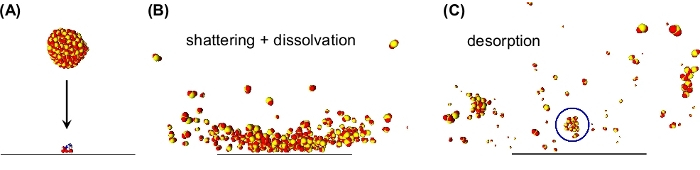
図2:分解によるクラスター誘導脱着を示す分子動力学シミュレーションのスナップショット(A)SO2クラスター(300分子)は、ジペプチド(アスパラギン酸アルギニン、ASP-ARG)が吸着された表面に対して1250m/s直交で表面に接近する。(B)クラスター表面の衝撃の際に、クラスターが粉々になる。吸着ジペプチドは、周囲のSO2分子と相互作用し、クラスター断片の1つでその解決につながる。(C)クラスター断片が表面からはみ出す。標識された断片(青い円)は、この断片に脱着されたジペプチドを運ぶ。この図は参照19から修正されました。この図の大きなバージョンを表示するには、ここをクリックしてください。
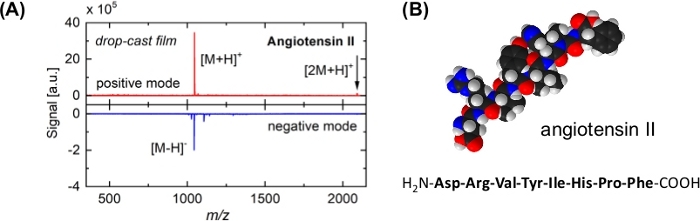
図3:アンジオテンシンIIの代表的な質量スペクトル及び分子モデル(A)質量スペクトル(上パネル:正イオンモード、底部パネル:負イオンモード)は、アンジオテンシンIIサンプルからクラスター誘導脱離/イオン化後に得られたもの。サンプルを、それぞれの溶液をSiウエハ(その天然酸化物で覆われた)上にドロップキャストして調製した。主なピークは、無傷の生体分子[M+H]+および[M-H]に割り当てられます。フラグメンテーション パターンは観察されません。ダイマー([2M+H]+、矢印)は、脱着プロセスの柔らかい性質をさらに示す。正イオン信号は、SO2クラスタ18の影響によりより強い。(B)アンジオテンシンIIの空間充填モデル及びアミノ酸配列。白いボールは水素原子を示す。ブラック: カーボン;青:窒素;赤:酸素。この図の大きなバージョンを表示するには、ここをクリックしてください。
DINeCは高真空条件と互換性がある固体サンプルの任意の並べ替えに適用することができる。特別なサンプル調製は必要なく、特に、マトリックス支援レーザー脱離/イオン化(MALDI)質量分析および関連技術20、21とは対照的に、DINeC-MS測定の前にマトリックスを適用する必要はない。これにより、真空チャンバー22または試料温度における反応性種のバックグラウンド圧力など、様々な実験条件で試料の化学的変化をリアルタイムで測定することが可能になる。DINeC-MSの検出限界はフェムトモール範囲11であることが示されている。サブモノ層レジーム内の固体表面に吸着した生体分子の解析に適用すると、単層の0.1%程度の表面被覆が検出された23。このカバレッジレジームでは、信号強度は表面カバレッジに直線的に依存し、DINeC-MSは、表面組成23の定量分析に使用することができる。混合サンプルの場合、試料組成物の定量的評価は17、24が可能であり、イオン化確率に対する化学的環境の大きな影響は認められない(例えば、混合脂質/ペプチドサンプル17の場合)。これは、特定の種のイオン化確率が、典型的には異なる化学成分の存在によって強く影響されるSIMSとは明らかな対照である(いわゆる「マトリックス効果」25、26)。
表面分析に加えて、地下領域の化学組成は、深度プロファイリング17によって探査することができる。現在のセットアップでは、生体分子のクラスター誘導脱着の典型的な脱離率は、10-3 nm/sの順序です。混合脂質/ペプチドサンプル17に対して1〜2nmの範囲で高い深度分解能が観察されている。
さらに応用分野としては、DINeC-MSと薄層クロマトグラフィー(TLC)の組み合わせがあります。従来のTLCプレートは、DINeC-MSを用いて直接分析することができ、位置依存性質量スペクトルはTLCプレートから取得することができ、したがってTLCプレート27から質量特異的クロマトグラムを得ることができる。分離された検体の再溶出は必要なく、ESI28、29と組み合わせて TLC と異なる。MALDI28、29とのTLCの結合とは対照的に、DINeC-MS + TLCの組み合わせにもマトリクスは必要ありません。
脱離エレクトロスプレーイオン化(DESI)はまた、MSアプリケーション30、31のためのソフト脱離/イオン化方法である。DINeCとDESIの最も顕著な違いは、DINeC23の定量的性質、超高真空(UHV)条件との互換性、特に真空23を破ることなくUHV条件で調製および移送されたサンプルを調査する可能性、および非極性分子19を効率的に脱脱する可能性である。
原則として、脱離/イオン化源としてのDINeCは、あらゆるタイプの質量分析計に結合することができる。しかし、イオントラップ質量分析との組み合わせは、2つの主な利点を特徴とする:第1に、典型的なパルス化されたクラスタービームのパルス幅および繰り返し速度は、イオントラップ15のスペクトルレートと同様に不連続蓄積時間に非常によく対応する、32。第二に、DINeCプロセスの柔らかい性質は、無傷の分子の脱着につながります。イオントラップ質量分析法のMSn能力と組み合わせて、調査されたサンプル15の最も包括的な分析が可能となる。
Protocol
Representative Results
Discussion
これまでに行われた多くの研究において、様々な物質に対するDINeC-MSの高感度が実証されている。実際、これはフェムトモールレジーム11内の物質の量まで検体の測定を可能にする。この高感度のため、サンプル調製、特に基板洗浄は、DINeC質量スペクトルの汚染を回避するために、高純度の化学物質で行われないものとなっ必要があります。多くの解析技術の場合は、空の基板からの適切なバックグラウンド測定は、基板/サンプル調製においてその起源を有する分析物およびピークからピークを分離するのに役立ちます。
我々は、所定の分析体分子のイオン化確率が混合試料17、24における共吸気または共構成成分の存在によって強く影響されないことを示したが、イオン化確率は物質から物質13に異なる場合がある。したがって、汚染物質としてクリーンな条件下で働き、イオン化の確率に応じて、検体よりもはるかに強い信号に寄与する可能性があります。予磁性イオン(例えば、多くの色素分子の場合に見られる)、または、プロトンの取り込みまたは脱プロトン化(すなわち、塩基または酸)に対する明確な傾向を示す官能基を有する分子は、典型的にはDINeC−MSにおける高いイオン化確率を示す。そのような官能基が検分に存在しない場合、イオン化確率は低くなる可能性がある。次いで、トリフルオロ酸などのイオン化剤(例えば、イオン化剤の蒸気圧への試料の曝露によって)により試料を処理することができる。
図4と図5で説明した代表的な結果は、質量分析法による化学反応のリアルタイム調査のためのDINeC-MSの適用性を示す。図6は、その方法のサブモノ層感受性を示す。2つの特性が組み合わされば、表面上の化学反応とその製品はリアルタイム23で追跡することができる。これは、表面3、33、34、35、36上の高分子構造の集合につながるいわゆる「表面合成」のために特に興味深いことができます。現在のセットアップでは、このような表面反応の観察は、金23や他の貴金属のような低い反応性を有する表面上で可能である。この実験は、シリコン表面37のような高反応性の表面で行われるのがより困難であり、脱着チャンバ内の塩基圧は10-7-mbar-範囲にある。現在の活動はこの制限に対処し、UHV互換DINeC装置が構築されています。反応性表面の場合、表面吸引および表面反応の測定の前に、SO2と基質表面との相互作用を試験しなければならない。
クラスタビームは中立であるため、集光できません。サンプル上のビームサイズは、このように使用中のスキマーのセットアップとオリフィスの形状によって与えられます。サンプルのビーム直径の典型的な値は、1〜数ミリメートルです。その結果、サンプルをスキャンすることで撮像が可能なのは、極めて低解像度の場合に限られる。一方、高いイオン化確率13によって与えられて、DINeCは脱着分子を効率的に利用する。従って、DINeC-MSとイオンイメージング検出器38の組み合わせは非常に魅力的であると思われる。
Disclosures
The authors have nothing to disclose.
Acknowledgements
著者らは、ヘルムホルツ国際見本市センター(HICforFAIR)とヘルムホルツハドロン・アンド・イオン研究大学院(P.S.)からの資金援助を認めている。著者らは、ES-IBD/DINeC実験の組み合わせに関する実りあるコラボレーションに対するラウシェンバッハ教授(オックスフォード大学)と彼のチームに感謝する。
Materials
| Acetone rotisolv HPLC | Roth | 7328.2 | HPLC Gradient Grade |
| Copper tape | |||
| Ethanol rotisolv HPLC | Roth | p076.1 | HPLC Gradient Grade |
| Helium | Praxair | 4800086706 | Purity 99.9999% |
| Nitrogen | Praxair | 40728408 | Purity 99.5 – 100% |
| Silicon Wafers | Active Business Company GmbH | G60007 | |
| Sulfur dioxide | Air Liquide | P1734S10R0A001 | Purity 99.98% |
| Water rotisolv LC-MS | Roth | HN43.1 | Ultra LC-MS |
References
- Vickerman, J. C., Gilmore, I. . Surface Analysis: The Principal Techniques. , (2009).
- Reutzel, M., Münster, N., Lipponer, M. A., Länger, C., Höfer, U., Koert, U., Dürr, M. Chemoselective Reactivity of Bifunctional Cyclooctynes on Si(001). Journal of Physical Chemistry C. 120, 26284-26289 (2016).
- Grill, L., Dyer, M., Lafferentz, L., Persson, M., Peters, M., Hecht, S. Nano-architectures by covalent assembly of molecular building blocks. Nature Nanotechnol. 2, 687-691 (2007).
- Stutzmann, M., Garrido, J. A., Eickhoff, M., Brandt, M. S. Direct biofunctionalization of semiconductors: A survey. Physica Status Solidi A. 203, 3424-3437 (2006).
- Adler-Abramovich, L., Gazit, E. The physical properties of supramolecular peptide assemblies: from building block association to technological applications. Chemical Society Reviews. 43, 6881-6893 (2014).
- Vickerman, J. C., Briggs, D. . TOF-SIMS: Materials Analysis by Mass Spectrometry, 2nd ed. , (2013).
- Winograd, N. The magic of cluster SIMS. Analytical Chemistry. 77, 142-149 (2005).
- Ichiki, K., Ninomiya, S., Nakata, Y., Honda, Y., Seki, T., Aoki, T., Matsuo, J. High Sputtering Yields of Organic Compounds by Large Gas Cluster Ions. Applied Surface Science. 255, 1148-1150 (2008).
- Mochiji, K., Hashinokuchi, M., Moritani, K., Toyoda, N. Matrix-free Detection of Intact Ions from Proteins in Argon-Cluster Secondary Ion Mass Spectrometry. Rapid Communications in Mass Spectrometry. 23, 648-652 (2009).
- Yokoyama, Y., Aoyagi, S., Fujii, M., Matsuo, J., Fletcher, J. S., Lockyer, N. P., Vickerman, J. C., Passarelli, M. K., Havelund, R., Seah, M. P. Peptide Fragmentation and Surface Structural Analysis by Means of ToF-SIMS Using Large Cluster Ion Sources. Analytical Chemistry. 88, 3592-3597 (2016).
- Gebhardt, C. R., Tomsic, A., Schröder, H., Durr, M., Kompa, K. L. Matrix-Free Formation of Gas-Phase Biomolecular Ions by Soft Cluster-Induced Desorption. Angewandte Chemie, International Edition. 48, 4162-4165 (2009).
- Baur, M., Lee, B. J., Gebhardt, C. R., Durr, M. Soft Clusterinduced Desorption and Ionization of Biomolecules – Influence of Surface Load and Morphology on Desorption Efficiency. Applied Physics Letters. 99, 234103 (2011).
- Lee, B. J., Baur, M., Gebhardt, C. R., Durr, M. Quantification of the Ionization Probability During Desorption/Ionization of Oligopeptides Induced by Neutral Cluster Impact. Rapid Communications in Mass Spectrometry. 27, 1090-1094 (2013).
- Lee, B. J., Gebhardt, C. R., Schroder, H., Kompa, K. L., Durr, M. Observation of Ionic Desorption Channels in Cluster-induced Desorption of Alkali Halides – Influence of Surface Electronic Properties and Surface Configuration. Chemical Physics Letters. 556, 77-81 (2013).
- Baur, M., Gebhardt, C. R., Durr, M. Desorption/Ionization Induced by Neutral Cluster Impact as a Soft and Efficient Ionization Source for Ion Trap Mass Spectrometry of Biomolecules. Rapid Communications in Mass Spectrometry. 28, 290-296 (2014).
- Kley, C. S., Dette, C., Rinke, G., Patrick, C. E., Cechal, J., Jung, S. J., Baur, M., Durr, M., Rauschenbach, S., Giustino, F., Stepanow, S., Kern, K. Atomic-Scale Observation of Multiconformational Binding and Energy Level Alignment of Ruthenium-Based Photosensitizers on TiO2 Anatase. Nano Letters. 14, 563-569 (2014).
- Portz, A., Aoyagi, S., Durr, M. Soft depth-profiling of mixed peptide/lipid samples by means of cluster induced desorption/ionization mass spectrometry – high depth resolution and low matrix effect. Biointerphases. 13, 03B405 (2018).
- Portz, A., Baur, M., Gebhardt, C. R., Frank, A. J., Neuderth, P., Eickhoff, M., Durr, M. Influence of the Cluster Constituents’ Reactivity on the Desorption/Ionization Process Induced by Neutral SO2 Clusters. Journal of Chemical Physics. 146, 134705 (2017).
- Schneider, P., Durr, M. Cluster-induced desorption investigated by means of molecular dynamics simulations – Microsolvation in clusters of polar and non-polar constituents. Journal of Chemical Physics. 150, 214301 (2019).
- Karas, M., Hillenkamp, F. Laser Desorption Ionization of Proteins with Molecular Masses Exceeding 10 000 Daltons. Analytical Chemistry. 60, 2299-2301 (1988).
- Buchberger, A. R., DeLaney, K., Johnson, J., Li, L. Mass Spectrometry Imaging: A Review of Emerging Advancements and Future Insights. Analytical Chemistry. 90, 240-265 (2018).
- Portz, A., Gebhardt, C. R., Durr, M. Real-Time Investigation of the H/D Exchange Kinetics of Porphyrins and Oligopeptides by Means of Neutral Cluster-Induced Desorption/Ionization Mass Spectrometry. Journal of Physical Chemistry B. 121, 11031-11036 (2017).
- Portz, A., Baur, M., Rinke, G., Abb, S., Rauschenbach, S., Kern, K., Dürr, M. Chemical Analysis of Complex Surface-Adsorbed Molecules and Their Reactions by Means of Cluster-Induced Desorption/Ionization Mass Spectrometry. Analytical Chemistry. 90, 3328 (2018).
- Portz, A., Baur, M., Gebhardt, C. R., Durr, M. Mass Spectrometry of Oligopeptides in the Presence of Large Amounts of Alkali Halides Using Desorption/Ionization Induced by Neutral Cluster Impact. Biointerphases. 11, 02A316 (2016).
- Shard, A. G., Spencer, S. J., Smith, S. A., Havelund, R., Gilmore, I. S. . International Journal of Mass Spectrometry. 377, 599-609 (2015).
- Nakano, S., Yamagishi, T., Aoyagi, S., Portz, A., Durr, M., Iwai, H., Kawashima, T. Evaluation of Matrix Effects on TOF-SIMS Data of Leu-enkephalin and DOPC Mixed Samples. Biointerphases. 13, 03B403 (2018).
- Heep, J., Tuchecker, P. H. K., Gebhardt, C. R., Dürr, M. Coupling of planar chromatography to mass spectrometry. ACS Omega. 4, 22426-22430 (2019).
- Morlock, G., Schwack, W. Coupling of planar chromatography to mass spectrometry. Trends in Analytical Chemistry. 29, 1157-1171 (2010).
- Cheng, S. C., Huang, M. Z., Shiea, J. Thin layer chromatography/mass spectrometry. Journal of Chromatography A. 1218, 2700-2711 (2011).
- Takats, Z., Wiseman, J. M., Gologan, B., Cooks, R. G. Mass spectrometry sampling under ambient conditions with desorption electrospray ionization. Science. 306, 471 (2004).
- Cooks, R. G., Ouyang, Z., Takats, Z., Wiseman, J. M. Ambient mass spectrometry. Science. 311, 1566 (2006).
- Dürr, M., Gebhardt, C. Ion generation in mass spectrometers by cluster bombardment. US Patent. , (2019).
- Lindner, R., Kuhnle, A. Bottom-up Assembly of Molecular Wagons on a Surface. ChemPhysChem. 16, 1582-1592 (2015).
- Dong, L., Liu, P. N., Lin, N. Bottom-up Assembly of Molecular Wagons on a Surface. Accounts of Chemical Research. 48, 2765-2774 (2015).
- Björk, J. Reaction mechanisms for on-surface synthesis of covalent nanostructures. Journal of Physics: Condensed Matter. 28, 083002 (2016).
- Rauschenbach, S., Rinke, G., Gutzler, R., Abb, S., Albarghash, A., Le, D., Rahman, T. S., Durr, M., Harnau, L., Kern, K. Two-Dimensional Folding of Polypeptides into Molecular Nanostructures at Surfaces. ACS Nano. 11, 2420-2427 (2017).
- Dürr, M., Höfer, U. Dissociative adsorption of molecular hydrogen on silicon surfaces. Surface Science Reports. 61, 465-526 (2006).
- Zhang, J., Franzreb, K., Aksyonov, S. A., Williams, P. Mass Spectra and Yields of Intact Charged Biomolecules Ejected by Massive Cluster Impact for Bioimaging in a Time-of-Flight Secondary Ion Microscope. Analytical Chemistry. 87, 10779-10784 (2015).

