Bestemmelse af den funktionelle status af kortikospinaltarmkanalen inden for en uge efter slagtilfælde
Summary
Denne protokol er til evaluering af kortikospinaltarmkanalen funktion inden for 1 uge efter slagtilfælde. Det kan bruges til at vælge og stratificere patienter i forsøg med interventioner designet til at forbedre overekstremiteten motor opsving og resultater og i klinisk praksis for at forudsige overekstremiteten funktionelle resultater 3 måneder efter slagtilfælde.
Abstract
Høj interindividuel variation i inddrivelsen af øvre lemmer (UL) funktion efter slagtilfælde betyder, at det er vanskeligt at forudsige en persons potentiale for helbredelse baseret på kliniske vurderinger alene. Den funktionelle integritet af kortikospinaltarmkanalen er en vigtig prognose biomarkør for inddrivelse af UL funktion, især for dem med svær indledende UL værdiforringelse. Denne artikel præsenterer en protokol til evaluering af kortikospinaltarmkanalen funktion inden for 1 uge efter slagtilfælde. Denne protokol kan bruges til at udvælge og tilfredsstille patienter i forsøg med interventioner designet til at forbedre UL motor opsving og resultater efter slagtilfælde. Protokollen er også en del af PREP2-algoritmen, som forudsiger UL-funktionen for individuelle patienter 3 måneder efter slagtilfælde. Algoritmen sekventielt kombinerer en UL styrke vurdering, alder, transkraniel magnetisk stimulation, og slagtilfælde sværhedsgrad, inden for et par dage efter slagtilfælde. Fordelene ved at bruge PREP2 i klinisk praksis er beskrevet andetsteds. Denne artikel fokuserer på brugen af en UL styrkevurdering og transkraniel magnetisk stimulation til at evaluere kortikospinaltarmkanalen funktion.
Introduction
Øvre lemmer funktion er almindeligt nedsat efter slagtilfælde, og inddrivelse af UL funktion er vigtigt for at genvinde uafhængighed i daglige levende aktiviteter1. Slagtilfælde rehabilitering forsøg er ofte rettet mod at forbedre UL opsving og resultater efter slagtilfælde. Størstedelen af slagtilfælde rehabilitering forskning udføres med patienter på den kroniske fase (> 6 måneder efterslagtilfælde), men de fleste rehabilitering opstår tidligt efter slagtilfælde2,3. Mere forskning skal udføres med patienter kort efter et slagtilfælde til at opbygge et evidensgrundlag for rehabilitering praksis.
En af de største udfordringer, når de udfører forskning kort efter slagtilfælde er at opdage virkningerne af interventionen på baggrund af opsving forekommer i de første uger og måneder efter slagtilfælde. Høj variation i klinisk præsentation og nyttiggørelse skaber støj, der kan skjule de gavnlige virkninger af interventioner. Interventions- og kontrolgrupper er typisk afbalancerede på kliniske målinger af indledende neurologisk svækkelse. Disse foranstaltninger er dog ofte dårlige prædiktorer for patientens potentiale for efterfølgende helbredelse, især dem med svær indledende svækkelse4,5. Det betyder, at grupper kan matches for kliniske baselineforanstaltninger og ikke afstemmes for deres restitutionspotentiale, hvilket gør det vanskeligere at fastslå interventionens virkninger. Biomarkører kan tage fat på denne udfordring ved at identificere den enkelte patients potentiale for motornyttiggørelse, således at grupper kan matches nøjagtigt og stratificeret6,7,8. Biomarkører kan også anvendes til at udvælge patienter, der med størst sandsynlighed vil reagere på interventionens kendte eller hypotese virkningsmekanismer6.
Den funktionelle integritet af kortikospinaltarmkanalen (CST) er en vigtig biomarkør, der forudsiger inddrivelse af UL funktion efter slagtilfælde5,8,9,10,11,12. CST formidler faldende motoriske output fra den primære motoriske cortex til rygmarven og er afgørende for koordinering og finmotorik kontrol. Patienter med en funktionel CST efter slagtilfælde er mere tilbøjelige til at genvinde styrke, koordinering og fingerfærdighed end patienter uden. En klinisk vurdering kan være tilstrækkelig til at bekræfte , at CST er funktionel hos letforringede patienter13,14,15. Patienter med mere alvorlig indledende svækkelse kan dog eller måske ikke have en funktionel CST, og en neurofysiologisk vurdering ved hjælp af transkraniel magnetisk stimulation (TMS) er nødvendig9,10,11,16,17.
TMS er en noninvasive og smertefri teknik, der kan bruges til at teste CST funktion18. TMS-spolen leverer en magnetisk stimulans over den primære motoriske cortex, der genererer en faldende volley i CST, fremkalde en motor-fremkaldt potentiale (MEP) i musklerne i den kontralaterale lemmer19. Tilstedeværelsen af et medlem af Europa-Parlamentet i den paretiske arm eller hånd (MEP+) indikerer en funktionel CST og er forbundet med et større potentiale for genopretning af UL-funktionen. Patienter, der er mep-er mest tilbøjelige til at have værre UL opsving, uden tilbagevenden af koordinerede og behændig hånd funktion4,6,9,12,16.
Det er upraktisk og unødvendigt at teste alle patienter med TMS, da patienter med mild indledende svækkelse sandsynligvis har en funktionel CST17. Derfor er der behov for en hierarkisk tilgang, så TMS kun anvendes til patienter med mere alvorlig indledende svækkelse. PREP2-algoritmen blev udviklet ved hjælp af en kombination af kliniske foranstaltninger og TMS til evaluering af CST-funktion og forudsige sandsynligul-resultatet ved 3 måneders eftertryk (figur 1)17. PREP2 starter ved dag 3 efterslagtilfælde ved at teste styrken af skulder bortførelse og finger forlængelse i paretic arm (SAFE score), ved hjælp af Medical Research Council kvaliteter. Hvis summen af disse kvaliteter er 5 eller flere ud af 10, er det “sikkert” at antage, at patienten er MEP+. Disse patienter forventes at have en god eller fremragende UL resultat af 3 måneder efterslagtilfælde, afhængigt af deres alder17. Disse patienter behøver ikke TMS at bestemme MEP status, minimere omkostninger og unødvendige test for patienten.
Patienter med en SIKKER score på mindre end 5 på dag 3 eftertryk kræver TMS at bestemme den funktionelle integritet af deres CST. Hvis et medlem af Europa-Parlamentet kan fremkaldes fra de paretiske extensor carpi radialis (ECR) eller første dorsale interosseus (FDI) muskler, patienten er MEP + og forventes at genvinde fin motorisk kontrol af hånden med 3 måneder efterslagtilfælde. Ca. halvdelen af patienter med en SIKKER score mindre end 5 på dag 3 efter slagtilfælde er MEP +. Det er vigtigt, at patienterne kan have en sikker score helt ned til nul og være medlem af Europa-Parlamentet+. Dette illustrerer behovet for TMS i denne undergruppe af patienter, da klinisk vurdering alene ikke kan skelne mellem patienter med og uden en funktionel CST. Patienter, der er MEP- har betydelige CST skader. Disse patienter forventes at have en begrænset eller dårlig UL funktionelle resultat afhængigt af deres samlede slagtilfælde sværhedsgrad, målt med National Institute of Health Stroke Scale (NIHSS)(Figur 1)17. Disse patienter fra Europa-Parlamentet forventes ikke at genvinde koordineret og behændig fingerkontrol og kan grupperes sammen til forskningsformål.
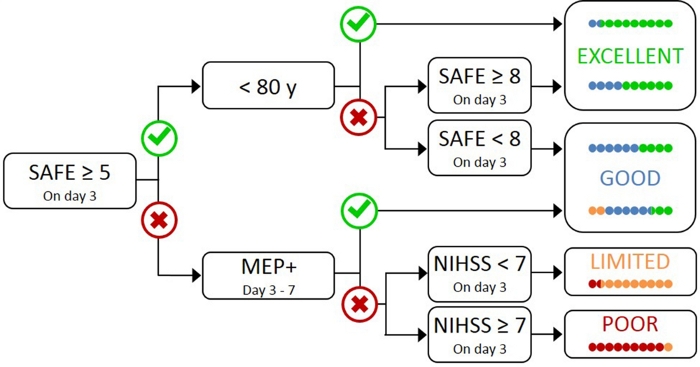
Figur 1: PREP2-algoritmen. SAFE = Skulder bortførelse, Finger Extension score, som er summen af Medical Research Council kvaliteter for hver af disse bevægelser ud af 5, for en samlet SIKKER score ud af 10. MEP+ = Motor Evoked Potentials kan fremkaldes fra den paretiske extensor carpi radialis (ECR) og/eller første dorsale interosseous (FDI) muskler i den paretiske UL ved hjælp af transkraniel magnetisk stimulation. NIHSS = National Institutes of Health Stroke Scale. Algoritmen forudsiger en af fire mulige UL funktionelle resultater på 3 måneder efterslagtilfælde. Hver forudsigelse kategori er forbundet med en rehabilitering fokus, der kan bruges til at skræddersy UL terapi2. De farvede prikker repræsenterer, proportionalt, PREP2 algoritme nøjagtighed. Prikkerne er farvekodede baseret på resultatet kategori faktisk opnået 3 måneder efterslagtilfælde (Grøn = Excellent; Blå = Godt; Orange = Begrænset; Rød = Dårlig). Figur gengivet fra Stinear et al.17. Klik her for at se en større version af denne figur.
I klinisk praksis forudsiger PREP2 en af fire resultatkategorier, der kan bruges til at skræddersy rehabilitering for individuelle patienter og hjælpe patienter og familier med at forstå, hvad de kan forvente for deres UL opsving. Til dato er PREP2 det eneste eksternt validerede UL-forudsigelsesværktøj, der kombinerer klinisk vurdering og biomarkøroplysninger i et beslutningstræ17. Det er også det eneste UL-forudsigelsesværktøj med forskning i virkningerne af gennemførelsen i klinisk praksis20,21. PREP2 forudsigelser er korrekte for omkring 75% af patienterne, for optimistisk for 17% og for pessimistisk for 8% af patienterne på 3 måneder efterslagtilfælde17. Nøjagtigheden er størst for mep-patienter (nøjagtig for 90 % af mep-patienterne), hvilket fremhæver værdien af at bruge TMS til at identificere disse patienter med alvorlige skader på de faldende motorveje17. PREP2 forbliver korrekt for omkring 80% af patienterne på 2 år efterslagtilfælde22. Dette understøtter brugen af PREP2 til at forudsige UL funktionelle motoriske resultater på 3 måneder og længere sigt. Oplysninger om levering af PREP2-forudsigelser og brug af dem i klinisk praksis ligger uden for rammerne af dette metodepapir, men detaljerede ressourcer er tilgængelige online23.
PREP2 giver forskerne et værktøj til at vælge og stratificere patienter til kliniske forsøg. Dette gør det muligt for patienter at blive grupperet ikke kun i henhold til baseline kliniske egenskaber, men også deres neurobiologiske potentiale for UL opsving. På trods af den stigende dokumentation for brugen af TMS som en prognose biomarkør for UL opsving, manglende kendskab til TMS protokoller i hospitalsmiljøer med subakut slagtilfælde patienter kan være en hindring for dens anvendelse i forskning. Derfor har denne protokol til formål at demonstrere, hvordan du bruger SAFE score og TMS til at evaluere CST funktion hos patienter på et hospital indstilling tidligt efter slagtilfælde.
Protocol
Representative Results
Discussion
CST-funktion evalueret med MEP-status er en vigtig prognose for UL-genoprettelse og resultat efter slagtilfælde. I alt 95% af patienter med en funktionel CST på 1 uge efterslagtilfælde opnå en Action Research Arm Test (ARAT) score på mindst 34 ud af 57 af 3 måneder efterslagtilfælde17. Omvendt, 100% af patienter uden en funktionel CST på 1 uge efterslagtilfælde opnå en ARAT score på mindre end 34 ved 3 måneder efterslagtilfælde17. Evaluering af CST funktion ind…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Forfatterne takker professor Winston Byblow og Harry Jordan for deres værdifulde bidrag til dette arbejde. Dette arbejde blev finansieret af Health Research Council of New Zealand.
Materials
| alcohol/skin cleansing wipes | Reynard | alcohol prep pads | |
| electromyography electrodes | 3M | red dot electrodes | |
| Magstim TMS coil | Magstim | flat figure-8 coil | |
| razors | any | ||
| skin prep tape | 3M | red dot skin prep tape | |
| TMS stimulator | Magstim | Magstim 200 single pulse stimulator |
References
- Veerbeek, J. M., Kwakkel, G., van Wegen, E. E., Ket, J. C., Heymans, M. W. Early prediction of outcome of activities of daily living after stroke: a systematic review. Stroke. 42 (5), 1482-1488 (2011).
- Lohse, K. R., Schaefer, S. Y., Raikes, A. C., Boyd, L. A., Lang, C. E. Asking New Questions with Old Data: The Centralized Open-Access Rehabilitation Database for Stroke. Frontiers in Neurology. 7, 153 (2016).
- Stinear, C., Ackerley, S., Byblow, W. Rehabilitation is initiated early after stroke, but most motor rehabilitation trials are not: a systematic review. Stroke. 44 (7), 2039-2045 (2013).
- Stinear, C. M. Prediction of recovery of motor function after stroke. Lancet Neurology. 9 (12), 1228-1232 (2010).
- Byblow, W. D., Stinear, C. M., Barber, P. A., Petoe, M. A., Ackerley, S. J. Proportional recovery after stroke depends on corticomotor integrity. Annals of Neurology. 78 (6), 848-859 (2015).
- Stinear, C. M. Prediction of motor recovery after stroke: advances in biomarkers. Lancet Neurology. 16 (10), 826-836 (2017).
- Kim, B., Winstein, C. Can Neurological Biomarkers of Brain Impairment Be Used to Predict Poststroke Motor Recovery? A Systematic Review. Neurorehabilitation and Neural Repair. 31 (1), 3-24 (2016).
- Boyd, L. A., et al. Biomarkers of stroke recovery: Consensus-based core recommendations from the Stroke Recovery and Rehabilitation Roundtable. International Journal of Stroke. 12 (5), 480-493 (2017).
- Escudero, J. V., Sancho, J., Bautista, D., Escudero, M., Lopez-Trigo, J. Prognostic value of motor evoked potential obtained by transcranial magnetic brain stimulation in motor function recovery in patients with acute ischemic stroke. Stroke. 29 (9), 1854-1859 (1998).
- Pennisi, G., et al. Absence of response to early transcranial magnetic stimulation in ischemic stroke patients: prognostic value for hand motor recovery. Stroke. 30 (12), 2666-2670 (1999).
- Rapisarda, G., Bastings, E., de Noordhout, A. M., Pennisi, G., Delwaide, P. J. Can motor recovery in stroke patients be predicted by early transcranial magnetic stimulation?. Stroke. 27 (12), 2191-2196 (1996).
- Bembenek, J. P., Kurczych, K., Karli Nski, M., Czlonkowska, A. The prognostic value of motor-evoked potentials in motor recovery and functional outcome after stroke – a systematic review of the literature. Functional Neurology. 27 (2), 79-84 (2012).
- Smania, N., et al. Active finger extension: a simple movement predicting recovery of arm function in patients with acute stroke. Stroke. 38 (3), 1088-1090 (2007).
- Nijland, R. H., van Wegen, E. E., Harmeling-van der Wel, B. C., Kwakkel, G. EPOS Investigators. Presence of finger extension and shoulder abduction within 72 hours after stroke predicts functional recovery: early prediction of functional outcome after stroke: the EPOS cohort study. Stroke. 41 (4), 745-750 (2010).
- Katrak, P., et al. Predicting upper limb recovery after stroke: the place of early shoulder and hand movement. Archives of Physical Medicine and Rehabilitation. 79 (7), 758-761 (1998).
- Stinear, C. M., Barber, P. A., Petoe, M., Anwar, S., Byblow, W. D. The PREP algorithm predicts potential for upper limb recovery after stroke. Brain. 135 (Pt 8), 2527-2535 (2012).
- Stinear, C. M., et al. PREP2: A biomarker-based algorithm for predicting upper limb function after stroke. Annals of Clinical and Translational Neurology. 4 (11), 811-820 (2017).
- Groppa, S., et al. A practical guide to diagnostic transcranial magnetic stimulation: report of an IFCN committee. Clinical Neurophysiology. 123 (5), 858-882 (2012).
- Barker, A. T., Jalinous, R., Freeston, I. L. Non-invasive magnetic stimulation of human motor cortex. Lancet. 1 (8437), 1106-1107 (1985).
- Stinear, C. M., Byblow, W. D., Ackerley, S. J., Barber, P. A., Smith, M. C. Predicting Recovery Potential for Individual Stroke Patients Increases Rehabilitation Efficiency. Stroke. 48 (4), 1011-1019 (2017).
- Connell, L. A., Smith, M. C., Byblow, W. D., Stinear, C. M. Implementing biomarkers to predict motor recovery after stroke. NeuroRehabilitation. 43 (1), 41-50 (2018).
- Smith, M. C., Ackerley, S. J., Barber, P. A., Byblow, W. D., Stinear, C. M. PREP2 Algorithm Predictions Are Correct at 2 Years Poststroke for Most Patients. Neurorehabilitation and Neural Repair. 33 (8), 635-642 (2019).
- Rossi, S., Hallett, M., Rossini, P. M., Pascual-Leone, A. Safety, ethical considerations, and application guidelines for the use of transcranial magnetic stimulation in clinical practice and research. Clinical Neurophysiology. 120 (12), 2008-2039 (2009).
- Talelli, P., Greenwood, R. J., Rothwell, J. C. Arm function after stroke: neurophysiological correlates and recovery mechanisms assessed by transcranial magnetic stimulation. Clinical Neurophysiology. 117 (8), 1641-1659 (2006).

