Determinazione dello stato funzionale del tratto Corticospinale entro una settimana dall'ictus
Summary
Questo protocollo è per la valutazione della funzione del tratto corticospinale entro 1 settimana dall’ictus. Può essere utilizzato per selezionare e stratificare i pazienti in sperimentazioni di interventi progettati per migliorare il recupero e gli esiti motori degli arti superiori e nella pratica clinica per prevedere gli esiti funzionali dell’arto superiore 3 mesi dopo l’ictus.
Abstract
L’elevata variabilità interindividuale nel recupero della funzione dell’arto superiore (UL) dopo l’ictus significa che è difficile prevedere il potenziale di recupero di un individuo basato solo su valutazioni cliniche. L’integrità funzionale del tratto corticospinale è un importante biomarcatore prognostico per il recupero della funzione UL, in particolare per quelli con grave compromissione iniziale UL. Questo articolo presenta un protocollo per la valutazione della funzione del tratto corticospinale entro 1 settimana dall’ictus. Questo protocollo può essere utilizzato per selezionare e stratificare i pazienti in sperimentazioni di interventi progettati per migliorare il recupero del motore UL e gli esiti dopo l’ictus. Il protocollo fa anche parte dell’algoritmo PREP2, che prevede la funzione UL per i singoli pazienti 3 mesi dopo l’ictus. L’algoritmo combina in sequenza una valutazione della forza UL, l’età, la stimolazione magnetica transcranica e la gravità dell’ictus, entro pochi giorni dall’ictus. I vantaggi dell’utilizzo di PREP2 nella pratica clinica sono descritti altrove. Questo articolo si concentra sull’uso di una valutazione della forza UL e della stimolazione magnetica transcranica per valutare la funzione del tratto corticospinale.
Introduction
La funzione dell’arto superiore è comunemente compromessa dopo l’ictus e il recupero della funzione UL è importante per riconquistare l’indipendenza nelle attività quotidiane1. Le prove di riabilitazione dell’ictus sono spesso volte a migliorare il recupero e gli esiti UL dopo l’ictus. La maggior parte della ricerca sulla riabilitazione dell’ictus è condotta con i pazienti in fase cronica (>6 mesi dopo l’ictus), ma la maggior parte della riabilitazione avviene presto dopo l’ictus2,3. Ulteriori ricerche devono essere condotte con i pazienti subito dopo un ictus per costruire una base di prova per la pratica di riabilitazione.
Una delle maggiori sfide quando si conduce la ricerca subito dopo l’ictus è rilevare gli effetti dell’intervento sullo sfondo del recupero che si verificano durante le settimane e i mesi iniziali dopo l’ictus. L’elevata variabilità intertesina nella presentazione clinica e nel recupero crea rumore che può oscurare gli effetti benefici degli interventi. I gruppi di intervento e di controllo sono in genere bilanciati su misure cliniche di compromissione neurologica iniziale. Tuttavia, queste misure sono spesso scarse predittori del potenziale del paziente per il successivo recupero, in particolare quelli con grave compromissione iniziale4,5. Ciò significa che i gruppi possono essere abbinati per le misure cliniche di base e non corrispondenti al loro potenziale di recupero, il che rende più difficile accertare gli effetti dell’intervento. I biomarcatori possono affrontare questa sfida identificando il potenziale di recupero motorio di un singolo paziente, in modo che i gruppi possano essere abbinati e stratificati accuratamente6,7,8. I biomarcatori possono essere utilizzati anche per selezionare i pazienti che hanno maggiori probabilità di rispondere ai meccanismi noti o ipotizzati dell’intervento di azione6.
L’integrità funzionale del tratto corticospinale (CST) è un biomarcatore chiave che prevede il recupero della funzione UL dopo il tratto5,8,9,10,11,12. Il CST trasmette l’uscita motoria discendente dalla corteccia motoria primaria al midollo spinale ed è essenziale per la coordinazione e il controllo motorio fine. I pazienti con un CST funzionale dopo l’ictus hanno maggiori probabilità di recuperare forza, coordinazione e destrezza rispetto ai pazienti senza. Una valutazione clinica può essere sufficiente a confermare che il CST è funzionale in pazienti con lieve compromissione13,14,15. Tuttavia, i pazienti con menomazione iniziale più grave possono o non possono avere un CST funzionale, e una valutazione neurofisiologica utilizzando stimolazione magnetica transcranica (TMS) è necessaria9,10,11,16,17.
TMS è una tecnica non invasiva e indolore che può essere utilizzata per testare la funzione CST18. La bobina TMS fornisce uno stimolo magnetico sulla corteccia motoria primaria che genera una raffica discendente nel CST, suscitando un potenziale motor-evokeed (MEP) nei muscoli dell’arto contralaterale19. La presenza di un deputato nel braccio o nella mano a foneture (MEP) indica un CST funzionale ed è associata a un maggiore potenziale di recupero della funzione UL. I pazienti che sono MEP- hanno più probabilità di avere un peggior recupero dell’UL, senza ritorno della funzione della mano coordinata e abile4,6,9,12,16.
Testare tutti i pazienti con TMS è poco pratico e inutile, in quanto quelli con lieve compromissione iniziale molto probabilmente hanno un CSTfunzionale 17. Pertanto, è necessario un approccio gerarchico in modo che il TMS venga utilizzato solo per i pazienti con disabilità iniziale più grave. L’algoritmo PREP2 è stato sviluppato utilizzando una combinazione di misure cliniche e TMS per valutare la funzione CST e prevedere il probabile risultato dell’UL a 3 mesi dopo l’ictus (Figura 1)17. PREP2 inizia al terzo giorno testando la forza del rapimento della spalla e l’estensione delle dita nel braccio paretico (punteggio SAFE), utilizzando i gradi del Medical Research Council. Se la somma di questi gradi è 5 o più su 10, è “sicuro” presumere che il paziente sia MEP. Questi pazienti sono tenuti ad avere un buon o eccellente esito UL da 3 mesi post-ictus, a seconda della loro età17. Questi pazienti non hanno bisogno di TMS per determinare lo stato di eurodeputato, riducendo al minimo i costi e test inutili per il paziente.
I pazienti con un punteggio SAFE inferiore a 5 il giorno 3 poststroke richiedono TMS per determinare l’integrità funzionale del loro CST. Se un eurodeputato può essere espulso dai muscoli dell’estensore delle pareti (ECR) o del primo interosseus dorsale (FDI), il paziente è MEP e si prevede che riprenda il controllo motorio fine della mano di 3 mesi dopo l’ictus. Circa la metà dei pazienti con un punteggio SAFE inferiore a 5 il giorno 3 poststroke sono MEP. È importante sottolineare che i pazienti possono avere un punteggio SAFE a partire da zero ed essere MEP. Ciò illustra la necessità di TMS in questo sottogruppo di pazienti, in quanto la valutazione clinica da sola non può distinguere tra pazienti con e senza un CST funzionale. I pazienti che sono eurodeputati- hanno danni CST significativi. Questi pazienti dovrebbero avere un esito funzionale dell’UL limitato o scarso a seconda della loro gravità complessiva dell’ictus, misurato con il National Institute of Health Stroke Scale (NIHSS) (Figura 1)17. Questi pazienti eurodeputati non dovrebbero riacquistare il controllo coordinato e abile delle dita e possono essere raggruppati per scopi di ricerca.
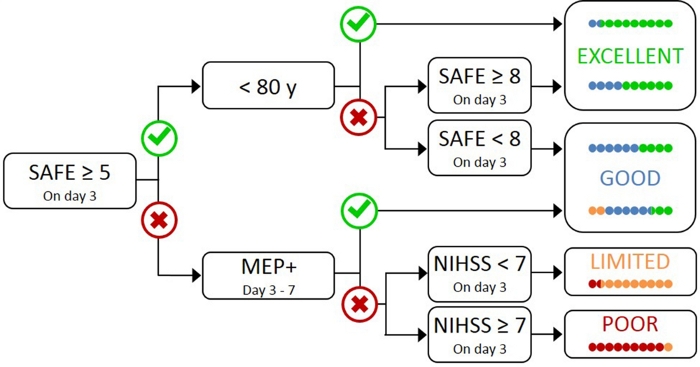
Figura 1: Algoritmo PREP2. SAFE – Rapimento alla spalla, punteggio di estensione delle dita, che è la somma dei gradi del Medical Research Council per ciascuno di questi movimenti su 5, per un punteggio SAFE totale su 10. I potenziali evocati dal motore possono essere suscitati dai muscoli estensori carpi radialis (ECR) e/o primi muscoli parosali dorsali (FDI) del UL paretico utilizzando la stimolazione magnetica transcranica. NIHSS – Istituti nazionali di ictus di salute Scala. L’algoritmo prevede uno dei quattro possibili risultati funzionali UL a 3 mesi dopo il colpo. Ogni categoria di previsione è associata a un focus di riabilitazione che può essere utilizzato per personalizzare la terapia UL2. I punti colorati rappresentano proporzionalmente la precisione dell’algoritmo PREP2. I punti sono codificati a colori in base alla categoria dei risultati effettivamente raggiunto 3 mesi dopo colpo (Verde – Eccellente; Blu – Buono; Arancione – Limitato; Rosso e Scarso). Figura riprodotta da Stinear etal. Fare clic qui per visualizzare una versione più grande di questa figura.
Nella pratica clinica, PREP2 prevede una delle quattro categorie di risultati che possono essere utilizzate per personalizzare la riabilitazione per singoli pazienti e aiutare i pazienti e le famiglie a capire cosa possono aspettarsi per il loro recupero dell’UL. Ad oggi, PREP2 è l’unico strumento di previsione UL convalidato esternamente che combina la valutazione clinica e le informazioni sui biomarcatori in un albero delle decisioni17. È anche l’unico strumento di previsione UL con ricerca sugli effetti dell’attuazione nella pratica clinica20,21. Le previsioni di PREP2 sono accurate per circa il 75% dei pazienti, troppo ottimistiche per il 17% e troppo pessimistiche per l’8% dei pazienti a 3 mesi dopo l’ictus17. L’accuratezza è più elevata per i pazienti MEP (accurata per il 90% dei pazienti MEP), evidenziando il valore dell’utilizzo di TMS per identificare questi pazienti con gravi danni alle vie motorie decrescenti17. PREP2 rimane corretto per circa l’80% dei pazienti a 2 anni post-ictus22. Questo supporta l’uso di PREP2 per prevedere gli esiti motori funzionali UL a 3 mesi e più a lungo termine. Le informazioni sulla fornitura di previsioni PREP2 e sul loro utilizzo nella pratica clinica non rientrano nell’ambito di questo documento sui metodi, ma le risorse dettagliate sono disponibili online23.
PREP2 fornisce ai ricercatori uno strumento per selezionare e stratificare i pazienti per gli studi clinici. Questo permette ai pazienti di essere raggruppati non solo in base alle caratteristiche cliniche di base, ma anche il loro potenziale neurobiologico per il recupero dell’UL. Nonostante le prove crescenti per l’uso di TMS come biomarcatore prognostico per il recupero dell’UL, la mancanza di familiarità con i protocolli TMS in ambienti ospedalieri con pazienti colpiti da ictus subacuta può essere una barriera al suo utilizzo nella ricerca. Pertanto, questo protocollo ha lo scopo di dimostrare come utilizzare il punteggio SAFE e TMS per valutare la funzione CST nei pazienti in un ambiente ospedaliero precocedopo l’ictus.
Protocol
Representative Results
Discussion
La funzione CST valutata con lo stato di MEP è un biomarcatore prognostico chiave per il recupero e il risultato dell’UL dopo l’ictus. Un totale di 95% dei pazienti con un CST funzionale a 1 settimana dopo colpo raggiungere un punteggio di Action Research Arm Test (ARAT) di almeno 34 su 57 da 3 mesi poststroke17. Al contrario, il 100% dei pazienti senza un CST funzionale a 1 settimana dopo colpo raggiungono un punteggio ARAT inferiore a 34 da 3 mesi post-corsa17. La valuta…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Gli autori ringraziano il professor Winston Byblow e Harry Jordan per il loro prezioso contributo a quest’opera. Questo lavoro è stato finanziato dal Health Research Council della Nuova .
Materials
| alcohol/skin cleansing wipes | Reynard | alcohol prep pads | |
| electromyography electrodes | 3M | red dot electrodes | |
| Magstim TMS coil | Magstim | flat figure-8 coil | |
| razors | any | ||
| skin prep tape | 3M | red dot skin prep tape | |
| TMS stimulator | Magstim | Magstim 200 single pulse stimulator |
References
- Veerbeek, J. M., Kwakkel, G., van Wegen, E. E., Ket, J. C., Heymans, M. W. Early prediction of outcome of activities of daily living after stroke: a systematic review. Stroke. 42 (5), 1482-1488 (2011).
- Lohse, K. R., Schaefer, S. Y., Raikes, A. C., Boyd, L. A., Lang, C. E. Asking New Questions with Old Data: The Centralized Open-Access Rehabilitation Database for Stroke. Frontiers in Neurology. 7, 153 (2016).
- Stinear, C., Ackerley, S., Byblow, W. Rehabilitation is initiated early after stroke, but most motor rehabilitation trials are not: a systematic review. Stroke. 44 (7), 2039-2045 (2013).
- Stinear, C. M. Prediction of recovery of motor function after stroke. Lancet Neurology. 9 (12), 1228-1232 (2010).
- Byblow, W. D., Stinear, C. M., Barber, P. A., Petoe, M. A., Ackerley, S. J. Proportional recovery after stroke depends on corticomotor integrity. Annals of Neurology. 78 (6), 848-859 (2015).
- Stinear, C. M. Prediction of motor recovery after stroke: advances in biomarkers. Lancet Neurology. 16 (10), 826-836 (2017).
- Kim, B., Winstein, C. Can Neurological Biomarkers of Brain Impairment Be Used to Predict Poststroke Motor Recovery? A Systematic Review. Neurorehabilitation and Neural Repair. 31 (1), 3-24 (2016).
- Boyd, L. A., et al. Biomarkers of stroke recovery: Consensus-based core recommendations from the Stroke Recovery and Rehabilitation Roundtable. International Journal of Stroke. 12 (5), 480-493 (2017).
- Escudero, J. V., Sancho, J., Bautista, D., Escudero, M., Lopez-Trigo, J. Prognostic value of motor evoked potential obtained by transcranial magnetic brain stimulation in motor function recovery in patients with acute ischemic stroke. Stroke. 29 (9), 1854-1859 (1998).
- Pennisi, G., et al. Absence of response to early transcranial magnetic stimulation in ischemic stroke patients: prognostic value for hand motor recovery. Stroke. 30 (12), 2666-2670 (1999).
- Rapisarda, G., Bastings, E., de Noordhout, A. M., Pennisi, G., Delwaide, P. J. Can motor recovery in stroke patients be predicted by early transcranial magnetic stimulation?. Stroke. 27 (12), 2191-2196 (1996).
- Bembenek, J. P., Kurczych, K., Karli Nski, M., Czlonkowska, A. The prognostic value of motor-evoked potentials in motor recovery and functional outcome after stroke – a systematic review of the literature. Functional Neurology. 27 (2), 79-84 (2012).
- Smania, N., et al. Active finger extension: a simple movement predicting recovery of arm function in patients with acute stroke. Stroke. 38 (3), 1088-1090 (2007).
- Nijland, R. H., van Wegen, E. E., Harmeling-van der Wel, B. C., Kwakkel, G. EPOS Investigators. Presence of finger extension and shoulder abduction within 72 hours after stroke predicts functional recovery: early prediction of functional outcome after stroke: the EPOS cohort study. Stroke. 41 (4), 745-750 (2010).
- Katrak, P., et al. Predicting upper limb recovery after stroke: the place of early shoulder and hand movement. Archives of Physical Medicine and Rehabilitation. 79 (7), 758-761 (1998).
- Stinear, C. M., Barber, P. A., Petoe, M., Anwar, S., Byblow, W. D. The PREP algorithm predicts potential for upper limb recovery after stroke. Brain. 135 (Pt 8), 2527-2535 (2012).
- Stinear, C. M., et al. PREP2: A biomarker-based algorithm for predicting upper limb function after stroke. Annals of Clinical and Translational Neurology. 4 (11), 811-820 (2017).
- Groppa, S., et al. A practical guide to diagnostic transcranial magnetic stimulation: report of an IFCN committee. Clinical Neurophysiology. 123 (5), 858-882 (2012).
- Barker, A. T., Jalinous, R., Freeston, I. L. Non-invasive magnetic stimulation of human motor cortex. Lancet. 1 (8437), 1106-1107 (1985).
- Stinear, C. M., Byblow, W. D., Ackerley, S. J., Barber, P. A., Smith, M. C. Predicting Recovery Potential for Individual Stroke Patients Increases Rehabilitation Efficiency. Stroke. 48 (4), 1011-1019 (2017).
- Connell, L. A., Smith, M. C., Byblow, W. D., Stinear, C. M. Implementing biomarkers to predict motor recovery after stroke. NeuroRehabilitation. 43 (1), 41-50 (2018).
- Smith, M. C., Ackerley, S. J., Barber, P. A., Byblow, W. D., Stinear, C. M. PREP2 Algorithm Predictions Are Correct at 2 Years Poststroke for Most Patients. Neurorehabilitation and Neural Repair. 33 (8), 635-642 (2019).
- Rossi, S., Hallett, M., Rossini, P. M., Pascual-Leone, A. Safety, ethical considerations, and application guidelines for the use of transcranial magnetic stimulation in clinical practice and research. Clinical Neurophysiology. 120 (12), 2008-2039 (2009).
- Talelli, P., Greenwood, R. J., Rothwell, J. C. Arm function after stroke: neurophysiological correlates and recovery mechanisms assessed by transcranial magnetic stimulation. Clinical Neurophysiology. 117 (8), 1641-1659 (2006).

