Approche systématique pour identifier les nouvelles molécules antimicrobiennes et antibiofilms à partir d’extraits et de fractions de plantes pour prévenir les caries dentaires
Summary
Les produits naturels représentent des points de départ prometteurs pour le développement de nouveaux médicaments et agents thérapeutiques. Cependant, en raison de la grande diversité chimique, trouver de nouveaux composés thérapeutiques à partir des plantes est une tâche difficile et longue. Nous décrivons une approche simplifiée pour identifier les molécules antimicrobiennes et antibiofilms à partir d’extraits de plantes et de fractions.
Abstract
Les produits naturels fournissent des substances structurellement différentes, avec une myriade d’activités biologiques. Toutefois, l’identification et l’isolement des composés actifs par rapport aux plantes sont difficiles en raison de la matrice complexe des plantes et des procédures d’isolement et d’identification qui prennent beaucoup de temps. Par conséquent, une approche stepwise pour le criblage des composés naturels des usines, y compris l’isolement et l’identification des molécules potentiellement actives, est présentée. Il comprend la collecte du matériel végétal; préparation et fractionnement d’extraits bruts; les approches de chromatographie et de spectrométrie (UHPLC-DAD-HRMS et NMR) pour l’analyse et l’identification des composés; bioassays (activités antimicrobiennes et antibiofilms; « force d’adhérence » bactérienne à la pellicle salivaire et matrice de glucane initiale traitée avec des traitements sélectionnés); et l’analyse des données. Le modèle est simple, reproductible, et permet un criblage à haut débit de plusieurs composés, concentrations et étapes de traitement peuvent être constamment contrôlés. Les données obtenues fournissent les bases d’études futures, y compris des formulations avec les extraits et/ou fractions les plus actifs, l’isolement des molécules, la modélisation des molécules à des cibles spécifiques dans les cellules microbiennes et les biofilms. Par exemple, une cible pour contrôler le biofilm cariogenic est d’inhiber l’activité des glucosyltransferases de Streptococcus mutans qui synthétisent les glucanes de la matrice extracellulaire. L’inhibition de ces enzymes empêche l’accumulation de biofilm, diminuant sa virulence.
Introduction
Les premiers modèles de médecine utilisés dans les sociétés étaient basés sur des produits naturels (PN). Depuis lors, les humains ont été à la recherche de nouveaux produits chimiques dans la nature qui peuvent être transformés enmédicaments 1. Cette recherche a entraîné une amélioration continue des technologies et des méthodes de dépistage ethnobotanique1,2,3. Les PN offrent une riche source de substances structurellement diversifiées, avec un large éventail d’activités biologiques utiles pour développer des thérapies alternatives ou adjuvantes. Toutefois, la matrice végétale complexe inhérente fait de l’isolement et de l’identification des composés actifs une tâche difficile et fastidieuse4.
Les médicaments ou formulations à base de PN peuvent être utilisés pour prévenir et/ou traiter plusieurs affections affectant l’oral, y compris les caries dentaires4. Caries dentaires, l’une des maladies chroniques les plus répandues dans le monde, dérive de l’interaction de l’alimentation riche en sucre et biofilms microbiens (plaque dentaire) formés sur la surface des dents qui conduit à la déminéralisation causée par des acides organiques dérivés du métabolisme microbien, et si elle n’est pas traitée, conduit à la perte dedents 5,6. Bien que d’autres micro-organismes puissentêtre associés 7, Streptococcus mutans est une bactérie cariogenic critique parce qu’elle est acidogène, acidurique, et un constructeur extracellulaire de matrice. Cette espèce code plusieurs exoenzymes (p. ex., glycosyltransferases ou Gtfs) qui utilisent le saccharose comme substrat8 pour construire la matrice extracellulaire riche en exopolysaccharides, qui sont un déterminant de la virulence9. En outre, le champignon Candida albicans peut conduire jusqu’à la production de cette matrice extracellulaire7. Bien que le fluorure, administré dans diverses modalités, reste la base pour prévenir les caries dentaires10, de nouvelles approches sont nécessaires comme adjuvants pour augmenter son efficacité. De plus, les modalités anti plaque disponibles sont fondées sur l’utilisation d’agents microbicides à large spectre (p. ex., chlorhexidine)11. Comme alternative, les PN sont des thérapies potentielles pour contrôler les biofilms et prévenir les cariesdentaires 12,13.
Les progrès supplémentaires réalisés dans la découverte de nouveaux composés bioactifs provenant de plantes comprennent les étapes ou les approches nécessaires telles que : (i) l’utilisation de protocoles fiables et reproductibles pour l’échantillonnage, étant donné que les plantes présentent souvent une variabilité intraspécifique; (ii) la préparation d’extraits complets et de leurs fractions respectives à petite échelle; iii) la caractérisation et/ou la dréplication de leurs profils chimiques pensaient à l’acquisition de données multidimensionnelles telles que GC-MS, LC-DAD-MS ou NMR, par exemple; iv) l’utilisation de modèles viables et à haut rendement pour évaluer la bioactivité; v) la sélection de nouveaux résultats potentiels basés sur une analyse multivariante des données ou d’autres outils statistiques; vi) d’effectuer l’isolement et la purification des composés ciblés ou des candidats prometteurs; et (vii) la validation des activités biologiques correspondantes à l’aide des composés isolés2,14.
La dréplication est le processus d’identification rapide des composés connus dans l’extrait brut et permet de différecier de nouveaux composés de ceux qui ont déjà été étudiés. En outre, ce processus empêche l’isolement lorsque la bioactivité a déjà été décrite pour certains composés, et il est particulièrement utile de détecter les « frappeurs fréquents ». Il a été utilisé dans différents flux de travail non ciblés allant de l’identification des composés majeurs ou l’accélération de la fractionnement guidé par l’activité jusqu’au profilage chimique des collections d’extraits. Il peut être entièrement intégré avec des études métabolomiques pour le profilage chimique non ciblé de ce ou l’identification ciblée des métabolites. Tout cela conduit finalement à hiérarchiser les extraits avant les procéduresd’isolement 1,15,16,17.
Par conséquent, dans le présent manuscrit, nous décrivons une approche systématique pour identifier les molécules antimicrobiennes et antibiofilms à partir d’extraits végétaux et de fractions. Il comprend quatre étapes multidisciplinaires : (1) la collecte de matériel végétal; (2) la préparation d’extraits bruts (CE) et de fractions (CEF), suivie de leur analyse du profil chimique; (3) bioassays; et (4) les analyses de données biologiques et chimiques (figure 1). Ainsi, nous présentons le protocole développé pour analyser les activités antimicrobiennes et antibiofilms des extraits et fractions de Casearia sylvestris contre streptococcus mutans et candida albicans13, ainsi que les procédures de caractérisation phytochimique et d’analyse des données. Par souci de simplicité, l’objectif ici est de démontrer l’approche de dépistage des composés naturels à l’aide de la bactérie.
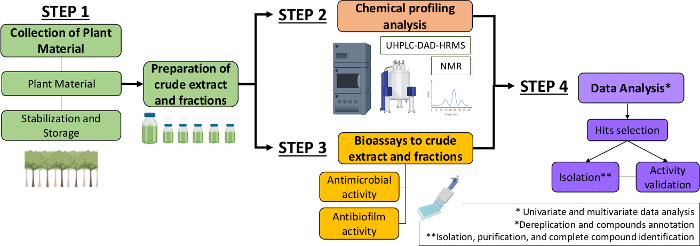
Figure 1 : Diagramme de flux de l’approche systématique pour identifier les molécules actives à partir d’extraits et de fractions de plantes. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Protocol
Representative Results
Discussion
Les principaux défis liés au travail avec des extraits bruts naturels comprennent leur composition complexe et les insuffisances des études classiques d’isolement bioguidé. Bien que ce processus soit lent, il est efficace et a mené à des résultats majeurs dans la recherche sur les PN. Pour rationaliser, des études axées sur la hiérarchisation sont nécessaires pour rationaliser. Ainsi, l’utilisation d’approches modernes de profilage chimique pour l’analyse de l’EC et la redondant avant l’isolement s…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Nous exprimons notre gratitude à Núcleo de Bioensaios, Biossíntese e Ecofisiologia de Produtos Naturais (NuBBE) de l’Institut de chimie de l’UNESP, Araraquara/SP pour avoir fourni les laboratoires pour la préparation du matériel végétal. Nous remercions également le Laboratoire de microbiologie appliquée du Département des matériaux dentaires et de la prosthodontie, l’UNESP, Araraquara/SP. Cette recherche a été appuyée par une subvention de recherche de la São Paulo Research Foundation (FAPESP #2013/07600-3 à l’AJC) et des bourses d’études ainsi que des fonds généraux (FAPESP #2017/07408-6 et FAPESP #2019/23175-7 au SMR; #2011/21440-3 et #2012/21921-4 au PCPB). Le Conseil national du développement scientifique et technologique, en association avec la FAPESP, a apporté un soutien supplémentaire (INCT CNPq #465637/2014-0 et FAPESP #2014/50926-0 à l’AJC).
Materials
| 96-well microplates | Kasvi | Flat bottom | |
| Activated carbon | LABSYNTH | Clean up and/or fractionation step | |
| Analytical mill | Ika LabortechniK | Model A11 Basic | |
| Blood agar plates | Laborclin | ||
| Chromatographic column C18 | Phenomenex Kinetex | 150 × 2.1 mm, 2.6 µm, 100Â | |
| Dimethyl sulfoxide | Sigma-Aldrich | Vehicle solution | |
| ELISA plate reader | Biochrom Ez | ||
| Ethanol | J. T. Baker | For extraction and fractionation steps, and mobile phase composition | |
| Ethanol | Sigma-Aldrich | Vehicle solution | |
| Ethyl acetate | J. T. Baker | Fractionation step | |
| GraphPad Software | La Jolla | GraphPad Prism7 | |
| Hexane | J. T. Baker | Fractionation step | |
| Incubator | Thermo Scientific | ||
| Isopropanol | J. T. Baker | For extraction step | |
| Lyophilizer (a freeze dryer) | Savant | Modulyo | |
| Nylon Millipore | LAC | 0.22 µm x 13 mm | |
| Orbital shaker | Quimis | Model G816 M20 | |
| Polyamide solid phase extraction cartridge | Macherey-Nagel | Clean up and/or fractionation step | |
| Silica gel | Merck | 40–63 μm, 60 Â | |
| Sodium Chloride (NaCl) | Synth | 0,89% in water | |
| Solid phase extraction cartridges (SPE) | Macherey-Nagel | Clean up and/or fractionation step | |
| Tryptone | Difco | ||
| UHPLC-DAD | Dionex | Ultimate 3000 RS | |
| Ultrasonic bath | UNIQUE | Model USC 2800 | |
| Yeast extract | Difco |
References
- Newman, D. J., Cragg, G. M. Natural Products as Sources of New Drugs over the Nearly Four Decades from 01/1981 to 09/2019. Journal of Natural Products. 83 (3), 770-803 (2020).
- Wolfender, J. L., Litaudon, M., Touboul, D., Queiroz, E. F. Innovative omics-based approaches for prioritisation and targeted isolation of natural products – new strategies for drug discovery. Natural Product Report. 36 (6), 855-868 (2019).
- Michel, T., Halabalaki, M., Skaltsounis, A. New Concepts, Experimental Approaches, and Dereplication Strategies for the Discovery of Novel Phytoestrogens from Natural Sources. Planta Medica. 79 (7), 514-532 (2013).
- Jeon, J. G., Rosalen, P. L., Falsetta, M. L., Koo, H. Natural products in caries research: current (limited) knowledge, challenges and future perspective. Caries Research. 45 (3), 243-263 (2011).
- Tonetti, M. S., Jepsen, S., Jin, L., Otomo-Corgel, J. Impact of the global burden of periodontal diseases on health, nutrition and wellbeing of mankind: A call for global action. Journal of Clinical Periodontology. 44 (5), 456-462 (2017).
- Peres, M. A., et al. Oral diseases: a global public health challenge. Lancet. 394 (10194), 249-260 (2019).
- Bowen, W. H., Burne, R. A., Wu, H., Koo, H. Oral biofilms: pathogens, matrix, and polymicrobial interactions in microenvironments. Trends Microbiology. 26 (3), 229-242 (2018).
- Paes Leme, A. F., Koo, H., Bellato, C. M., Bedi, G., Cury, J. A. The role of sucrose in cariogenic dental biofilm formation–new insight. Journal of Dental Research. 85 (10), 878-887 (2006).
- Koo, H., Falsetta, M. L., Klein, M. I. The exopolysaccharide matrix: a virulence determinant of cariogenic biofilm. Journal of Dental Research. 92 (12), 1065-1073 (2013).
- Cury, J. A., de Oliveira, B. H., dos Santos, A. P., Tenuta, L. M. Are dental fluoride releasing materials clinically effective on caries control. Dental Materials. 32 (3), 323-333 (2016).
- Mattos-Graner, R. O., Klein, M. I., Smith, D. J. Lessons Learned from Clinical Studies: Roles of Mutans Streptococci in the Pathogenesis of Dental Caries. Current Oral Health Reports. 1, 70-78 (2014).
- Rocha, G. R., Florez Salamanca, E. J., de Barros, A. L., Lobo, C. I. V., Klein, M. I. Effect of tt-farnesol and myricetin on in vitro biofilm formed by Streptococcus mutans and Candida albicans. BMC Complementary and Alternative Medicine. 18 (1), 61 (2018).
- Ribeiro, S. M., et al. Antimicrobial and antibiofilm activities of Casearia sylvestris extracts from distinct Brazilian Biomes against Streptococcus mutans and Candida albicans. BMC Complementary and Alternative Medicine. 19 (1), 308 (2019).
- Pilon, A. C., et al. Metabolômica de plantas: métodos e desafios. Quimica Nova. 43 (3), 329-354 (2020).
- Wolfender, J. L., Nuzillard, J. M., Hooft, J. J. J., Renault, J. H., Bertrand, S. Accelerating Metabolite Identification in Natural Product Research: Toward an Ideal Combination of Liquid Chromatography-High-Resolution Tandem Mass Spectrometry and NMR Profiling, in Silico Databases, and Chemometrics. Analytical Chemistry. 91 (1), 704-742 (2019).
- Allard, P. M., et al. Pharmacognosy in the digital era: shifting to contextualized metabolomics. Current opinion in biotechnology. 54, 57-64 (2018).
- Hubert, J., Nuzillard, J., Renault, J. Dereplication strategies in natural product research: How many tools and methodologies behind the same concept. Phytochemistry Reviews. 16, 55-95 (2017).
- Bueno, P. C. P., Pereira, F. M. V., Torres, R. B., Cavalheiro, A. J. Development of a comprehensive method for analysing clerodane-type diterpenes and phenolic compounds from Casearia sylvestris Swartz (Salicaceae) based on ultra-high performance liquid chromatography combined with chemometric tools. Journal of separation science. 38 (10), 1649-1656 (2015).
- Bueno, P. C. P., Lopes, N. P. Metabolomics to Characterize Adaptive and Signaling Responses in Legume Crops under Abiotic Stresses. American Chemical Society omega. 5 (4), 1752-1763 (2020).
- Blaženović, I., Kind, T., Ji, J., Fiehn, O. Software tools and approaches for compound identification of LC-MS/MS data in metabolomics. Metabolites. 8 (2), 31 (2018).
- Eloff, J. N. Quantifying the bioactivity of plant extracts during screening and bioassay-guided fractionation. Phytomedicine: International Journal Of Phytotherapy And Phytopharmacology. 11 (4), 370-371 (2004).
- Rios, J. L., Recio, M. C. Medicinal plants and antimicrobial activity. Journal of Ethnopharmacology. 100 (1-2), 80-84 (2005).
- Eloff, J. N. A sensitive and quick microplate method to determine the minimal inhibitory concentration of plant extracts for bacteria. Planta Medica. 64, 711-714 (1998).
- Eloff, J. N. Avoiding pitfalls in determining antimicrobial activity of plant extracts and publishing the results. BMC Complementary and Alternative Medicine. 19 (1), 106 (2019).
- Klein, M. I., Xiao, J., Heydorn, A., Koo, H. An analytical tool-box for comprehensive biochemical, structural and transcriptome evaluation of oral biofilms mediated by mutans streptococci. Journal of Visualized Experiments. (47), e2512 (2011).
- Lemos, J. A., Abranches, J., Koo, H., Marquis, R. E., Burne, R. A. Protocols to study the physiology of oral biofilms. Methods in molecular biology. 666, 87-102 (2010).
- Venkitaraman, A. R., Vacca-Smith, A. M., Kopec, L. K., Bowen, W. H. Characterization of glucosyltransferase B, GtfC, and GtfD in solution and on the surface of hydroxyapatite. Journal of Dental Research. 74, 1695-1701 (1995).
- Vacca-Smith, A. M., Venkitaraman, A. R., Quivey, R. G., Bowen, W. H. Interactions of streptococcal glucosyltransferases with alpha-amylase and starch on the surface of saliva-coated hydroxyapatite. Archives of Oral Biology. 41, 291-298 (1996).
- Van Dijck, P., et al. Methodologies for in vitro and in vivo evaluation of efficacy of antifungal and antibiofilm agents and surface coatings against fungal biofilms. Microbial Cell. 5 (7), 300-326 (2018).
- Marsh, P. D. Are dental diseases examples of ecological catastrophes. Microbiology. 149 (2), 279-294 (2003).
- Bowen, W. H., Koo, H. Biology of Streptococcus mutans-derived glucosyltransferases: role in extracellular matrix formation of cariogenic biofilms. Caries Research. 45 (1), 69-86 (2011).
- Lobo, C. I. V., et al. Dual-species biofilms of Streptococcus mutans and Candida albicans exhibit more biomass and are mutually beneficial compared with single-species biofilms. Journal of Oral Microbioly. 11 (1), 1581520 (2019).
- Kim, D., et al. Candida albicans stimulates Streptococcus mutans microcolony development via crosskingdom biofilm-derived metabolites. Scientific reports. 7, 41332 (2017).
- Ferreira, P. M. Folk uses and pharmacological properties of Casearia sylvestris: a medicinal review. Anais da Academia Brasileira de Ciencias. 83 (4), 1373-1384 (2011).
- Xia, L., Guo, Q., Tu, P., Chai, X. The genus Casearia: a phytochemical and pharmacological overview. Phytochemistry Reviews. 14, 99-135 (2015).
- Ferreira, P. M. P., et al. Toxicological findings about an anticancer fraction with casearins described by traditional and alternative techniques as support to the Brazilian Unified Health System (SUS). Journal of Ethnopharmacol. 15, 241 (2019).
- Koo, H., Xiao, J., Klein, M. I., Jeon, J. G. Exopolysaccharides produced by Streptococcus mutans glucosyltransferases modulate the establishment of microcolonies within multispecies biofilms. Journal of Bacteriology. 192 (12), 3024-3032 (2010).
- Maske, T. T., van de Sande, F. H., Arthur, R. A., Huysmans, M. -. C. D. N. J. M., Cenci, M. S. In vitro biofilm models to study dental caries: a systematic review. Biofouling. 33 (8), 661-675 (2017).
- Fu, Y., Luo, J., Qin, J., Yang, M. Screening techniques for the identification of bioactive compounds in natural products. Journal of Pharmaceutical and Biomedical Analysis. 168, 189-200 (2019).
- Sarker, S. D., Nahar, L. An introduction to natural products isolation. Methods in molecular biology. 864, 1-25 (2012).
- Clinical Laboratory Standards Institute (CLSI). Performance standards for antimicrobial susceptibility testing; twenty-fifth informational supplement. Clinical Laboratory Standards Institute (CLSI). , (2015).
- Saputo, S., Faustoferri, R. C., Quivey, R. G. A drug repositioning approach reveals that Streptococcus mutans is susceptible to a diverse range of established antimicrobials and nonantibiotics. Antimicrobial Agents and Chemotherapy. 62 (1), 01674 (2018).

