Систематический подход к выявлению новых противомикробных и антибиопленных молекул из экстрактов растений и фракций для предотвращения кариеса зубов
Summary
Натуральные продукты представляют собой перспективные отправные точки для разработки новых лекарственных средств и терапевтических средств. Однако, из-за высокого химического разнообразия, поиск новых терапевтических соединений из растений является сложной и трудоемкой задачей. Мы описываем упрощенный подход к выявлению молекул противомикробных препаратов и антибиоплений из растительных экстрактов и фракций.
Abstract
Натуральные продукты обеспечивают структурно различные вещества, с множеством биологических видов деятельности. Однако выявление и изоляция активных соединений от растений являются сложными из-за сложной матрицы растений и трудоемких процедур изоляции и идентификации. Поэтому представлен пошаговая подход к скринингу природных соединений растений, включая изоляцию и идентификацию потенциально активных молекул. Она включает в себя сбор растительного материала; подготовка и фракция сырых экстрактов; подходы к хроматографии и спектрометрии (UHPLC-DAD-HRMS и NMR) для анализа и идентификации соединений; биоанализ (антимикробная и антибиопленная деятельность; бактериальная “сила адгезии” к слюнной пелликуле и начальной глюканой матрице, обработанной отдельными методами лечения); и анализ данных. Модель проста, воспроизводима и позволяет последовательно контролировать скрининг нескольких соединений, концентраций и этапов лечения. Полученные данные обеспечивают основу для будущих исследований, включая формулировки с наиболее активными экстрактами и/или фракциями, изоляцию молекул, моделирование молекул до конкретных целей в микробных клетках и биопленки. Например, одной из мишеней для контроля кариогенной биопленки является ингибирование активности глюканов стрептококка мутан, которые синтезируют глюканы внеклеточной матрицы. Ингибирование этих ферментов предотвращает накопление биопленки, уменьшая ее вирулентность.
Introduction
Самые ранние модели медицины, используемые в обществах, основывались на натуральных продуктах (НП). С тех пор люди искали новые химические вещества в природе, которые могут быть преобразованы в наркотики1. Этот поиск вызвал постоянное совершенствование технологий и методов этноботалогическогоскрининга 1,2,3. NPs предлагают богатый источник структурно разнообразных веществ, с широким спектром биологической деятельности, полезной для разработки альтернативных или адъювантных методов лечения. Тем не менее, присущая комплексная матрица растений делает изоляцию и идентификацию активных соединений сложной и трудоемкой задачей4.
NPs-основанные снадобья или формулировки можно использовать для того чтобы предотвратить and/or обработать несколько условий влияя на устные, включая зубовогокариеса 4. Кариес зубов, один из самых распространенных хронических заболеваний во всем мире, вытекает из взаимодействия богатых сахаром диеты и микробных биопленок (зубной налет), образуется на поверхности зуба, что приводит к деминерализации, вызванной органическими кислотами, полученными из микробного метаболизма, и если не лечить,приводит к потере зубов 5,6. Хотя другие микроорганизмы могут бытьсвязаны 7, Streptococcus mutans является одним из важнейших кариогенных бактерий, потому что это кислогенный, кислый, и внеклеточной матрицы строитель. Этот вид кодирует несколько экзоэнзимов (например, гликозилтрансферазы или Гтфы), которые используют сахарозу вкачестве субстрата 8 для построения внеклеточной матрицы, богатой экзополисахаридами, которые являются детерминантомвирулентности 9. Кроме того, грибОк Candida Albicans может привести к производству, что внеклеточной матрицы7. Хотя фтор, вводят в различных условиях, остается основой для предотвращениякариеса зубов 10, новые подходы необходимы в качестве адъювантов для повышения его эффективности. Кроме того, имеющиеся методы борьбы с бляшками основаны на использовании микробицидных агентов широкого спектра действия (например, хлоргексидина)11. В качестве альтернативы, NPs являются потенциальными методами лечения для контроля биопленок и предотвращениякариеса зубов 12,13.
Дальнейший прогресс в открытии новых биологически активных соединений растений включает в себя необходимые шаги или подходы, такие, как: i) использование надежных и воспроизводимых протоколов отбора проб, учитывая, что растения часто проявляют внутриспецифическую изменчивость; ii) подготовка всеобъемлющих экстрактов и их соответствующих фракций в небольших масштабах; iii) характеристика и/или dereplication их химических профилей думали приобретение многомерных данных, таких как GC-MS, LC-DAD-MS, или NMR, например; iv) использование жизнеспособных и высокодоходных моделей для оценки биоактивности; v) выбор потенциальных новых попаданий на основе многовариантного анализа данных или других статистических инструментов; vi) для выполнения изоляции и очистки целевых соединений или перспективных кандидатов; и (vii) проверка соответствующих биологических действий с использованием изолированныхсоединений 2,14.
Dereplication является процесс быстрого выявления известных соединений в сырой экстракт и позволяет дифференциации новых соединений из тех, которые уже были изучены. Кроме того, этот процесс предотвращает изоляцию, когда биоактивность уже описана для некоторых соединений, и это особенно полезно для обнаружения “часто нападающих”. Он использовался в различных нецелесооборотных рабочих процессах, начиная от идентификации основных соединений или ускорения фракционования, управляемого деятельностью, до химического профилирования коллекций экстрактов. Он может быть полностью интегрирован с метаболомическими исследованиями для нецелесофильного химического профилирования CE или целевой идентификации метаболитов. Все это в конечном итоге приводит к приоритизации экстрактов передпроцедурами изоляции 1,15,16,17.
Поэтому в настоящей рукописи мы описываем систематический подход к выявлению молекул противомикробных и антибиопленных из растительных экстрактов и фракций. Она включает в себя четыре междисциплинарных этапа: (1) сбор растительного материала; (2) подготовка сырых экстрактов (CE) и фракций (CEF), а затем их химический анализ профиля; (3) биоанализ; и (4) анализ биологических и химических данных(рисунок 1). Таким образом, мы представляем протокол, разработанный для анализа противомикробной и антибиопленной деятельности экстрактов и фракций Casearia sylvestris против стрептококковых мутанов и candida albicans13,а также процедуры фитохимической характеристики и анализа данных. Для простоты, основное внимание здесь, чтобы продемонстрировать подход к скринингу природных соединений с использованием бактерии.
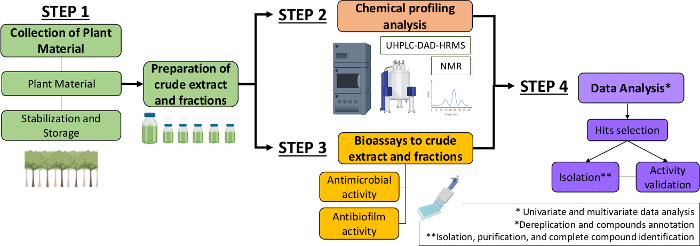
Рисунок 1: Поток-график системного подхода к выявлению активных молекул из растительных экстрактов и фракций. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Protocol
Representative Results
Discussion
Основными проблемами, связанными с работой с натуральными экстрактами сырой нефти, являются их сложный состав и недостатки классических исследований биоуместной изоляции. Хотя этот процесс идет медленно, он эффективен и привел к крупным выводам в исследованиях NP. Для рационализации н…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Мы выражаем нашу благодарность Нуклео де Биоэнсайос, Биоссюнте e Ecofisiologia de Produtos Naturais (NuBBE) Из Института химии UNESP, Araraquara/SP за предоставление лабораторий для подготовки растительного материала. Мы также благодарим Лабораторию прикладной микробиологии Департамента стоматологических материалов и протезов, UNESP, Araraquara/SP. Это исследование было поддержано научно-исследовательский грант от Сан-Паулу научно-исследовательский фонд (FAPESP #2013/07600-3 для AJC) и стипендии плюс накладные средства (FAPESP #2017/07408-6 и FAPESP #2019/23175-7 для СМР; #2011/21440-3 и #2012/21921-4 к PCPB). Национальный совет по научно-техническому развитию в сотрудничестве с ФАПЕСП оказал дополнительную поддержку (INCT CNPq #465637/2014-0 и FAPESP #2014/50926-0 к AJC).
Materials
| 96-well microplates | Kasvi | Flat bottom | |
| Activated carbon | LABSYNTH | Clean up and/or fractionation step | |
| Analytical mill | Ika LabortechniK | Model A11 Basic | |
| Blood agar plates | Laborclin | ||
| Chromatographic column C18 | Phenomenex Kinetex | 150 × 2.1 mm, 2.6 µm, 100Â | |
| Dimethyl sulfoxide | Sigma-Aldrich | Vehicle solution | |
| ELISA plate reader | Biochrom Ez | ||
| Ethanol | J. T. Baker | For extraction and fractionation steps, and mobile phase composition | |
| Ethanol | Sigma-Aldrich | Vehicle solution | |
| Ethyl acetate | J. T. Baker | Fractionation step | |
| GraphPad Software | La Jolla | GraphPad Prism7 | |
| Hexane | J. T. Baker | Fractionation step | |
| Incubator | Thermo Scientific | ||
| Isopropanol | J. T. Baker | For extraction step | |
| Lyophilizer (a freeze dryer) | Savant | Modulyo | |
| Nylon Millipore | LAC | 0.22 µm x 13 mm | |
| Orbital shaker | Quimis | Model G816 M20 | |
| Polyamide solid phase extraction cartridge | Macherey-Nagel | Clean up and/or fractionation step | |
| Silica gel | Merck | 40–63 μm, 60 Â | |
| Sodium Chloride (NaCl) | Synth | 0,89% in water | |
| Solid phase extraction cartridges (SPE) | Macherey-Nagel | Clean up and/or fractionation step | |
| Tryptone | Difco | ||
| UHPLC-DAD | Dionex | Ultimate 3000 RS | |
| Ultrasonic bath | UNIQUE | Model USC 2800 | |
| Yeast extract | Difco |
References
- Newman, D. J., Cragg, G. M. Natural Products as Sources of New Drugs over the Nearly Four Decades from 01/1981 to 09/2019. Journal of Natural Products. 83 (3), 770-803 (2020).
- Wolfender, J. L., Litaudon, M., Touboul, D., Queiroz, E. F. Innovative omics-based approaches for prioritisation and targeted isolation of natural products – new strategies for drug discovery. Natural Product Report. 36 (6), 855-868 (2019).
- Michel, T., Halabalaki, M., Skaltsounis, A. New Concepts, Experimental Approaches, and Dereplication Strategies for the Discovery of Novel Phytoestrogens from Natural Sources. Planta Medica. 79 (7), 514-532 (2013).
- Jeon, J. G., Rosalen, P. L., Falsetta, M. L., Koo, H. Natural products in caries research: current (limited) knowledge, challenges and future perspective. Caries Research. 45 (3), 243-263 (2011).
- Tonetti, M. S., Jepsen, S., Jin, L., Otomo-Corgel, J. Impact of the global burden of periodontal diseases on health, nutrition and wellbeing of mankind: A call for global action. Journal of Clinical Periodontology. 44 (5), 456-462 (2017).
- Peres, M. A., et al. Oral diseases: a global public health challenge. Lancet. 394 (10194), 249-260 (2019).
- Bowen, W. H., Burne, R. A., Wu, H., Koo, H. Oral biofilms: pathogens, matrix, and polymicrobial interactions in microenvironments. Trends Microbiology. 26 (3), 229-242 (2018).
- Paes Leme, A. F., Koo, H., Bellato, C. M., Bedi, G., Cury, J. A. The role of sucrose in cariogenic dental biofilm formation–new insight. Journal of Dental Research. 85 (10), 878-887 (2006).
- Koo, H., Falsetta, M. L., Klein, M. I. The exopolysaccharide matrix: a virulence determinant of cariogenic biofilm. Journal of Dental Research. 92 (12), 1065-1073 (2013).
- Cury, J. A., de Oliveira, B. H., dos Santos, A. P., Tenuta, L. M. Are dental fluoride releasing materials clinically effective on caries control. Dental Materials. 32 (3), 323-333 (2016).
- Mattos-Graner, R. O., Klein, M. I., Smith, D. J. Lessons Learned from Clinical Studies: Roles of Mutans Streptococci in the Pathogenesis of Dental Caries. Current Oral Health Reports. 1, 70-78 (2014).
- Rocha, G. R., Florez Salamanca, E. J., de Barros, A. L., Lobo, C. I. V., Klein, M. I. Effect of tt-farnesol and myricetin on in vitro biofilm formed by Streptococcus mutans and Candida albicans. BMC Complementary and Alternative Medicine. 18 (1), 61 (2018).
- Ribeiro, S. M., et al. Antimicrobial and antibiofilm activities of Casearia sylvestris extracts from distinct Brazilian Biomes against Streptococcus mutans and Candida albicans. BMC Complementary and Alternative Medicine. 19 (1), 308 (2019).
- Pilon, A. C., et al. Metabolômica de plantas: métodos e desafios. Quimica Nova. 43 (3), 329-354 (2020).
- Wolfender, J. L., Nuzillard, J. M., Hooft, J. J. J., Renault, J. H., Bertrand, S. Accelerating Metabolite Identification in Natural Product Research: Toward an Ideal Combination of Liquid Chromatography-High-Resolution Tandem Mass Spectrometry and NMR Profiling, in Silico Databases, and Chemometrics. Analytical Chemistry. 91 (1), 704-742 (2019).
- Allard, P. M., et al. Pharmacognosy in the digital era: shifting to contextualized metabolomics. Current opinion in biotechnology. 54, 57-64 (2018).
- Hubert, J., Nuzillard, J., Renault, J. Dereplication strategies in natural product research: How many tools and methodologies behind the same concept. Phytochemistry Reviews. 16, 55-95 (2017).
- Bueno, P. C. P., Pereira, F. M. V., Torres, R. B., Cavalheiro, A. J. Development of a comprehensive method for analysing clerodane-type diterpenes and phenolic compounds from Casearia sylvestris Swartz (Salicaceae) based on ultra-high performance liquid chromatography combined with chemometric tools. Journal of separation science. 38 (10), 1649-1656 (2015).
- Bueno, P. C. P., Lopes, N. P. Metabolomics to Characterize Adaptive and Signaling Responses in Legume Crops under Abiotic Stresses. American Chemical Society omega. 5 (4), 1752-1763 (2020).
- Blaženović, I., Kind, T., Ji, J., Fiehn, O. Software tools and approaches for compound identification of LC-MS/MS data in metabolomics. Metabolites. 8 (2), 31 (2018).
- Eloff, J. N. Quantifying the bioactivity of plant extracts during screening and bioassay-guided fractionation. Phytomedicine: International Journal Of Phytotherapy And Phytopharmacology. 11 (4), 370-371 (2004).
- Rios, J. L., Recio, M. C. Medicinal plants and antimicrobial activity. Journal of Ethnopharmacology. 100 (1-2), 80-84 (2005).
- Eloff, J. N. A sensitive and quick microplate method to determine the minimal inhibitory concentration of plant extracts for bacteria. Planta Medica. 64, 711-714 (1998).
- Eloff, J. N. Avoiding pitfalls in determining antimicrobial activity of plant extracts and publishing the results. BMC Complementary and Alternative Medicine. 19 (1), 106 (2019).
- Klein, M. I., Xiao, J., Heydorn, A., Koo, H. An analytical tool-box for comprehensive biochemical, structural and transcriptome evaluation of oral biofilms mediated by mutans streptococci. Journal of Visualized Experiments. (47), e2512 (2011).
- Lemos, J. A., Abranches, J., Koo, H., Marquis, R. E., Burne, R. A. Protocols to study the physiology of oral biofilms. Methods in molecular biology. 666, 87-102 (2010).
- Venkitaraman, A. R., Vacca-Smith, A. M., Kopec, L. K., Bowen, W. H. Characterization of glucosyltransferase B, GtfC, and GtfD in solution and on the surface of hydroxyapatite. Journal of Dental Research. 74, 1695-1701 (1995).
- Vacca-Smith, A. M., Venkitaraman, A. R., Quivey, R. G., Bowen, W. H. Interactions of streptococcal glucosyltransferases with alpha-amylase and starch on the surface of saliva-coated hydroxyapatite. Archives of Oral Biology. 41, 291-298 (1996).
- Van Dijck, P., et al. Methodologies for in vitro and in vivo evaluation of efficacy of antifungal and antibiofilm agents and surface coatings against fungal biofilms. Microbial Cell. 5 (7), 300-326 (2018).
- Marsh, P. D. Are dental diseases examples of ecological catastrophes. Microbiology. 149 (2), 279-294 (2003).
- Bowen, W. H., Koo, H. Biology of Streptococcus mutans-derived glucosyltransferases: role in extracellular matrix formation of cariogenic biofilms. Caries Research. 45 (1), 69-86 (2011).
- Lobo, C. I. V., et al. Dual-species biofilms of Streptococcus mutans and Candida albicans exhibit more biomass and are mutually beneficial compared with single-species biofilms. Journal of Oral Microbioly. 11 (1), 1581520 (2019).
- Kim, D., et al. Candida albicans stimulates Streptococcus mutans microcolony development via crosskingdom biofilm-derived metabolites. Scientific reports. 7, 41332 (2017).
- Ferreira, P. M. Folk uses and pharmacological properties of Casearia sylvestris: a medicinal review. Anais da Academia Brasileira de Ciencias. 83 (4), 1373-1384 (2011).
- Xia, L., Guo, Q., Tu, P., Chai, X. The genus Casearia: a phytochemical and pharmacological overview. Phytochemistry Reviews. 14, 99-135 (2015).
- Ferreira, P. M. P., et al. Toxicological findings about an anticancer fraction with casearins described by traditional and alternative techniques as support to the Brazilian Unified Health System (SUS). Journal of Ethnopharmacol. 15, 241 (2019).
- Koo, H., Xiao, J., Klein, M. I., Jeon, J. G. Exopolysaccharides produced by Streptococcus mutans glucosyltransferases modulate the establishment of microcolonies within multispecies biofilms. Journal of Bacteriology. 192 (12), 3024-3032 (2010).
- Maske, T. T., van de Sande, F. H., Arthur, R. A., Huysmans, M. -. C. D. N. J. M., Cenci, M. S. In vitro biofilm models to study dental caries: a systematic review. Biofouling. 33 (8), 661-675 (2017).
- Fu, Y., Luo, J., Qin, J., Yang, M. Screening techniques for the identification of bioactive compounds in natural products. Journal of Pharmaceutical and Biomedical Analysis. 168, 189-200 (2019).
- Sarker, S. D., Nahar, L. An introduction to natural products isolation. Methods in molecular biology. 864, 1-25 (2012).
- Clinical Laboratory Standards Institute (CLSI). Performance standards for antimicrobial susceptibility testing; twenty-fifth informational supplement. Clinical Laboratory Standards Institute (CLSI). , (2015).
- Saputo, S., Faustoferri, R. C., Quivey, R. G. A drug repositioning approach reveals that Streptococcus mutans is susceptible to a diverse range of established antimicrobials and nonantibiotics. Antimicrobial Agents and Chemotherapy. 62 (1), 01674 (2018).

