Determinación rápida de la afinidad anticuerpos-antígenos por fotometría de masas
Summary
Describimos un enfoque de una sola molécula para las mediciones de afinidad antígeno-anticuerpo utilizando fotometría de masas (MP). El protocolo basado en MP es rápido, preciso, utiliza una cantidad muy pequeña de material y no requiere modificación de proteínas.
Abstract
Las mediciones de la especificidad y afinidad de las interacciones antígeno-anticuerpos son de vital importancia para aplicaciones médicas y de investigación. En este protocolo, describimos la implementación de una nueva técnica de una sola molécula, la fotometría de masas (MP), para este propósito. MP es una técnica libre de etiquetas e inmovilización que detecta y cuantifica las masas moleculares y las poblaciones de anticuerpos y complejos antigen-anticuerpos a nivel de una sola molécula. MP analiza la muestra de antígeno-anticuerpo en cuestión de minutos, permitiendo la determinación precisa de la afinidad de unión y proporcionando simultáneamente información sobre la estequiometría y el estado oligomérico de las proteínas. Esta es una técnica simple y directa que requiere sólo cantidades de picomole de proteína y no consumibles caros. El mismo procedimiento se puede utilizar para estudiar la unión proteína-proteína para proteínas con una masa molecular superior a 50 kDa. Para las interacciones multivalentes de proteínas, las afinidades de múltiples sitios de unión se pueden obtener en una sola medición. Sin embargo, el modo de medición de una sola molécula y la falta de etiquetado imponen algunas limitaciones experimentales. Este método da los mejores resultados cuando se aplica a mediciones de affinidades de interacción submicromolar, antígenos con una masa molecular de 20 kDa o más grandes, y muestras de proteínas relativamente puras. También describimos el procedimiento para realizar los pasos de ajuste y cálculo necesarios utilizando el software básico de análisis de datos.
Introduction
Los anticuerpos se han convertido en herramientas omnipresentes de la biología molecular y se utilizan ampliamente en aplicaciones médicas y de investigación. En medicina, son de vital importancia en el diagnóstico, pero sus aplicaciones terapéuticas también se están expandiendo y constantemente se desarrollan nuevas terapias basadas en anticuerpos1,2,3,4. Las aplicaciones científicas de los anticuerpos incluyen muchas técnicas de laboratorio indispensables como la inmunofluorescencia5,la inmunoprecipitación6,la citometría de flujo7,ELISA e hinchazón occidental. Para cada una de estas aplicaciones, es de crucial importancia obtener mediciones precisas de las propiedades de unión del anticuerpo, incluida la afinidad y especificidad de unión.
Desde que se introdujo el primer instrumento de resonancia de plasmon de superficie comercial (SPR) en 1990, los biosensores ópticos se han convertido en el “estándar de oro” de caracterización de anticuerpos, pero otras técnicas, incluyendo ELISA, también se utilizan rutinariamente para medir las afinidades de anticuerpos8,9. Estos métodos generalmente requieren inmovilización o etiquetado de las moléculas analizadas, lo que puede afectar potencialmente la interacción de interés. También son relativamente lentos, lo que implica varios pasos de ensayo antes de que los resultados se puedan recopilar para el análisis de datos. Un método de una sola molécula desarrollado recientemente, la fotometría de masas (MP), detecta moléculas directamente en la solución cuando aterrizan en la superficie del microscopio cubrep10,11. La detección óptica basada en dispersión de luz que emplea MP no requiere etiquetado o modificación de proteínas. Las moléculas de proteínas individuales se registran mediante el microscopio de dispersión interferométrico como manchas oscuras que aparecen en la imagen(Figura 1D),y varios miles de moléculas se pueden detectar durante la adquisición de datos de un minuto12. La señal generada por cada partícula individual se cuantifica y se calcula su valor de contraste (oscuridad relativa). Los valores de contraste interferométrico son proporcionales a las masas moleculares de las proteínas, lo que permite la identificación de especies unidas y libres en la mezcla antígeno-anticuerpo. Al mismo tiempo, contando los eventos de aterrizaje molecular, MP mide directamente las poblaciones de especies. Esto proporciona a los métodos basados en MP una capacidad única para cuantificar de forma independiente las afines de varios sitios de enlace.
La unión de las moléculas de antígeno (Ag) a los dos sitios de unión del anticuerpo intacto (Ab) se puede describir como: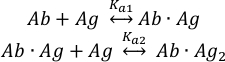
con las constantes de asociación de equilibrio Ka1 y Ka2 definidas como: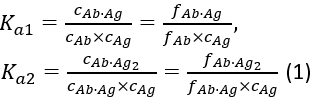
donde ci y fi representan la concentración y fracción del componente i, respectivamente. La concentración total de antígenos (cAg)tot puede expresarse como: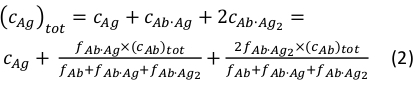
Dado que se conocen las concentraciones totales del anticuerpo (cAb)tot y antígeno (cAg)tot, esta ecuación se puede utilizar para ajustar directamente las fracciones de componentes experimentales obtenidas de las mediciones MP y calcular las constantes de asociación de equilibrio Ka1 y Ka2 (ver Información complementaria).
Los datos MP también se pueden utilizar para estimar la cooperatividad entre los dos sitios de unión de anticuerpos11. Para dos paratopos de anticuerpos con constantes de unión microscópicas idénticas, los factores estadísticos que describen el proceso de población de la Ab Ag y Ab? Loscomplejos Ag2 dictan que las constantes de equilibrio macroscópicas aparentes Ka1 y Ka2 no serán numéricamente iguales, y Ka1 a 4Ka2. Por lo tanto, los valores experimentales de Ka1 < 4Ka2 indican una cooperación positiva entre los dos sitios de unión de anticuerpos. Del mismo modo, Ka1 > 4Ka2 indica una cooperación negativa.
Las mediciones MP de la afinidad de unión antígeno-anticuerpo son rápidas y requieren una pequeña cantidad de material. Las distribuciones de masa MP utilizadas para los cálculos constantes de equilibrio proporcionan información adicional sobre las propiedades de la muestra y permiten la evaluación de la pureza, la oligomerización y la agregación de la muestra en un solo experimento. El mismo método se puede utilizar para medir la unión entre proteínas y proteínas de alta afinidad, y MP es particularmente útil para estudios de interacciones multi-variables de proteínas. Los complejos multi proteico suelen tener grandes masas moleculares, óptimas para la detección de MP, y los datos de una sola molécula se pueden utilizar para medir la estequiometría y calcular las afinidades de múltiples sitios de unión simultáneamente. Esta información suele ser difícil de obtener mediante métodos basados en masa.
Sin modificaciones, el protocolo actual es adecuado para mediciones de interacciones submicromolares de relativamente alta afinidad con antígenos de una masa molecular de 20 kDa o más. Para obtener resultados óptimos, las existencias de proteínas deben ser de alta pureza, pero no hay requisitos específicos de amortiguación. Mediante el uso de MP, la unión antígeno-anticuerpos se puede evaluar en menos de cinco minutos. La recopilación y el análisis de datos necesarios para cálculos Kd precisos se pueden realizar en un plazo de 30 minutos.
Protocol
Representative Results
Discussion
El protocolo basado en fotometría de masas descrito aquí proporciona un método rápido y preciso para medir las afinidades de unión de anticuerpos antigen. El análisis de MP utiliza una cantidad muy pequeña de material, y la información adicional, incluida la estequiometría, la oligomerización y la pureza, se puede evaluar a partir de los mismos datos (Figura 5). Sin modificaciones, este método es aplicable a las mediciones de constantes de disociación en el rango de aproximadamen…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Agradecemos a Keir Neuman por su lectura crítica del manuscrito. Este trabajo fue apoyado por el programa intramuros de la NHLBI, NIH.
Materials
| AcquireMP | Refeyn | MP data collection software | |
| Anti-human thrombin | Haematologic Technologies | AHT-5020 | RRID: AB_2864302 |
| Cotton-tipped applicators | Thorlabs | CTA10 | cotton optical swabs for lens cleaning |
| Coverslips 24×24 mm | Globe Scientific | 1405-10 | |
| Coverslips 24×50 mm | Fisher Scientific | 12-544-EP | |
| DiscoverMP | Refeyn | MP data processing software | |
| Forceps | Electron Microscopy Sciences | 78080-CF | soft-tipped forceps for coverslips handling |
| Human α-thrombin | Haematologic Technologies | HCT-0020 | |
| Immersion oil | Thorlabs | MOIL-30 | |
| Isopropanol | Alfa Aesar | 36644 | |
| Microsoft Excel | Microsoft | spreadsheet | |
| OneMP | Refeyn | Mass Photometry instrument | |
| Origin | OriginLab | scientific graphing software | |
| PBS | Corning | 46-013-CM | 10x stock |
| Syringe filter | Millipore | SLGSR33SS | buffer and sample filtering |
References
- Francis, R. J., et al. A phase I trial of antibody directed enzyme prodrug therapy (ADEPT) in patients with advanced colorectal carcinoma or other CEA producing tumours. British Journal of Cancer. 87 (6), 600-607 (2002).
- van Dyck, C. H. Anti-Amyloid-beta Monoclonal Antibodies for Alzheimer’s Disease: Pitfalls and Promise. Biological Psychiatry. 83 (4), 311-319 (2018).
- Vennepureddy, A., Singh, P., Rastogi, R., Atallah, J. P., Terjanian, T. Evolution of ramucirumab in the treatment of cancer – A review of literature. Journal of Oncology Pharmacy Practice. 23 (7), 525-539 (2017).
- Waldmann, T. A. Immunotherapy: past, present and future. Nature Medicine. 9 (3), 269-277 (2003).
- Huang, B., Bates, M., Zhuang, X. Super-resolution fluorescence microscopy. Annual Review of Biochemistry. 78, 993-1016 (2009).
- Rosenberg, M. I. . Protein Analysis and Purification. , (2005).
- Picot, J., Guerin, C. L., Le Van Kim, C., Boulanger, C. M. Flow cytometry: Retrospective, fundamentals and recent instrumentation. Cytotechnology. 64 (2), 109-130 (2012).
- Khan, S. H., Farkas, K., Kumar, R., Ling, J. A versatile method to measure the binding to basic proteins by surface plasmon resonance. Analytical Biochemistry. 421 (2), 385-390 (2012).
- Lofgren, J. A., et al. Comparing ELISA and surface plasmon resonance for assessing clinical immunogenicity of panitumumab. The Journal of Immunology. 178 (11), 7467-7472 (2007).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
- Wu, D., Piszczek, G. Measuring the affinity of protein-protein interactions on a single-molecule level by mass photometry. Analytical Biochemistry. 592, 113575 (2020).
- Cole, D., Young, G., Weigel, A., Sebesta, A., Kukura, P. Label-free single-molecule imaging with numerical-aperture-shaped interferometric scattering microscopy. ACS Photonics. 4 (2), 211-216 (2017).
- Soltermann, F., et al. Quantifying protein-protein interactions by molecular counting with mass photometry. Angewandte Chemie International Edition in English. 59 (27), 10774-10779 (2020).
- Kemmer, G., Keller, S. Nonlinear least-squares data fitting in Excel spreadsheets. Nature Protocols. 5 (2), 267-281 (2010).

