מדידה פוטנציאלית לפעולה אופטית חד-תאית בקרדיומיוציטים שמקורם בתאי גזע מושרים על ידי תאי גזע אנושיים
Summary
כאן אנו מתארים רכישה אופטית ואפיון של פוטנציאל פעולה מתאי גזע פלוריפוטנטים המושרים שמקורם בקרדיומיוציטים באמצעות מערכת פוטומטריה מודולרית במהירות גבוהה.
Abstract
טכניקות מיקרו-אלקטרוקטרודה תאיות קונבנציונליות לכימות אלקטרופיזיולוגיה של קרדיומיוצית הן מורכבות ביותר, עתירות עבודה, ובדרך כלל מבוצעות בתפוקה נמוכה. התרחבות מהירה ומתמשכת של טכנולוגיית תאי גזע פלוריפוטנטים המושרים (iPSC) מציגה סטנדרט חדש במחקר לב וכלי דם ושיטות חלופיות נחוצות כעת כדי להגדיל את התפוקה של נתונים אלקטרופיזיולוגיים ברמת תא אחד. VF2.1Cl הוא צבע רגיש למתח שנגזר לאחרונה המספק ערוץ יחיד מהיר, תגובה בעוצמה גבוהה לתנודות בפוטנציאל הממברנה. יש לו קינטיקה עדיפה על אלה של מחווני מתח קיימים אחרים ועושה נתונים פונקציונליים זמינים שוות ערך לזה של טכניקות מיקרו-ectrode מסורתיות. כאן, אנו מדגימים אפיון פוטנציאלי פעולה פשוטה ולא פולשנית ב cardiomyocytes אנושיים בקצב חיצוני באמצעות מערכת פוטומטריה מודולרית ובמחיר סביר מאוד.
Introduction
מידול אלקטרופיזיולוגי של קרדיומיוציטים ובניית פלטפורמות יעילות להקרנת תרופות לב חיוניות לפיתוח אסטרטגיות טיפוליות למגוון הפרעות קצב. התרחבות מהירה של טכנולוגיית תאי גזע פלוריפוטנטים המושרה (iPSC) יצרה חדירה מבטיחה למידול מחלות אנושיות ולחקירה פרמקולוגית באמצעות קרדיומיוציטים שמקורם בחולה מבודד (iPSC-CM). טכניקות “תקן זהב” לאפיון אלקטרופיזיולוגי של תאים אלה באמצעות מהדק תיקון (מהדק זרם) יכולות לכמת את פוטנציאל הפעולה (AP) מורפולוגיה ומשך זמן, עם זאת, שיטה זו מורכבת ואיטית להפליא, ואינה מתאימה לרכישת נתוני תפוקה גבוהה1. iPSC-CMs מדווחים באופן קבוע יש פוטנציאל ממברנה דיאסטולית מוגברת וזרם דליפה מוגבר בהשוואה לקרדיומיוציטים ילידים למבוגרים2. הוא הציע כי גודל תא קטן יותר קיבוליות ממברנה מופחתת שנצפו iPSC-CMs עלול לייצר כמה שגיאה שיטתית בעת שימוש בטכניקת מלחציים הנוכחי, אולי להסביר את הסטיות האלה3. על מנת למקסם את התועלת של פלטפורמת iPSC-CM, שיטה נוספת היא בעלת ערך כדי להגדיל את התפוקה ולהבטיח דיוק נתונים בעת אפיון שינויי מתח transmembrane ברמת תא יחיד ב- iPSC-CMs.
צבעים רגישים למתח (VSD) כבר זמן רב שיטה מוצעת כדי לספק ניתוח מהיר יותר, לא פולשני שווה ערך של קינטיקה AP לב בהשוואה לאלה של טכניקות מסורתיות4. מחקר שנערך לאחרונה הדגים את ההתאמה של פוטומטריה רגישה למתח רציטרי כדי לכמת במדויק את AP הלב5. יתר על כן, היכולת להגדיל בקלות את הגישות פוטומטריה אופטית מעניק טכניקה זו בקנה מידה גדול מסכי cardiotoxicity קריטי בפיתוח תרופות טיפוליות (למשל, CiPA). פיתוח פרוטוקולי cardiotoxicity מתוקננים במחקר מרובה אתרים עיוור באמצעות מערך microelectrode וטכניקות אופטיות חישת מתח הדגים את הערך העיקרי של גישה זו6.
צבעים פוטנציומטריים רבים זמינים מסחרית, ופיתוח סינתטי מתמשך של בדיקות חדשות מראה פוטנציאל מרגש לייעול האפקטיביות שלהם על פני מגוון מבנים לב ועצביים. VSD האידיאלי יהיה קינטיקה מוגברת ורגישות, תוך הצגת עומס קיבולי מופחת, ליטוף פוטו וציטוטוקסיות. VF2.1Cl מסונתז לאחרונה (FluoVolt) מבטא רבים של תכונות מועילות אלה בעיקר בשל המבנה המולקולרי מבוסס חוט החדש שלה, משותף על ידי חברים אחרים של מתח Fluor החדש (VF) משפחה7. בניגוד VSDs אלקטרוכרומי נפוץ שבו בדיקות פשוטות מצומדות מולקולרית וחשמלית לקרום הפלזמה, צבע זה מורכב חוט סינתטי מוחדר באופן פסיבי, המשתרע על פני ממברנה אשר משייך תורם עשיר באלקטרונים עם פלואורופור פלואורסין שונה (FITC). פרטים מכניים מסופקים באיור 1. צבע זה מדגים רגישות מעולה לתנודות מתח הממברנה, ומציג שינוי של 27% בעוצמת הפליטה לכל 100 mV לעומת ~ 10% שנראה בבדיקות נפוצות אחרות במהירויותדומות 7. בנוסף, מערכות PeT מבוססות חוט אינן מתקשרות ישירות עם השדה החשמלי הסלולרי המייצר הפרעות חשמליות מינימליות ושינויים זניחים בעומס הקיבולי התאי.
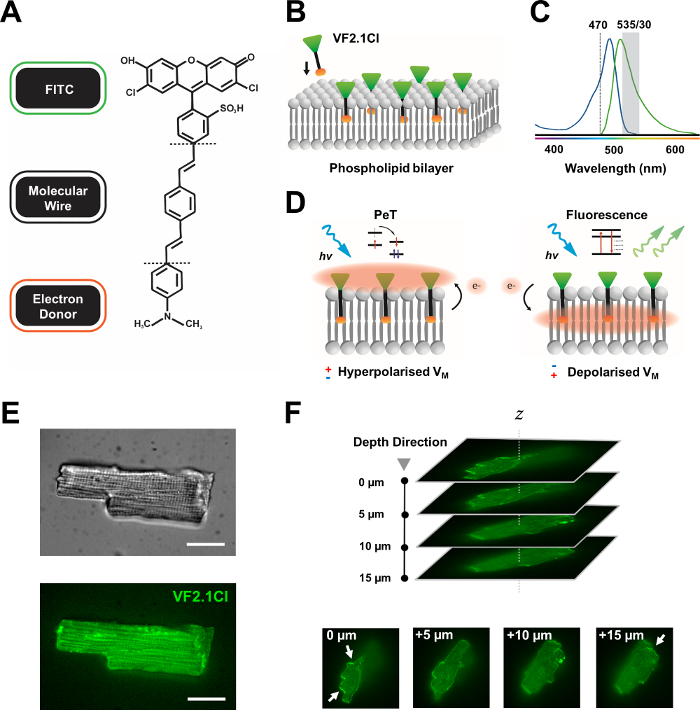
איור 1: פרמטרים כימיים, ספקטרליים ומכניסטיים של צבע VF2.1Cl. (A)מבנה כימי של תכונות מולקולריות VF2.1Cl. לציין כוללים קבוצות אלקיל מרובות בתוך חוט מולקולרי פנילן וינילן אשר להקל על החדרה לתוך קרום הפלזמה. קבוצת חומצה גופרתית טעונה שלילית הצומדת בגשושית FITC מבטיחה ייצוב פלואורופור על פני השטח החוץ-תאיים ומסייעת ליד החדרה מאונכת ביחס לשדה החשמלי של דו-שכבתי השומנים. (B)סכמטי פשוט של VF2.1Cl מאונך מוטבע לתוך קרום הפלזמה של תא יעד. (C)ספקטרום ספיגה ופליטה של צבע VF2.1Cl. ספקטרה זהה לזו של בדיקות FITC ו- GFP סטנדרטיות. (ד)תיאור של מצב הפעולה המכניסטי של VF2.1Cl. בתנאי מנוחה (היפרפולרי), מתחים תאיים שליליים מניעים אלקטרונים חופשיים לכיוון הפלואורופור של הרוסטרל. שפע אלקטרונים מבטיח העברת אלקטרונים המושרה על ידי תמונה (PeT) מועדף כמסלול מחוץ למצב הנרגש לאחר העירור האופטי, למעשה מרווה פלואורסצנטיות. לעומת זאת, פוטנציאל ממברנה דה קוטבי משפיע על תנועת אלקטרונים כלפי מטה ומעדיף פלואורסצנטיות על עירור אופטי. התגובה הפלואורסצנטית המתקבלת קשורה באופן ליניארי למתח הממברנה וניתן להשתמש בה במדויק כדי לאסוף מידע זמני מפורט על קינטיקה אלקטרופיזיולוגית תאית. (E)נציג brightfield (עליון) ופלואורסצנטיות ב 470 ננומטר (נמוך יותר) תמונות של קרדיומיוציטים לפולין טעון עם VF2.1Cl. (F)Z מחסנית Z של קרדיומיוציטים טעון יחיד. החצים מציינים אזורים של לוקליזציה ברורה של VF2.1Cl לממברנה התאית. תמונות נרכשו עם מערכת קונפוקלית דיסק מסתובב המורכבת ראש קונפוקלי דיסק מסתובב X-lightv3 עם תבנית חור סיכה 50 מיקרומטר; תאורת LDI-7; מצלמת Prime95B ומטרת PlanApo Lambda 100x. סרגל קנה מידה: 20 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
הבדיקה FITC הצומדת ל- VF2.1Cl מבטיחה שניתן יהיה להשתמש בה ביעילות בתצורות מסנן רגילות ו- GFP, והיא דורשת רק מערכת רכישה של ערוץ אחד, שתיהן תכונות נפוצות של פלטפורמות הדמיה פלואורסצנטיות. ניתוח של מונוליות IPSC-CM אנושי צפוף עם צבע זה דווח לאחרונה8,9,10,11. הפרוטוקול שלנו שונה ממחקרים אלה עקב החקירה שלנו של iPSC-CMs יחידים, מבודדים, ללא הפרעה על ידי ההשפעות החשמליות והפרקרינית של monolayers סינכרוני צפוף, והשימוש שלנו במערכת פוטומטריה במחיר סביר וניתן להתאמה אישית בניגוד לסידורי הדמיה קונפוקליים או רחבים מורכבים.
כאן, אנו מתארים את הפרוטוקול שלנו לרכישה וניתוח מהירים של APs אופטי חזק מקרדיומיוציטים אנושיים מבודדים וקרדיומיוציטים מקומיים (ראה קובץ משלים). אנו משתמשים VF2.1Cl בשילוב עם המדינה הניתנת להתאמה אישית של פלטפורמת האמנות למדידות פוטומטריה של תא יחיד. פרוטוקולים ניסיוניים אלה אושרו על ידי ועדת האתיקה של המרכז הרפואי האוניברסיטאי גטינגן (מס ’10/9/15).
Protocol
Representative Results
Discussion
כאן אנו מתארים פרוטוקול בסיסי כדי לרכוש בקלות פרופילי AP מפורטים מ- iPSC-CMs מבודדים המתאימים למידול אלקטרופיזיולוגי והקרנת תרופות לב. אנו מזהים APs רגילים וחזקים מה- iPSC-CMs שלנו עם זרעים דלילות, מה שמרמז הן על פונקציונליות המחוון והן על נאמנות מתודולוגית.
בשל הספקטרום הרחב של מתוד?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
המחברים מבקשים להכיר ב- Cairn Research Ltd. על תרומתם הכספית האדיבת אשר כיסתה את עלויות הייצור של פרסום זה. בנוסף, אנו מודים לגברת אינס מולר ולמרת סטפני קסטל על התמיכה הטכנית המצוינת שלהם.
המחקר של המחברים נתמך על ידי המרכז הגרמני לחקר הלב וכלי הדם (DZHK), דויטשה Forschungsgemeinschaft (DFG, קרן המחקר הגרמנית, VO 1568/3-1, IRTG1816 RP12, SFB1002 TPA13 ותחת אסטרטגיית המצוינות של גרמניה – EXC 2067/1- 390729940) ו-Else-Kröner-Fresenius Stiftung (EKFS 2016_A20).
Materials
| Reagents | |||
| 0.25 Trypsin EDTA | Gibco | 25200056 | |
| B27 Supplement | Gibco | 17504044 | |
| CaCl2 | Carl Roth | HN04.2 | |
| D(+)-Glucose anhydrous BioChemica | ITW Reagents | A1422 | |
| Fetal Bovine Serum | Gibco | 10270-106 | |
| FluoVolt Membrane Potential Kit | Invitrogen | F10488 | |
| HEPES | Carl Roth | HN77.4 | |
| KCl | Sigma-Aldrich | 6781.1 | |
| Lamanin | Sigma-Aldrich | 114956-81-9 | |
| Matrigel | BD | 354230 | |
| NaCl | Sigma-Aldrich | 9265.2 | |
| Nifedipine | Sigma-Aldrich | 21829-25-4 | |
| Penicillin/Streptomycin | Invitrogen | 15140 | |
| ROCK Inhibitor Y27632 | Stemolecule | 04-0012-10 | |
| RPMI 1640 Medium | Gibco | 61870010 | |
| Versene EDTA | Gibco | 15040033 | |
| Equipment | |||
| 495LP Dichroic Beamsplitter | Chroma Technology | ||
| Axopatch 200B Amplifier | Molecular Devices | ||
| Circle Coverslips, Thickness 0 | Thermo Scientific | CB00100RA020MNT0 | |
| Digidata 1550B | Molecular Devices | ||
| Dual OptoLED Power Supply | Cairn Research | ||
| ET470/40x Excitation Filter | Chroma Technology | ||
| ET535/50m | Chroma Technology | ||
| Etched Neubauer Hemacytometer | Hausser Scientific | ||
| Filter Cubes | Cairn Research | ||
| IX73 Inverted Microscope | Olympus | ||
| MonoLED | Cairn Research | ||
| Multiport Adaptors | Cairn Research | ||
| Myopacer Cell Stimulator | IonOptix | ||
| Optomask Shutter | Cairn Research | ||
| Optoscan System Controller | Cairn Research | ||
| PH-1 Temperature Controlled Platform | Warner Instruments | ||
| Photomultiplier Detector | Cairn Research | ||
| PMT Amplifier Insert | Cairn Research | ||
| PMT Supply Insert | Cairn Research | ||
| RC-26G Open Bath Chamber | Warner Instruments | ||
| SA-OLY/2AL Stage Adaptor | Olympus | ||
| T565lpxr Dichroic Beamsplitter | Chroma Technology | ||
| T660lpxr Dichroic Beamsplitter | Chroma Technology | ||
| TC-20 Dual Channel Temperature Controller | npi Electronic | ||
| UPLFLN 40X Objective | Olympus | ||
| USB 3.0 Colour Camera | Imaging Source | ||
| Software | |||
| Clampex 11.1 | Molecular Devices | ||
| Clampfit 11.1 | Molecular Devices | ||
| IC Capture 2.4 | Imaging Source | ||
| Prism 8 | Graphpad |
References
- Miller, E. W. Small molecule fluorescent voltage indicators for studying membrane potential. Current Opinion in Chemical Biology. 33, 74-80 (2016).
- Liang, P., et al. Drug screening using a library of human induced pluripotent stem cell-derived cardiomyocytes reveals disease-specific patterns of cardiotoxicity. Circulation. 127 (16), 1677-1691 (2013).
- Horváth, A., et al. Low resting membrane potential and low inward rectifier potassium currents are not inherent features of hiPSC-derived cardiomyocytes. Stem Cell Reports. 10 (3), 822-833 (2018).
- Salama, G., Morad, M. Merocyanine 540 as an optical probe of transmembrane electrical activity in the heart. Science. 191 (4226), 485-487 (1976).
- Hortigon-Vinagre, M., et al. The use of ratiometric fluorescence measurements of the voltage sensitive dye Di-4-ANEPPS to examine action potential characteristics and drug effects on human induced pluripotent stem cell-derived cardiomyocytes. Toxicological Sciences. 154 (2), 320-331 (2016).
- Blinova, K., et al. International multisite study of human-induced pluripotent stem cell-derived cardiomyocytes for drug proarrhythmic potential assessment. Cell Reports. 24 (13), 3582-3592 (2018).
- Miller, E. W., et al. Optically monitoring voltage in neurons by photo-induced electron transfer through molecular wires. Proceedings of the National Academy of Sciences. 109 (6), 2114-2119 (2012).
- Bedut, S., et al. High-throughput drug profiling with voltage- and calcium-sensitive fluorescent probes in human iPSC-derived cardiomyocytes. American Journal of Physiology-Heart and Circulatory Physiology. 311 (1), 44-53 (2016).
- McKeithan, W. L., et al. An automated platform for assessment of congenital and drug-induced arrhythmia with hiPSC-derived cardiomyocytes. Frontiers in Physiology. 8, 766 (2017).
- Duncan, G., et al. Drug-mediated shortening of action potentials in LQTS2 human induced pluripotent stem cell-derived cardiomyocytes. Stem Cells and Development. 26 (23), 1695-1705 (2017).
- Asakura, K., Hayashi, S., Ojima, A., Taniguchi, T., Miyamoto, N. Improvement of acquisition and analysis methods in multi-electrode array experiments with iPS cell-derived cardiomyocytes. Journal of Pharmacological and Toxicological Methods. 75, 17-26 (2015).
- Lian, X., et al. Directed cardiomyocyte differentiation from human pluripotent stem cells by modulating Wnt/β-catenin signaling under fully defined conditions. Nature Protocols. 8 (1), 162-175 (2013).
- Burridge, P. W., et al. Chemically defined generation of human cardiomyocytes. Nature methods. 11 (8), 855-860 (2014).
- Kleinsorge, M., Cyganek, L. Subtype-directed differentiation of human iPSCs into atrial and ventricular cardiomyocytes. STAR Protocols. , 100026 (2020).
- Knollmann, B. C., Katchman, A. N., Franz, M. R. Monophasic action potential recordings from intact mouse heart: validation, regional heterogeneity, and relation to refractoriness. Journal of Cardiovascular Electrophysiology. 12 (11), 1286-1294 (2001).
- Leopold, J. A., Loscalzo, J. Emerging role of precision medicine in cardiovascular disease. Circulation Research. 122 (9), 1302-1315 (2018).
- Voigt, N., Zhou, X. B., Dobrev, D. Isolation of human atrial myocytes for simultaneous measurements of Ca2+ transients and membrane currents. Journal of Visualized Experiments. (77), e50235 (2013).
- Voigt, N., et al. Enhanced sarcoplasmic reticulum Ca2+ Leak and increased Na+-Ca2+ exchanger function underlie delayed afterdepolarizations in patients with chronic atrial fibrillation. Circulation. 125 (17), 2059-2070 (2012).
- Voigt, N., et al. Cellular and molecular mechanisms of atrial arrhythmogenesis in patients with paroxysmal atrial fibrillation. Circulation. 129 (2), 145-156 (2014).
- Fakuade, F. E., et al. Altered atrial cytosolic calcium handling contributes to the development of postoperative atrial fibrillation. Cardiovascular Research. , 162 (2020).
- Gross, E., Bedlack, R. S., Loew, L. M. Dual-wavelength ratiometric fluorescence measurement of the membrane dipole potential. Biophysical Journal. 67 (1), 208-216 (1994).
- Matiukas, A., et al. Near-infrared voltage-sensitive fluorescent dyes optimized for optical mapping in blood-perfused myocardium. Heart Rhythm. 4 (11), 1441-1451 (2007).
- Mutoh, H., et al. Spectrally-resolved response properties of the three most advanced fret based fluorescent protein voltage probes. PLoS One. 4 (2), 4555 (2009).
- Hochbaum, D. R., et al. All-optical electrophysiology in mammalian neurons using engineered microbial rhodopsins. Nature Methods. 11 (8), 825-833 (2014).
- Huang, Y. L., Walker, A. S., Miller, E. W. A photostable silicon rhodamine platform for optical voltage sensing. Journal of the American Chemical Society. 137 (33), 10767-10776 (2015).
- Deal, P. E., Kulkarni, R. U., Al-Abdullatif, S. H., Miller, E. W. Isomerically pure tetramethylrhodamine voltage reporters. Journal of the American Chemical Society. 138 (29), 9085-9088 (2016).
- Fluhler, E., Burnham, V. G., Loew, L. M. Spectra, membrane binding, and potentiometric responses of new charge shift probes. Biochemistry. 24 (21), 5749-5755 (1985).
- Fromherz, P., Muller, C. O. Voltage-sensitive fluorescence of amphiphilic hemicyanine dyes in neuron membrane. Biochimica et Biophysica Acta. 1150 (2), 111-122 (1993).
- Salama, G., et al. Properties of new, long-wavelength, voltage-sensitive dyes in the heart. Journal of Membrane Biology. 208 (2), 125-140 (2005).
- Jin, L., et al. Single action potentials and subthreshold electrical events imaged in neurons with a fluorescent protein voltage probe. Neuron. 75 (5), 779-785 (2012).
- Kralj, J. M., Douglass, A. D., Hochbaum, D. R., MacLaurin, D., Cohen, A. E. Optical recording of action potentials in mammalian neurons using a microbial rhodopsin. Nature Methods. 9 (1), 90-95 (2012).
- Tsutsui, H., Karasawa, S., Okamura, Y., Miyawaki, A. Improving membrane voltage measurements using FRET with new fluorescent proteins. Nature Methods. 5 (8), 683-685 (2008).
- Lundby, A., Mutoh, H., Dimitrov, D., Akemann, W., Knöpfel, T. Engineering of a genetically encodable fluorescent voltage sensor exploiting fast Ci-VSP voltage-sensing movements. PLoS One. 3 (6), 2514 (2008).
- Bradley, J., Luo, R., Otis, T. S., DiGregorio, D. A. Submillisecond optical reporting of membrane potential in situ using a neuronal tracer dye. The Journal of neuroscience. 29 (29), 9197-9209 (2009).
- Herron, T. J., Lee, P., Jalife, J. Optical imaging of voltage and calcium in cardiac cells & tissues. Circulation Research. 110 (4), 609-623 (2012).
- Kappadan, V., et al. High-resolution optical measurement of cardiac restitution, contraction, and fibrillation dynamics in beating vs. blebbistatin-uncoupled isolated rabbit hearts. Frontiers in Physiology. 11, 464 (2020).
- Kettlewell, S., Walker, N. L., Cobbe, S. M., Burton, F. L., Smith, G. L. The electrophysiological and mechanical effects of 2,3-butane-dione monoxime and cytochalasin-D in the Langendorff perfused rabbit heart. Experimental Physiology. 89 (2), 163-172 (2004).
- Képiró, M., et al. para-Nitroblebbistatin, the non-cytotoxic and photostable Myosin inhibitor. Angewandte Chemie International Edition. 53 (31), 8211-8215 (2014).

