Optimisation de la croissance des cristaux d’endothiapepsine pour les expériences de cristallographie en série
Summary
Le but de cet article est de donner au spectateur une solide compréhension de la façon de transformer leur protocole de diffusion de vapeur de petit volume, pour la croissance de gros cristaux de protéines uniques, en une méthode de micro-cristallisation par lots de grands volumes pour la cristallographie en série.
Abstract
Ici, un protocole est présenté pour faciliter la création de grands volumes (> 100 μL) de boues microcristallines adaptées aux expériences de cristallographie en série à la fois aux synchrotrons et aux XFEL. La méthode est basée sur une compréhension du diagramme de phase des cristaux de protéines et sur la façon dont ces connaissances peuvent être utilisées. La méthode est divisée en trois étapes: (1) optimisation de la morphologie cristalline, (2) transition vers le lot et (3) mise à l’échelle. L’étape 1 consiste à trouver des monocristaux bien diffractants, espérons-le mais pas nécessairement, se présentant dans une morphologie cubique. Au stade 2, la condition de stade 1 est optimisée par le temps de croissance des cristaux. Cette stratégie peut transformer les cristaux cultivés par diffusion de vapeur en lots. Une fois que la croissance des cristaux peut se produire dans environ 24 heures, un morphogramme du mélange de protéines et de précipitants peut être tracé et utilisé comme base pour une stratégie de mise à l’échelle (étape 3). Lorsque les cristaux peuvent être cultivés par lots, il est possible de tenter de mettre à l’échelle et d’optimiser la taille et la concentration des cristaux à mesure que le volume augmente. L’endothiapepsine a été utilisée comme protéine de démonstration pour ce protocole. Certaines des décisions présentées sont spécifiques à l’endothiapepsine. Cependant, on espère que la façon dont ils ont été appliqués inspirera une façon de penser cette procédure que d’autres pourront adapter à leurs propres projets.
Introduction
La cristallographie macromoléculaire à température ambiante (RT) est à nouveau populaire au sein de la communauté de la biologie structurale. Le développement de sources lumineuses à rayons X (XFEL) a stimulé le développement d’approches de livraison d’échantillons RT 1,2,3,4, et ces méthodes ont maintenant été appliquées aux synchrotrons 5,6,7,8. Non seulement les méthodes RT ouvrent la possibilité de stratégies expérimentales pompe-sonde 9,10,11,12, mais il y a aussi de plus en plus de preuves qu’elles favorisent des états conformationnels alternatifs dans les protéines 13,14,15,16,17.
Cependant, la principale raison pour laquelle les méthodes cryogéniques ont gagné du terrain par rapport aux approches RT à la fin des années 1990 était le ralentissement des dommages causés par les rayonnements par des températures cristallines inférieures à zéro18. Les méthodes cryogéniques19 ont commencé à permettre la collecte d’un ensemble de données complet à partir d’un seul cristal de protéine. Les méthodes modernes de RT dans les XFEL et les synchrotrons ont résolu le problème des dommages causés par le rayonnement monocristallin par le développement de stratégies d’administration rapide (> 100 Hz)de cristaux 1,2,3,4. Ces méthodes permettent de collecter un ensemble de données complet à partir de milliers de cristaux exposés individuellement. Ces approches d’administration RT nécessitent donc la production de grandes quantités de solutions contenant des microcristaux homogènes (> 100 μL de cristaux < 50 μm). Cependant, étant donné que les cryo-méthodes ont tendance à ne nécessiter que des monocristaux, les méthodes de création de telles boues microcristallines ne sont actuellement pas omniprésentes dans les laboratoires de cristallographie des protéines.
Il existe des exemples dans la littérature sur la façon de faire des parties de la procédure d’optimisation de la microcristallisation pour les échantillons de cristallographie en série. Ici, une distinction doit être faite entre les protéines membranaires et solubles. Les protocoles visant à optimiser la croissance des cristaux de protéines micro-membranaires cultivés dans la monooléine (ou un autre lipide), pour la phase cubique lipidique (LCP), ont été bien décrits20,21,22. Cependant, les méthodes de microcristallisation des protéines solubles, y compris les protéines membranaires cultivées dans des conditions non LCP, font généralement défaut. Des études antérieures se sont concentrées sur des parties spécifiques du processus, telles que le criblage de microcristaux 23,24, l’amélioration de la nucléation 24 et la mise à l’échelle à l’aide de la diffusion à interface libre 25, mais pas une méthode complète.
Cependant, une méthode a récemment été décrite26 qui tente d’offrir un protocole complet. Comme beaucoup d’aspects de la cristallographie des protéines, elle n’est pas nouvelle. Bon nombre des idées proposées ont déjà été décrites par Rayment (2002)27. La méthode vise à montrer aux cristallographes comment effectuer la conversion d’un seul cristal cultivé par diffusion de vapeur en une méthodologie de lot pour cultiver des milliers de microcristaux. La méthode se concentre sur la diffusion de vapeur comme point de départ commun, car 95% de tous les dépôts de banques de données sur les protéines (PDB) proviennent de cristaux cultivés dans des plaques de diffusion de vapeur26. La diffusion de vapeur n’est cependant pas la méthode idéale pour la micro-cristallisation26, c’est pourquoi une méthodologie est décrite pour convertir la diffusion de vapeur en cristallisation par lots. Une fois que les cristaux peuvent être cultivés par lots, les voies de mise à l’échelle vers de plus grands volumes deviennent plus pratiques. Compte tenu des aléas de la cristallisation des protéines, les auteurs soulignent que cette méthode n’est pas infaillible. Cependant, le protocole devrait, au moins, fournir un aperçu de « l’espace de cristallisation » d’une protéine.
Cette méthode repose sur le diagramme de phase de cristallisation des protéines et sur la façon dont la compréhension de ce diagramme peut servir de guide lors de l’optimisation de la micro-cristallisation. Un diagramme de phase protéique est généralement représenté comme un diagramme x/y avec des concentrations de précipitants et de protéines sur les axes x et y, respectivement (Figure 1A). À partir du point d’eau pure (coin inférieur gauche – Figure 1A), la concentration de protéines et de précipitants augmente jusqu’à ce que la ligne de solubilité soit atteinte. La ligne de solubilité marque le point de sursaturation (ligne violette – Figure 1A). Lorsqu’une protéine est sursaturée, la solution devient thermodynamiquement instable et commence à se séparer en deux phases: « riche en protéines » et une solution saturée stable. Cette séparation peut se produire n’importe où au-delà de la ligne de solubilité et sa cinétique dépend des propriétés de la protéine et des composants de la solution.
Lorsque les concentrations de protéines et de précipitants sont trop élevées, la protéine se décompose de manière instable hors de la solution et donne un précipité amorphe (région rose – Figure 1A). Cependant, une séparation de phase ordonnée peut se produire dans la région de nucléation [voir Garcia-Ruiz (2003)28 pour une description détaillée] et les nucléants cristallins ont la propension à se former (région verte – Figure 1A). La nucléation et la croissance éliminent les protéines de la solution et déplacent la goutte dans la région métastable où la croissance peut se poursuivre jusqu’à ce que la ligne de solubilité soit atteinte [voir McPherson et Kuznetsov (2014)29 pour une discussion détaillée]. Le diagramme est, pour la grande majorité des conditions de cristallisation, une simplification grossière30. Indépendamment de cela, le diagramme est toujours d’une grande utilité pour les micro-cristallographes car la cartographie du diagramme permet de déterminer la ligne de solubilité et la cinétique de nucléation.
En termes de création de micro-cristaux, les deux facteurs lors de la cristallisation qui doivent être optimisés sont le nombre de cristaux (Xn) et leur dimension moyenne la plus longue (Xs). X n sera proportionnel au nombre d’événements de nucléation (n ) (Eq. 1).
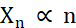 Éq. 1
Éq. 1
X s est proportionnelle à la concentration de protéines libres au-dessus de la ligne de solubilité (Ps) divisée par Xn (Eq. 2).
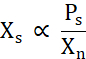 Éq. 2
Éq. 2
Dans une situation parfaite, chaque événement de nucléation produirait un cristal possible et chacun de ces cristaux aurait un accès égal à la protéine disponible en solution. La figure 2 est une représentation graphique d’un scénario idéal de la relation entre Xn et Xs. En pratique, le principal contrôle qu’un cristallographe a sur Xn et X s est en influençant la quantité de nucléation ou par l’ajout de cristaux graines. Le microcristallographe doit juger comment augmenter Xn de telle sorte qu’une concentration cristalline et une taille cristalline appropriées puissent être créées.
La majorité des techniques de cristallisation nécessitent une « période de transition » (Figure 1B). Par exemple, dans une expérience de diffusion de vapeur, lors du mélange de la protéine et des solutions précipitantes, les concentrations de chacune changeront à mesure que la goutte s’équilibre avec la solution du puits. On espère que ces changements feront progressivement passer la goutte dans la zone de nucléation où la propension à la cristallisation augmentera. Au fur et à mesure que les cristaux commencent à nucléer et à croître, la quantité de protéines en solution commence à diminuer, ce qui diminue la probabilité d’une nucléation supplémentaire. La quantité ultime de nucléation sera spécifique à la protéine et à la condition, et dépendra également de la profondeur de pénétration dans la zone de nucléation. Compte tenu de la pénétration limitée de la zone de nucléation des méthodes qui nécessitent une étape de transition, le niveau de nucléation sera finalement limité au taux de nucléation à la limite de la région de nucléation métastable.
En raison de l’importance de pouvoir améliorer le niveau de nucléation pour un micro-cristallographe, il est important de passer à une méthodologie de cristallisation par lots. Le lot peut tirer davantage parti de l’ensemble de la région de nucléation (Figure 1C). Dans les méthodes discontinues, l’idée est de mélanger la protéine et le précipitant ensemble de sorte qu’une solution sursaturée soit créée sans qu’il soit nécessaire de modifier les concentrations des composants. La nucléation devrait être possible immédiatement après le mélange. Les méthodes batch permettent donc d’atteindre théoriquement toute la zone de nucléation. Toute augmentation de la cinétique de nucléation au-delà de la limite de nucléation métastable peut alors être utilisée.
Si le niveau basal de nucléation cristalline n’est pas suffisant pour générer un grand Xn, des méthodes de micro-ensemencement peuvent être utilisées. Dans le micro-ensemencement, les cristaux pré-cultivés sont brisés pour créer une boue de fragments cristallins qui peut agir comme un échafaudage pour la croissance des cristaux frais31,32. Le micro-ensemencement a été largement utilisé dans la préparation d’échantillons cristallographiques en série comme moyen d’augmenter Xn sans avoir besoin d’augmenter la nucléation cristalline (Figure 1C).
La transition de la diffusion de vapeur au lot peut être visualisée sur un diagramme de phase comme déplaçant le point de départ expérimental des régions non sursaturées ou métastables vers la zone de nucléation. Cela peut être fait en augmentant les concentrations de protéines et/ou de précipitants, et/ou le rapport des deux dans la goutte (Figure 1D), et en observant quelles conditions produisent des cristaux apparaissant rapidement (< 24 h)26. L’équilibrage complet des gouttes de diffusion de vapeur peut prendre des jours ou des semaines33. Par conséquent, en recherchant des conditions qui montrent des cristaux apparaissant rapidement, les conditions des lots peuvent être trouvées sans avoir à passer à d’autres formats de criblage de cristallisation tels que le micro-lot34,35,36,37.
Une fois que la zone de nucléation a été trouvée, une condition de lot a été trouvée et un morphogramme – ici, un diagramme de phase approximatif – peut être créé. Le morphogramme est d’une grande utilité lorsqu’il s’agit d’utiliser un protocole de lot ensemencé ou de lot direct. En traçant le Xn en fonction de la concentration en protéines et en précipitants, on peut évaluer la cinétique de nucléation26. Si X n reste faible dans toute la région de nucléation, un lot ensemencé peut être nécessaire pour rendre Xn assez grand pour limiter la croissance cristalline. Cette évaluation est la première étape du processus de mise à l’échelle vers des volumes plus importants (> 100 μL).
Cette méthode a été conçue de manière à pouvoir être réalisée dans la majorité des laboratoires de cristallisation en utilisant un équipement standard de cristallisation par diffusion de vapeur. De nombreuses études ont également été menées qui décrivent des techniques pour faciliter de nombreuses parties de ce processus, si l’équipement est disponible. Ceux-ci incluent, mais ne sont pas limités à, la diffusion dynamique de la lumière (DLS)25,27, l’imagerie non linéaire 20,24,25, la diffraction des poudres 20,24,27 et la microscopie électronique 26 [voir Cheng et al. (2020)40 pour une belle revue].
L’objectif de ce travail est de fournir une démonstration visuelle de la méthode de transition de la cristallisation par diffusion de vapeur en petit volume ( 100 μL). L’endothiapepsine de Cryphonectria parasitica a été utilisée comme exemple de système pour démontrer cette traduction. Le type d’expérience et la méthode d’administration d’échantillons pour lesquels les microcristaux sont nécessaires influenceront la sortieidéale de Xs 26. Pour les expériences de mélange nécessitant une résolution temporelle de l’ordre de la milliseconde41 ou des buses virtuellesdynamiques en phase gazeuse42, un X s final de < 5 μm peut être souhaitable. Dans ce cas, l’objectif était de produire des cristaux de protéines diffractés à environ 1,5 Å, pour une expérience pompe-sonde activée par photon, et en utilisant une approche de livraison à cible fixe.
Pour illustrer les besoins en échantillons d’une telle expérience de cristallographie en série utilisant l’endothiapepsine, le tableau 1 montre les paramètres expérimentaux d’une expérience hypothétique. L’échantillon d’information était basé sur le protocole décrit ci-dessous. Compte tenu de certaines estimations prudentes sur les taux de réussite et les exigences de collecte de données, 50 mg est l’estimation de la consommation totale de l’échantillon pour l’ensemble de l’expérience.
La figure 3 montre un organigramme du processus d’optimisation complet depuis la cristallisation initiale par diffusion de vapeur à petit volume jusqu’au lot à grande échelle. Pour la majorité des projets de cristallographie en série, ce protocole commencera à l’étape 2 : « transition vers le lot », puisque la protéine cible aura déjà été cristallisée. Cependant, l’étape 1 a été incluse pour être complète et pour rappeler aux lecteurs son importance. Trouver une condition qui donne lieu à un cristal simple, grand et bien diffractant est le meilleur point de départ pour l’optimisation des microcristaux. À l’étape 2, cette condition peut ensuite être optimisée de la diffusion de vapeur au lot, et un morphogramme des régions de nucléation et métastables peut être tracé. Une fois cette opération effectuée, la mise à l’échelle de la condition de lot à des volumes plus importants peut être effectuée à l’étape 3. À la fin de l’organigramme, un cristallographe aura créé un protocole de microcristallisation reproductible et de grand volume (> 100 μL) pour l’endothiapepsine. Cette méthode peut ensuite être appliquée à leur protéine d’intérêt particulière.
Protocol
Representative Results
Discussion
La méthode présentée montre comment optimiser la cristallisation de l’endothiapepsine à partir de gros cristaux (≥ dimension la plus longue de 100 μm), cultivés dans des cribles à 96 puits à matrice clairsemée, à des microcristaux, cultivés dans des tubes à centrifuger (volume de 300 μL) par lots. L’idée derrière le protocole est que les mesures prises pour optimiser l’endothiapepsine pourraient également être utilisées pour d’autres protéines. En fin de compte, répondre au problème de la création de grands volumes (>100 μL) de microcristaux (10-20 μm) pour des expériences de cristallographie en série dans des XFEL et des synchrotrons.
Le protocole divise la tâche de microcristallisation à grand volume en trois étapes: (1) optimisation de la morphologie cristalline, (2) transition vers le lot et (3) mise à l’échelle. À l’étape 1, la gamme de formes cristallines qu’une protéine peut créer doit être explorée dans des plaques de diffusion de vapeur. Les conditions qui donnent naissance à des cristaux uniques en forme de boîte qui diffractent à la résolution requise devraient être l’objectif. À l’étape 2, les conditions sélectionnées peuvent ensuite être transformées de la diffusion de vapeur en lot. Ici, le critère d’optimisation est le temps de croissance des cristaux et de trouver des conditions qui donnent naissance à des cristaux de protéines dans les 24 heures. Un morphogramme peut également être tracé donnant à l’expérimentateur une idée de l’emplacement de la ligne de solubilité et des limites de la zone de nucléation. Ce morphogramme est d’une grande utilité à l’étape 3, Mise à l’échelle. Le morphogramme indiquera si la nucléation seule peut augmenter Xn et faire descendre Xs. Au fur et à mesure que le volume de l’expérience augmente, Xn et Xs peuvent être continuellement évalués comme les critères clés du succès de la mise à l’échelle.
Dans le cas de l’endothiapepsine, l’étape 1 a mis au jour ce qui était potentiellement une morphologie cristalline jusqu’alors inconnue pour l’endothiapepsine. Cette morphologie avait le même groupe spatial que ceux précédemment rapportés mais, ce qui est important pour la cristallographie en série, une forme plus en forme de boîte. Les monocristaux semblaient également se développer à partir de points de nucléation simples, contrairement aux ventilateurs créés à partir d’autres conditions (Figure 4). Pour la condition sélectionnée, l’étape 2 était déjà partiellement satisfaite car la croissance des cristaux s’est produite en < 24 heures. Le morphogramme indiquait qu’un protocole de lot direct ou ensemencé pouvait réussir lors de la mise à l’échelle à l’étape 3. La mise à l’échelle initiale en lot direct, a créé une condition qui a produit des cristaux avec une gamme Xn et Xs de 3,6 ± 1,2 x 106 cristaux ·mL-1 et 42 ± 4,1 μm, respectivement. Ces cristaux, bien qu’acceptables pour certaines expériences de cristallographie en série, ont été jugés trop gros. Des optimisations supplémentaires ont donc été effectuées. Le protocole final a produit des cristaux avec une concentration et une gamme de taille de 3,1 x 106 cristaux·mL-1 et 15 ± 3,9 μm, respectivement. C’était plus qu’idéal pour les expériences prévues.
La méthode se concentre sur la transformation en lots de cristaux de protéines « solubles » cultivés dans des plaques de diffusion de vapeur. La raison de cette focalisation est que la grande majorité des cristaux de protéines solubles sont cultivés par diffusion de vapeur26. Cependant, les concepts présentés pourraient également être appliqués à des cristaux de protéines solubles cultivés à l’aide d’autres méthodes, telles que les micro-lots. Les concepts peuvent également s’appliquer aux cristaux de protéines membranaires cultivés en LCP; car il s’agit également d’un processus de cristallisation par lots.
Un aspect clé du protocole est le processus de transformation des conditions des cristaux cultivés dans des plaques de diffusion de vapeur afin qu’ils puissent être cultivés par lots. Pour cette transformation, la méthode utilise le critère proposé par Beale et al. (2019)26. Les cristaux cultivés par un procédé discontinu, même dans des plaques de diffusion de vapeur, se formeront rapidement (< 24 h). Ce critère est une approximation basée sur la vitesse d’équilibration des gouttes de diffusion de vapeur, et est particulièrement vrai pour les conditions précipitantes basées sur le PEG. Cependant, les conditions de cristallisation contiendront une grande variété de composés qui influenceront le temps d’équilibre. L’équilibrage des conditions de cristallisation à base de sel, par exemple le chlorure d’ammonium hautement concentré, peut se produire en 1-2 jours. Par conséquent, le critère des 24 h peut ne pas être vrai pour les conditions à base de sel. Les conditions à base de sel peuvent également avoir des diagrammes de phase plus complexes26,30 qui peuvent ne pas être conformes à l’archétype présenté dans ce protocole. Une réduction du critère de temps pour les conditions à base de sel à 12 ou 6 heures peut être nécessaire si la mise à l’échelle en plus grands volumes s’avère impossible.
Une autre limite de cette méthode est sa complexité apparente. Le protocole qui a été suivi pour optimiser la micro-cristallisation de l’endothiapepsine a en fait changé relativement peu l’état d’origine du criblage à matrice clairsemée. Le premier résultat observé dans le criblage PACT était de 0,1 HEPES pH 7,0, 0,2 M MgCl2 et 20% (p/v) PEG 6 000. Le tampon de cristallisation à l’échelle finale était de 0,1 Tris-HCl pH 7,0, 0,15 M MgCl2 et 40 % (p/v) PEG 6 000. Il est également très possible que le changement de tampon de HEPES à Tris-HCl, et la concentration de MgCl2 , aient peu contribué au succès du processus. Laisser l’augmentation de la concentration de PEG 6 000 comme seule optimisation, et celle qui aurait pu être réalisée tout simplement.
Cependant, cette évaluation est également trop simpliste. Cela ne tient pas compte seulement des problèmes rencontrés lors du détartrage (c’est-à-dire l’utilisation de graines et la trempe), mais aussi du fait que ce n’est pas parce que cette protéine s’est avérée simple que la prochaine s’avérera également être. Les étapes conseillées dans le protocole ont été conçues parce que l’optimisation de la mise à l’échelle des volumes de cristallisation des protéines peut être très coûteuse en protéines. Au cours des sept essais de détartrage de l’endothiapepsine qui sont montrés, 100 mg de protéines ont été consommés. Certes, certaines de ces étapes ont été effectuées pour montrer leurs conséquences à la lumière de ce protocole. Même ainsi, 100 mg d’une protéine, plus potentiellement 50 mg supplémentaires pour les protéines consommées au cours d’une expérience (tableau 1), peuvent être un investissement important en temps ou en argent.
Heureusement, il n’est pas clair que cette masse d’échantillon requis soit omniprésente dans toutes les protéines. L’endothiapepsine était très soluble et nécessitait donc une forte concentration de protéines pour atteindre la sursaturation. Dans d’autres (actuellement en cours d’optimisation), la sursaturation peut être atteinte à 10 voire 5 mg/mL. Ces variables sont spécifiques aux protéines et doivent être adoptées lorsqu’elles apparaissent.
Parmi les autres limites de la méthode, citons sa dépendance à l’égard d’équipements complexes tels que des robots de manipulation de liquides pour la création de cribles et de plaques, et des imageurs pour imager automatiquement les plaques en cas de besoin. Des routines alternatives ont été proposées pour limiter le besoin de certains de ces équipements, mais le protocole prendra plus de temps à suivre sans elles. Le protocole suggère également de tester la diffraction de cristaux optimisés. Pour les cristallographes qui n’ont pas d’accès régulier à un synchrotron, ces tests pourraient s’avérer difficiles. Des contrôles à chaque étape peuvent ne pas être nécessaires, mais ces tests sont fortement recommandés une fois qu’un résultat positif a été identifié, ainsi qu’avant et après la mise à l’échelle. Les cristaux non diffractés dans un XFEL ne sont malheureusement pas rares. Compte tenu de cela, il est préférable de pécher par excès de prudence en ce qui concerne les hypothèses sur la diffraction cristalline.
En fin de compte, ce protocole et les résultats présentés ici offriront un guide, des idées et un exemple à ceux qui luttent avec la production d’échantillons pour des expériences de cristallographie en série. Espérons qu’au fur et à mesure que la cristallographie en série sera développée, les demandes d’échantillons de la technique seront réduites de sorte que le besoin de protocoles comme celui-ci sera réduit. Cependant, même dans cet événement, les stratégies présentées ici seront toujours utiles à ceux qui souhaitent explorer l’espace de cristallisation de leur protéine.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Ce projet a reçu un financement du programme de recherche et d’innovation Horizon 2020 de l’Union européenne dans le cadre de la convention de subvention Marie Skłodowska-Curie n° 701647. Merci beaucoup pour l’aide et le soutien des scientifiques de la ligne de faisceau de la ligne de faisceau X10SA-PXII de la Source de Lumière Suisse.
Materials
| Swissci 96-well 2-Drop plates | Molecular Dimensions | MD11-002 | 96-well 2-drop crystallisation plate |
| Swissci 96-well 3-Drop plates | Molecular Dimensions | MD11-003 | 96-well 3-drop crystallisation plate |
| mosquito LCP liquid handling robot | sptlabtech | mosquito LCP | Crystallisation robot |
| ClearVue Sheets | Molecular Dimensions | MD6-015 | 96-well crystallization plate seals |
| Safe-Tube 1.5 mL | Eppendorf | 30120086 | 1.5 mL centrifuge tubes |
| Scaple | Swan and Morton | No. 3 scalple and No. 3 handle | Scalple for cutting open plate seals |
| MS 3 Vortex | IKA | 3319000 | Vortex for mixing solution and making seed stocks |
| 24-well XRL Plate | Molecular Dimensions | MD3-11 | 24-well hanging-drop plates |
| Tube revolver/rotator | Thermo Fischer Scientific | 88881001 | Tube revolver for mixing solution during scaling |
| Eppendorf Research plus pipettes | Eppendorf | Range of manual pipettes, 0.5-10, 1-20, 10-100, 100-1000 µL | |
| Eppendorf pipette tips | Eppendorf | Range of tip sizes for manual pipettes | |
| Suparen 600 | Prochem AG | Suparen 600 | Endothiapepsin solution |
| Sodium Acetate | Sigma-Aldrich | 241245-1KG | Sodium Acetate |
| Tris | Merck | 8382T014 | Tris |
| Magnesium Chloride | Sigma-Aldrich | M2670-1kg | Magnesium Chloride |
| PEG 6,000 | Sigma-Aldrich | 81255-1kg | PEG 6,000 |
| Ethelyene glycol | Sigma-Aldrich | 324558-1L | Ethelyene glycol for cyro-protecting the crystals |
| PACT Premier HT screen | Molecular Dimensions | MD1-36 | PACT Premier 96-well crystal screen |
| DOW CORNING high vacuum grease | Molecular Dimensions | MD6-02 | Grease for sealing 24-well plates |
| Hirschmann 22 x 22 mm glaser cover slides | Hirschmann | 8000104 | Cover slides for sealing 24-well sitting drop plates |
| Crystal pins | PSI | Manufactured inhouse | Thin-film supports for micro-crystals. |
| 1-1.3 mm SiLibeads Type S | Faust | 6239547 | Glass beads for making mico-seed stocks |
| Macbook Pro | Apple | Macbook Pro | Computer for performing data analysis |
| CCP4 software suite | CCP4 | Diffraction pattern data processing software | |
| Excel | Microsoft | Microsoft Office | Plotting tool for phase diagram |
| Hausser Scientific Bright-Line counting chamber | Thermo Fischer Scientific | 02-671-51B | Tool to calculate crystal concentration |
| PACT Premier | Molecular Dimensions | MD1-29-ECO | Sparse-matrix crystallization screen |
| Rock Imager | Formulatrix | Rock Imager | Temperature controlled crystal plate storage and imager |
| Rock MakerWeb | Formulatrix | Rock MakerWeb | Crystal plate creation and image storage stoftware |
| Formulator | Formulatrix | Formulator | 96-well crystal screen creation liquid handling robot |
| Leica MZ16 Microscope | Leica | Leica MZ16 | Light microscope |
| LAS V4.6 | Leica | LAS V4.6 | Software for Leica microscopes |
| Spectra/Por 3.5 kDa dialysis tubing | Spectrumlabs | Spectra/Por 3 Dialysis Membrane | 3.5 kDa dialysis membrane |
| Dialysis tubing closures | Spectrumlabs | Spectra/Por 3 Duniversal Closures | Clips to seal the dialysis tubing ends |
| Amicon 10 kDa centrifugal concentrator | Merck-Millipore | Amicon Ultra-15 10 kDa centrifugal concentrator | 10 kDa centrifugal filter |
| 5810 R swing bucket centrifuge | Eppendorf | 5810 R Centrifuge | Swing bucket centrifuge |
References
- DePonte, D. P., et al. Gas dynamic virtual nozzle for generation of microscopic droplet streams. Journal of Physics D: Applied Physics. 41 (19), 195505 (2008).
- Hunter, M. S., et al. Fixed-target protein serial microcrystallography with an x-ray free electron laser. Scientific Reports. 4 (1), 6026 (2014).
- Weierstall, U., et al. Lipidic cubic phase injector facilitates membrane protein serial femtosecond crystallography. Nature Communications. 5 (1), 1-6 (2014).
- Roessler, C. G. G., et al. Acoustic Injectors for Drop-On-Demand Serial Femtosecond Crystallography. Structure. 24 (4), 631-640 (2016).
- Sherrell, D. A., et al. A modular and compact portable mini-endstation for high-precision, high-speed fixed target serial crystallography at FEL and synchrotron sources. Journal of Synchrotron Radiation. 22 (6), 1372-1378 (2015).
- Roedig, P., et al. A micro-patterned silicon chip as sample holder for macromolecular crystallography experiments with minimal background scattering. Scientific Reports. 5 (1), 1-11 (2015).
- Botha, S., et al. Room-temperature serial crystallography at synchrotron X-ray sources using slowly flowing free-standing high-viscosity microstreams. Acta Crystallographica Section D Biological Crystallography. 71 (2), 387-397 (2015).
- Weinert, T., et al. Serial millisecond crystallography for routine room-temperature structure determination at synchrotrons. Nature Communications. 8 (1), 542 (2017).
- Tenboer, J., et al. Time-resolved serial crystallography captures high-resolution intermediates of photoactive yellow protein. Science. 346 (6214), 1242-1246 (2014).
- Nango, E., et al. A three-dimensionalmovie of structural changes in bacteriorhodopsin. Science. 354 (6319), 1552-1557 (2016).
- Suga, M., et al. Light-induced structural changes and the site of O=O bond formation in PSII caught by XFEL. Nature. 543 (7643), 131-135 (2017).
- Mehrabi, P., et al. Liquid application method for time-resolved analyses by serial synchrotron crystallography. Nature Methods. 16 (10), 979-982 (2019).
- Halle, B. Biomolecular cryocrystallography: structural changes during flash-cooling. Proceedings of the National Academy of Sciences of the United States of America. 101 (14), 4793-4798 (2004).
- Fraser, J. S., et al. Hidden alternative structures of proline isomerase essential for catalysis. Nature. 462 (7273), 669-673 (2009).
- Fenwick, R. B., van den Bedem, H., Fraser, J. S., Wright, P. E. Integrated description of protein dynamics from room-temperature X-ray crystallography and NMR. Proceedings of the National Academy of Sciences of the United States of America. 111 (4), 445-454 (2014).
- Keedy, D. A., et al. Mapping the conformational landscape of a dynamic enzyme by multitemperature and XFEL crystallography. Elife. 4, (2015).
- Thomaston, J. L., et al. XFEL structures of the influenza M2 proton channel: Room temperature water networks and insights into proton conduction. Proceedings of the National Academy of Sciences of the United States of America. 114 (51), 13357-13362 (2017).
- Haas, D. J., Rossmann, M. G. Crystallographic studies on lactate dehydrogenase at -75 °C. Acta Crystallographica Section B Structural Crystallography and Crystal Chemistry. 26 (7), 998-1004 (1970).
- Hope, H. Cryocrystallography of biological macromolecules: a generally applicable method. Acta Crystallographica Section B Structural Science. 44 (1), 22-26 (1988).
- Wu, W., et al. Batch crystallization of rhodopsin for structural dynamics using an X-ray free-electron laser. Acta Crystallographica Section:F Structural Biology Communications. 71 (7), 856-860 (2015).
- Ishchenko, A., Cherezov, V., Liu, W. Preparation and delivery of protein microcrystals in lipidic cubic phase for serial femtosecond crystallography. Journal of Visualized Experiments. (115), e54463 (2016).
- Andersson, R., et al. Well-based crystallization of lipidic cubic phase microcrystals for serial X-ray crystallography experiments. Acta Crystallographica Section D: Structural Biology. 75 (10), 937-946 (2019).
- Luft, J. R., et al. The detection and subsequent volume optimization of biological nanocrystals. Structural Dynamics. 2 (4), 041710 (2015).
- Lee, D. B., et al. Supersaturation-controlled microcrystallization and visualization analysis for serial femtosecond crystallography. Scientific Reports. 8 (1), 1-10 (2018).
- Kupitz, C., et al. Microcrystallization techniques for serial femtosecond crystallography using photosystem II from Thermosynechococcus elongatus as a model system. Philosophical transactions of the Royal Society of London. Series B, Biological Sciences. 369 (1647), 20130316 (2014).
- Beale, J. H., et al. Successful sample preparation for serial crystallography experiments. Journal of Applied Crystallography. 52, 1385-1396 (2019).
- Rayment, I. Small-scale batch crystallization of proteins revisited: An underutilized way to grow large protein crystals. Structure. 10 (2), 147-151 (2002).
- García-Ruiz, J. M. Nucleation of protein crystals. Journal of Structural Biology. 142 (1), 22-31 (2003).
- McPherson, A., Kuznetsov, Y. G. Mechanisms, kinetics, impurities and defects: Consequences in macromolecular crystallization. Acta Crystallographica Section F:Structural Biology Communications. 70 (4), 384-403 (2014).
- Rupp, B. Origin and use of crystallization phase diagrams. Acta crystallographica. Section F, Structural biology communications. 71, 247-260 (2015).
- Luft, J. R., DeTitta, G. T. A method to produce microseed stock for use in the crystallization of biological macromolecules. Acta Crystallographica Section D Biological Crystallography. 55 (5), 988-993 (1999).
- Ireton, G. C., Stoddard, B. L. Microseed matrix screening to improve crystals of yeast cytosine deaminase. Acta crystallographica. Section D, Biological crystallography. 60 (3), 601-605 (2004).
- Forsythe, E. L., Maxwell, D. L., Pusey, M. Vapor diffusion, nucleation rates and the reservoir to crystallization volume ratio. Acta Crystallographica Section D Biological Crystallography. 58 (10), 1601-1605 (2002).
- Chayen, N. E., Shaw Stewart, P. D., Maeder, D. L., Blow, D. M. IUCr An automated system for micro-batch protein crystallization and screening. Journal of Applied Crystallography. 23 (4), 297-302 (1990).
- Chayen, N. E., Shaw Stewart, P. D., Blow, D. M. Microbatch crystallization under oil – a new technique allowing many small-volume crystallization trials. Journal of Crystal Growth. 122 (1-4), 176-180 (1992).
- Chayen, N. E. Comparative studies of protein crystallization by vapour-diffusion and microbatch techniques. Acta Crystallographica Section D: Biological Crystallography. 54 (1), 8-15 (1998).
- D’Arcy, A., Mac Sweeney, A., Stihle, M., Haber, A. The advantages of using a modified microbatch method for rapid screening of protein crystallization conditions. Acta Crystallographica – Section D Biological Crystallography. 59 (2), 396-399 (2003).
- Darmanin, C., et al. Protein crystal screening and characterization for serial femtosecond nanocrystallography. Scientific Reports. 6, 25345 (2016).
- Gati, C., et al. Atomic structure of granulin determined from native nanocrystalline granulovirus using an X-ray free-electron laser. Proceedings of the National Academy of Sciences of the United States of America. 114 (9), 2247-2252 (2017).
- Cheng, R. K. Y. Towards an optimal sample delivery method for serial crystallography at XFEL. Crystals. 10 (3), 215 (2020).
- Schmidt, M. Mix and Inject: Reaction Initiation by Diffusion for Time-Resolved Macromolecular Crystallography. Advances in Condensed Matter Physics. 2013, 1-10 (2013).
- Oberthuer, D., et al. Double-flow focused liquid injector for efficient serial femtosecond crystallography. Scientific Reports. 7 (1), 44628 (2017).
- McPherson, A., Gavira, J. A. Introduction to protein crystallization. Acta crystallographica. Section F, Structural biology communications. 70, 2-20 (2014).
- Yaoi, M., et al. Effect of stirring method on protein crystallization. Japanese Journal of Applied Physics, Part 2: Letters. 43 (10), 1318 (2004).
- Castro, F., Ferreira, A., Teixeira, J. J., Rocha, F. Influence of Mixing Intensity on Lysozyme Crystallization in a Meso Oscillatory Flow Reactor. Crystal Growth & Design. 18 (10), 5940-5946 (2018).
- Moews, P. C., Bunn, C. W. An X-ray crystallographic study of the rennin-like enzyme of Endothia parasitica. Journal of Molecular Biology. 54 (2), 395-397 (1970).
- Newman, J., et al. Towards rationalization of crystallization screening for small- to medium-sized academic laboratories: the PACT/JCSG+ strategy. Acta crystallographica. Section D, Biological. 61, 1426-1431 (2005).
- Ebrahim, A., et al. Resolving polymorphs and radiation-driven effects in microcrystals using fixed-target serial synchrotron crystallography. Acta Crystallographica Section D Structural Biology. 75, 151-159 (2019).
- Davy, B., et al. Reducing sample consumption for serial crystallography using acoustic drop ejection. Journal of Synchrotron Radiation. 26 (5), (2019).

