הפריה זמן לשגות הדמיה תא חי כדי לחקור את העברת תאים לכיוון האיבר של קורטי
Summary
במחקר זה, אנו מציגים שיטת הדמיה בזמן אמת באמצעות מיקרוסקופיה קונפוקלית כדי להתבונן בתאים הנעים לכיוון רקמה פגומה על ידי דגירה ex vivo עם אפיתל שבלול המכיל את האיבר של קורטי.
Abstract
כדי לחקור את ההשפעות של תאי גזע mesenchymal (MSCs) על התחדשות התא וטיפול, שיטה זו עוקבת אחר נדידת MSC ושינויים מורפולוגיים לאחר תרבות משותפת עם אפיתל שבלול. האיבר של קורטי היה משותק על כיסוי פלסטיק על ידי לחיצה על חלק מהקרום של רייסנר שנוצר במהלך הניתוח. MSCs מוגבל על ידי גליל זכוכית היגר לכיוון אפיתל cochlear כאשר הצילינדר הוסר. לוקליזציה השלטת שלהם נצפתה modiolus של האיבר של קורטי, מיושר בכיוון דומה לזה של סיבי העצב. עם זאת, כמה MSCs היו לוקליזציה באזור הלימבוס והראה צורה מוארכת אופקית. בנוסף, ההגירה לאזור תאי השיער הוגדלה, והמורפולוגיה של ה- MSCs השתנתה לצורות שונות לאחר הטיפול בקנאמיצין. לסיכום, תוצאות מחקר זה מצביעות על כך שהשיתוף של MSCs עם אפיתל שבלול יהיה שימושי להתפתחות טיפולית באמצעות השתלת תאים ולחיקרי התחדשות תאים שיכולים לבחון תנאים וגורמים שונים.
Introduction
אובדן שמיעה יכול להתרחש מולדת או יכול להיגרם בהדרגה על ידי מספר גורמים, כולל הזדקנות, תרופות, ורעש. אובדן שמיעה הוא לעתים קרובות קשה לטפל כי זה מאוד מאתגר לשחזר תפקוד לקוי פעם תאי השיער האחראים על השמיעה פגומים1. על פי ארגון הבריאות העולמי, 461 מיליון בני אדם ברחבי העולם מעריכים כי יש אובדן שמיעה, המהווה 6.1% מאוכלוסיית העולם. מבין הסובלים מירידה בשמיעה, 93% הם מבוגרים ו-7% הם ילדים.
מספר גישות נוסו לטפל באובדן שמיעה; יש לציין כי גישת התחדשות באמצעות MSCs התפתחה כטיפול מבטיח. כאשר הרקמה פגומה, MSCs משתחררים באופן טבעי לתוך מערכת הדם ונדדים לאתר הפציעה שבו הם מפרישים מולקולות שונות כדי ליצור microenvironment המקדםהתחדשות 2. לפיכך, חשוב לפתח שיטה לטיפול ברקמות פגומות באמצעות הגירה של MSCs מושתל חיצונית כדי למקד איברים ואת הפרשתם הבאים של מולקולות הגורמות ויסות חיסוני חזק, אנגיוגנזה, ואנטי אפופטוזיס כדי לשפר את השיקום של תפקוד התא הפגוע3,4,5.
תהליך הביות שבו MSCs נודדים לרקמות פגומות עשוי להיות המכשול החשוב ביותר להתגבר עליו. MSCs יש מנגנון ביות מערכתי עם שלבים רציפים של קשירה / גלגול, הפעלה, מעצר, גלגול /diapedesis, והגירה6,7,8. נכון לעכשיו, נעשים מאמצים לזהות דרכים לשיפור צעדים אלה. אסטרטגיות שונות, כולל שינוי גנטי, הנדסת משטח התא, הפריה חוץ גופית, והדרכה מגנטית, נבדקו6,7. בנוסף, נעשו מספר ניסיונות לקדם את ההגנה וההתחדשות של תאי שיער שמיעתיים על ידי ביות MSCs לאתר של שבלול פגום. עם זאת, מעקב אחר MSCs ב vivo הוא זמן רב ועבודה אינטנסיבית ודורש מיומנויות מיוחדות מאוד9.
כדי לפתור בעיה זו, פותחה שיטה לבחינת הביות של MSCs בשבלול באמצעות מיקרוסקופיה קונפוקלית של זמן לשגות המצלם את נדידת התאים במשך מספר שעות (איור 1). הוא פותח בתחילת המאה ה-20 והפך לאחרונה לכלי רב עוצמה לחקר הגירה של תאים ספציפיים.
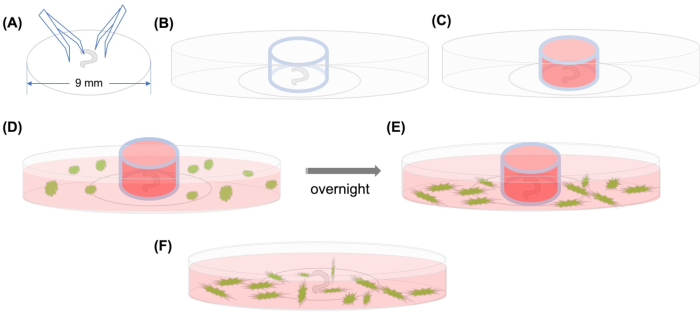
איור 1: תקציר גרפי. (A) לאחר שהאיבר המנותח של קורטי דבק בכיסוי פלסטיק באמצעות מלקחיים, הכיסוי ממוקם על צלחת מיקרוסקופית עם תחתית זכוכית 35 מ”מ, ו- (B) גליל הזכוכית ממוקם. (C) לאחר מילוי החלק הפנימי של גליל הזכוכית עם בינוני, (D) GFP שכותרתו MSCs עם בינוני מתווספים בזהירות מחוץ הצילינדר. (E)לאחר הדגירה בן לילה,(F)הצילינדר זכוכית מוסר, ותמונות נלקחות עם מיקרוסקופ confocal. קיצורים: GFP = חלבון פלואורסצנטי ירוק; MSCs = תאי גזע mesenchymal. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Protocol
Representative Results
Discussion
השתלת MSCs לאתרים פגומים כדי לקדם את ההתחדשות של תאים פגומים נחקרה בהרחבה, ואת ההשפעה הטיפולית ניכרת. ההשתלה והבידול הבאים של MSCs דווחו כדי לשחזר את השמיעה בחולדות עם אובדן שמיעה המושרה על ידי חומצה 3-nitropropionic13. למרות לי ואח ‘להחיל MSCs על בני אדם טרנס-ורידים, הם לא השיגו שום שיפור משמ…
Disclosures
The authors have nothing to disclose.
Acknowledgements
עבודה זו נתמכה על ידי מענקי מחקר (NRF-2018-R1D1A1B0705050175, HURF-2017-66) מקרן המחקר הלאומית (NRF) של קוריאה וקרן המחקר של אוניברסיטת האלים.
Materials
| 10X PBS Buffer | GenDEPOT | P2100-104 | |
| 4% Formalin | T&I | BPP-9004 | |
| Ampicillin | sigma | A5354-10ml | |
| BSA | sigma | A4503-100G | |
| confocal dish | SPL | 200350 | |
| confocal microscope | ZEISS | LSM800 | |
| coverslip | SPL | 20009 | |
| DMEM/F12 | Gibco | 10565-018 | |
| Fetal Bovine Serum | Thermo Fisher scientific | 16140071 | |
| Fluorsheild with DAPI | sigma | F6057 | |
| Forcep | Dumont | 0508-L5-P0 | |
| HBSS | Thermo Fisher scientific | 14065056 | |
| HEPES | Thermo Fisher scientific | 15630080 | |
| N2 supplement | Gibco | 17502-048 | |
| Phalloidin-iFluor 647 Reagent | abcam | ab176759 | |
| Stage Top Incubator | TOKAI HIT | WELSX | |
| Strain C57BL/6 mouse messenchymal stem cells with GFP | cyagen | MUBMX-01101 | |
| Triton X-100 | sigma | T8787 |
References
- Brown, C. S., Emmett, S. D., Robler, S. K., Tucci, D. L. Global hearing loss prevention. Otolaryngologic Clinics of North America. 51 (3), 575-592 (2018).
- Chamberlain, G., Fox, J., Ashton, B., Middleton, J. Concise review: mesenchymal stem cells: their phenotype, differentiation capacity, immunological features, and potential for homing. Stem Cells. 25 (11), 2739-2749 (2007).
- Fu, X., et al. Mesenchymal stem cell migration and tissue repair. Cells. 8 (8), (2019).
- Uder, C., Brückner, S., Winkler, S., Tautenhahn, H. M., Christ, B. Mammalian MSC from selected species: Features and applications. Cytometry A. 93 (1), 32-49 (2018).
- Rojewski, M. T., et al. Translation of a standardized manufacturing protocol for mesenchymal stromal cells: A systematic comparison of validation and manufacturing data. Cytotherapy. 21 (4), 468-482 (2019).
- Ullah, M., Liu, D. D., Thakor, A. S. Mesenchymal stromal cell homing: Mechanisms and strategies for improvement. iScience. 15, 421-438 (2019).
- Ahn, Y. J., et al. Strategies to enhance efficacy of SPION-labeled stem cell homing by magnetic attraction: a systemic review with meta-analysis. International Journal of Nanomedicine. 14, 4849-4866 (2019).
- Alon, R., Ley, K. Cells on the run: shear-regulated integrin activation in leukocyte rolling and arrest on endothelial cells. Current Opinion in Cell Biology. 20 (5), 525-532 (2008).
- Sykova, E., Jendelova, P. In vivo tracking of stem cells in brain and spinal cord injury. Progress in Brain Research. 161, 367-383 (2007).
- Landegger, L. D., Dilwali, S., Stankovic, K. M. Neonatal murine cochlear explant technique as an in vitro screening tool in hearing research. Journal of Visualized Experiments. (124), e55704 (2017).
- Pijuan, J., et al. In vitro cell migration, invasion, and adhesion assays: From cell imaging to data analysis. Frontiers in Cell and Developmental Biology. 7, 107 (2019).
- Rask-Andersen, H., et al. Human cochlea: anatomical characteristics and their relevance for cochlear implantation. The Anatomical Record. 295 (11), 1791-1811 (2012).
- Kamiya, K., et al. Mesenchymal stem cell transplantation accelerates hearing recovery through the repair of injured cochlear fibrocytes. The American Journal of Pathology. 171 (1), 214-226 (2007).
- Lee, H. S., Kim, W. J., Gong, J. S., Park, K. H. Clinical safety and efficacy of autologous bone marrow-derived mesenchymal stem cell transplantation in sensorineural hearing loss patients. Journal of Audiology and Otology. 22 (2), 105-109 (2018).
- Vanden Berg-Foels, W. S. In situ tissue regeneration: chemoattractants for endogenous stem cell recruitment. Tissue Engineering Part B: Reviews. 20 (1), 28-39 (2014).
- Parker, M., Brugeaud, A., Edge, A. S. Primary culture and plasmid electroporation of the murine organ of Corti. Journal of Visualized Experiments. (36), e1685 (2010).
- Ogier, J. M., Burt, R. A., Drury, H. R., Lim, R., Nayagam, B. A. Organotypic culture of neonatal murine inner ear explants. Frontiers in Cellular Neuroscience. 13, 170 (2019).
- Oshima, K., et al. Mechanosensitive hair cell-like cells from embryonic and induced pluripotent stem cells. Cell. 141 (4), 704-716 (2010).

