体外延时活细胞成像探索细胞向科尔蒂器官迁移
Summary
在这项研究中,我们提出了一种实时成像方法,使用共聚焦显微镜观察细胞通过与含有Corti器官的耳蜗上皮的外活体孵化向受损组织移动。
Abstract
为了研究间质干细胞(MSCs)对细胞再生和治疗的影响,该方法跟踪MSC迁移和与声蜗上皮共同培养后的形态变化。Corti 的器官通过按压解剖过程中产生的里斯纳膜的一部分,在塑料盖上固定。当气缸被移除时,被玻璃缸限制的 MSC 迁移到高音表皮。它们的主要定位是在科尔蒂器官的修饰中观察到的,其方向与神经纤维的方向相似。然而,一些MSC在limbus区域被本地化,并显示出水平拉长的形状。此外,进入毛细胞区的迁移增加,在卡那霉素治疗后,MSC的形态转变为各种形式。最后,这项研究的结果表明,MSC与人工增生上皮的共生将有助于通过细胞移植和细胞再生研究,可以检查各种条件和因素的治疗发展。
Introduction
听力损失可能是先天发生的,也可以是由几个因素逐渐引起的,包括衰老、药物和噪音。听力损失往往很难治疗,因为一旦负责听力的毛细胞受损,恢复受损的功能是非常具有挑战性的。据世界卫生组织统计,全世界估计有4.61亿人听力损失,占世界人口的6.1%。在听力损失者中,93%是成年人,7%是儿童。
已尝试采取若干方法治疗听力损失:值得注意的是,使用MSC的再生方法已成为一种很有前途的治疗方法。当组织受损时,MSC自然释放到循环系统中,并迁移到损伤部位,在那里它们分泌各种分子,形成促进再生的微环境2。因此,重要的是要开发一种方法,通过外部植入的MSC迁移来治疗受损组织的目标器官及其随后的分子分泌,导致强大的免疫调节,血管生成和抗凋亡,以加强恢复受损细胞功能3,4,5。
MSC 迁移到受损组织的回程过程可能是最重要的障碍。MSC 具有系统性定位机制,具有连续的系绳/滚动、激活、逮捕、迁移/迁移和迁移6、7、8等步骤。目前,正在努力确定改进这些步骤的方法。各种策略,包括基因改造,细胞表面工程,体外启动,磁导,已经测试了6,7。此外,还多次试图通过将MSC吊到受损的科克菌部位来促进听觉毛细胞的保护和再生。然而,在体内跟踪MSC是耗时和劳动密集型的,需要高度专业化的技能9。
为了解决这个问题,开发了一种方法,通过延时共焦显微镜观察耳蜗中MSC的生长情况,该显微镜可拍摄细胞在几个小时内的迁移(图1)。它开发于20世纪初 ,最近已成为研究特定细胞迁移的有力工具。
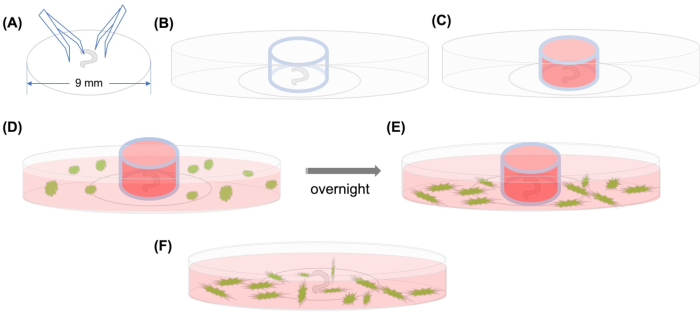
图1:图形摘要。 (A) Corti 的解剖器官使用钳子粘附在塑料盖片上后,盖片被放置在 35 毫米玻璃底的圆角微碟上,并且(B) 玻璃缸被定位。(C) 在玻璃缸内填充中等物后,在气缸外小心添加带有中型的 GFP 标签的 MSC。(E) 在一夜之间孵化后,(F) 玻璃缸被移除,图像用共聚焦显微镜拍摄。缩写:GFP = 绿色荧光蛋白;MSC=中性干细胞。请单击此处查看此图的较大版本。
Protocol
Representative Results
Discussion
对MSC移植到受损部位,促进受损细胞再生进行了广泛的研究,治疗效果明显。据报道,MSC的移植和随后的分化,以恢复大鼠的听力损失引起的3硝基丙酸13。虽然李等人将MSC应用于人类,但他们在听力14方面并没有取得任何显著改善。直到最近,通过MSC移植,还进行了近12项实验,以恢复啮齿动物模型的听力。虽然由于异质性,结果有些不清楚,但有迹象表明,MSC…
Disclosures
The authors have nothing to disclose.
Acknowledgements
这项工作得到了韩国国家研究基金会(NRF-2018-R1D1A1B07050175,HURF-2017-66)和韩国国家研究基金会(NRF)和哈莱姆大学研究基金的研究赠款的支持。
Materials
| 10X PBS Buffer | GenDEPOT | P2100-104 | |
| 4% Formalin | T&I | BPP-9004 | |
| Ampicillin | sigma | A5354-10ml | |
| BSA | sigma | A4503-100G | |
| confocal dish | SPL | 200350 | |
| confocal microscope | ZEISS | LSM800 | |
| coverslip | SPL | 20009 | |
| DMEM/F12 | Gibco | 10565-018 | |
| Fetal Bovine Serum | Thermo Fisher scientific | 16140071 | |
| Fluorsheild with DAPI | sigma | F6057 | |
| Forcep | Dumont | 0508-L5-P0 | |
| HBSS | Thermo Fisher scientific | 14065056 | |
| HEPES | Thermo Fisher scientific | 15630080 | |
| N2 supplement | Gibco | 17502-048 | |
| Phalloidin-iFluor 647 Reagent | abcam | ab176759 | |
| Stage Top Incubator | TOKAI HIT | WELSX | |
| Strain C57BL/6 mouse messenchymal stem cells with GFP | cyagen | MUBMX-01101 | |
| Triton X-100 | sigma | T8787 |
References
- Brown, C. S., Emmett, S. D., Robler, S. K., Tucci, D. L. Global hearing loss prevention. Otolaryngologic Clinics of North America. 51 (3), 575-592 (2018).
- Chamberlain, G., Fox, J., Ashton, B., Middleton, J. Concise review: mesenchymal stem cells: their phenotype, differentiation capacity, immunological features, and potential for homing. Stem Cells. 25 (11), 2739-2749 (2007).
- Fu, X., et al. Mesenchymal stem cell migration and tissue repair. Cells. 8 (8), (2019).
- Uder, C., Brückner, S., Winkler, S., Tautenhahn, H. M., Christ, B. Mammalian MSC from selected species: Features and applications. Cytometry A. 93 (1), 32-49 (2018).
- Rojewski, M. T., et al. Translation of a standardized manufacturing protocol for mesenchymal stromal cells: A systematic comparison of validation and manufacturing data. Cytotherapy. 21 (4), 468-482 (2019).
- Ullah, M., Liu, D. D., Thakor, A. S. Mesenchymal stromal cell homing: Mechanisms and strategies for improvement. iScience. 15, 421-438 (2019).
- Ahn, Y. J., et al. Strategies to enhance efficacy of SPION-labeled stem cell homing by magnetic attraction: a systemic review with meta-analysis. International Journal of Nanomedicine. 14, 4849-4866 (2019).
- Alon, R., Ley, K. Cells on the run: shear-regulated integrin activation in leukocyte rolling and arrest on endothelial cells. Current Opinion in Cell Biology. 20 (5), 525-532 (2008).
- Sykova, E., Jendelova, P. In vivo tracking of stem cells in brain and spinal cord injury. Progress in Brain Research. 161, 367-383 (2007).
- Landegger, L. D., Dilwali, S., Stankovic, K. M. Neonatal murine cochlear explant technique as an in vitro screening tool in hearing research. Journal of Visualized Experiments. (124), e55704 (2017).
- Pijuan, J., et al. In vitro cell migration, invasion, and adhesion assays: From cell imaging to data analysis. Frontiers in Cell and Developmental Biology. 7, 107 (2019).
- Rask-Andersen, H., et al. Human cochlea: anatomical characteristics and their relevance for cochlear implantation. The Anatomical Record. 295 (11), 1791-1811 (2012).
- Kamiya, K., et al. Mesenchymal stem cell transplantation accelerates hearing recovery through the repair of injured cochlear fibrocytes. The American Journal of Pathology. 171 (1), 214-226 (2007).
- Lee, H. S., Kim, W. J., Gong, J. S., Park, K. H. Clinical safety and efficacy of autologous bone marrow-derived mesenchymal stem cell transplantation in sensorineural hearing loss patients. Journal of Audiology and Otology. 22 (2), 105-109 (2018).
- Vanden Berg-Foels, W. S. In situ tissue regeneration: chemoattractants for endogenous stem cell recruitment. Tissue Engineering Part B: Reviews. 20 (1), 28-39 (2014).
- Parker, M., Brugeaud, A., Edge, A. S. Primary culture and plasmid electroporation of the murine organ of Corti. Journal of Visualized Experiments. (36), e1685 (2010).
- Ogier, J. M., Burt, R. A., Drury, H. R., Lim, R., Nayagam, B. A. Organotypic culture of neonatal murine inner ear explants. Frontiers in Cellular Neuroscience. 13, 170 (2019).
- Oshima, K., et al. Mechanosensitive hair cell-like cells from embryonic and induced pluripotent stem cells. Cell. 141 (4), 704-716 (2010).

