Extracción, purificación y perfilado de gangliósidos
Summary
Los gangliósidos son glicoesfingolípidos portadores de ácido siálico que son particularmente abundantes en el cerebro. Su naturaleza anfipática requiere técnicas de extracción y purificación orgánicas / acuosas para garantizar una recuperación óptima y análisis precisos. Este artículo proporciona información general sobre la extracción de gangliósidos a escala analítica y preparativa, la purificación y el análisis de cromatografía de capa delgada.
Abstract
Los gangliósidos son glicoesfingolípidos que contienen uno o más residuos de ácido siálico. Se encuentran en todas las células y tejidos de vertebrados, pero son especialmente abundantes en el cerebro. Expresados principalmente en la valva externa de las membranas plasmáticas de las células, modulan las actividades de las proteínas de la superficie celular a través de la asociación lateral, actúan como receptores en las interacciones célula-célula y son objetivos para patógenos y toxinas. La desregulación genética de la biosíntesis de gangliósidos en humanos da como resultado trastornos congénitos graves del sistema nervioso. Debido a su naturaleza anfipática, la extracción, purificación y análisis de gangliósidos requieren técnicas que han sido optimizadas por muchos investigadores en los 80 años transcurridos desde su descubrimiento. Aquí, describimos métodos a nivel de banco para la extracción, purificación y análisis cualitativos y cuantitativos preliminares de los principales gangliósidos de tejidos y células que se pueden completar en unas pocas horas. También describimos métodos para el aislamiento y purificación a mayor escala de las principales especies de gangliósidos del cerebro. Juntos, estos métodos proporcionan acceso a escala analítica y preparativa a esta clase de moléculas bioactivas.
Introduction
Los gangliósidos se definen como glicoesfingolípidos que contienen uno o más residuos de ácido siálico1. Se expresan principalmente en la superficie celular con su fracción lipídica de ceramida hidrofóbica incrustada en la valva externa de la membrana plasmática y sus glicanos hidrófilos que se extienden hacia el espacio extracelular2. Aunque se distribuyen ampliamente en las células y tejidos de los vertebrados, son particularmente abundantes en el cerebro de los vertebrados3, donde fueron descubiertos y nombrados por primera vez4.
Las estructuras de los glicanos gangliósidos varían y son la base de su nomenclatura (Figura 1). Los glicanos gangliósidos se componen de un núcleo de azúcar neutro que contiene diferentes números y distribuciones de ácidos siálicos. El gangliósido más pequeño, GM4, tiene sólo dos azúcares (ácido siálico unido a la galactosa)5. Los gangliósidos naturales más grandes pueden contener más de una docena de azúcares totales6 o hasta siete ácidos siálicos en un solo núcleo neutro7. Sus fracciones lipídicas de ceramida también varían, teniendo diferentes longitudes de esfingosina y una variedad de amidas de ácidos grasos. En el cerebro de los vertebrados predominan cuatro especies de gangliósidos, GM1, GD1a, GD1b y GT1b. La expresión gangliósida está regulada por el desarrollo, específica del tejido y específica del tipo de célula.
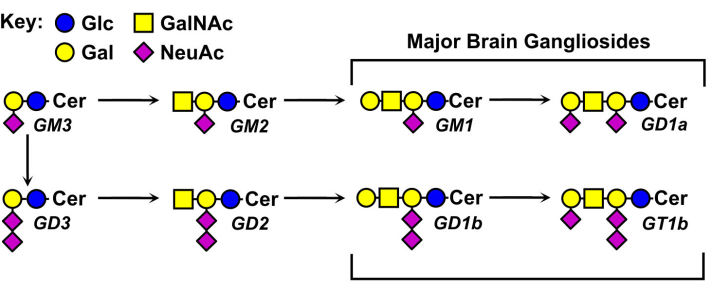
Figura 1: Principales gangliósidos cerebrales y sus precursores biosintéticos. Las estructuras se muestran utilizando la nomenclatura de símbolos para glicanos11. Haga clic aquí para ver una versión más grande de esta figura.
Los gangliósidos funcionan a nivel molecular al involucrar y modular proteínas en sus propias membranas (regulación cis) o al involucrar proteínas de unión a glicanos en el medio extracelular, incluidas las toxinas bacterianas y las lectinas en otras células (reconocimiento trans)3. La unión específica de gangliósidos a proteínas reguladoras y/o la autoasociación con otras moléculas en balsas lipídicas da como resultado cambios en el comportamiento celular que afectan la estructura y función del sistema nervioso, la progresión del cáncer, el metabolismo, la inflamación, las proteinopatías neuronales y las enfermedades infecciosas8. Debido a sus diversas funciones celulares, los métodos para su aislamiento y análisis pueden proporcionar una mayor comprensión de la regulación de los procesos fisiológicos y patológicos. Aquí, se proporcionan métodos validados para la extracción y el análisis rápidos a pequeña escala, y el aislamiento a escala preparativa de gangliósidos del cerebro. Se discuten las oportunidades y desafíos para la aplicación a otros tejidos.
Protocol
Representative Results
Discussion
Los métodos para la extracción y el aislamiento de gangliósidos a pequeña y gran escala reportados aquí no son únicos: existen muchos enfoques diferentes de extracción y purificación con solventes que proporcionan excelentes resultados12. Los métodos reportados aquí para la purificación a pequeña escala del cerebro, de Fredman y Svennerholm13, demostraron optimizar la recuperación y han demostrado ser robustos y sencillos durante muchos años en nuestro laborat…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Este trabajo fue apoyado por la subvención U01CA241953 del Fondo Común para la Glicociencia de los Institutos Nacionales de Salud (NIH). MJP fue apoyado por el Programa de Interfaz Química-Biología en Johns Hopkins (T32GM080189).
Materials
| Bovine brain, stripped | PelFreez | 57105-1 | |
| Ganglioside standards | Matreya | GM1, 1061; GD1a, 1062; GD1b, 1501; GT1b, 1063 | |
| Glass bottle with PTFE-lined cap | Fisher Scientific | 02-911-739 | |
| Glass centrifuge bottle | Fisher Scientific | 05-586B | |
| Glass culture tubes, 16 x 125 mm | VWR | 60825-430 | for collecting HPLC fractions |
| Glass separatory funnel (2 L) | Pyrex | 6400-2L | |
| Injection syringe – Hamilton 1750 gastight 500 µl | Hamilton | 81265 | |
| p-Anisaldehyde, 98% | Sigma-Aldrich | A88107 | |
| Potter-Elvhjem Homogenizer | Fisher Scientific | 08-414-14A | Choose appropriate volume option |
| Reprosil 100 NH2 10µm 5x4mm guard columns | Analytics-Shop | AAVRS1N-100540-5 | |
| Reprospher 100 NH2, 5 μm, 250 mm x 20 mm HPLC column | Analytics-Shop | custom packed | other sizes available |
| Resorcinol | Sigma-Aldrich | 30752-1 | |
| Rotary evaporator | Buchi | R-300 | |
| Sample loop for Model 7725 Injector (5 ml) | Sigma-Aldrich | 57632 | |
| Sep-Pak tC18 Cartidges Vac 35 cc (10 g) | Waters | WAT043350 | |
| Sep-Pak tC18 Plus Short Cartridge, 400 mg | Waters | WAT036810 | |
| Spotting syringe – Hamilton 701N 10 µl | Hamilton | 80300 | |
| Thick-walled 13-mm diameter test tubes with PFTE lined caps | Fisher Scientific | 14-933A | |
| Threaded 2-ml vials with PFTE lined caps | Fisher Scientific | 14-955-323 | For ganglioside storage |
| TLC plates, HPTLC Silica gel 60 F254 Multiformat | Fisher Scientific | M1056350001 | Fluorescence impregnation (F254) stabilizes the sorbent surface |
| TLC reagent sprayer | Fisher Scientific | 05-723-26A | |
| TLC running chamber for 10 x 10 cm plates | Camag | 22.5155 | |
| Waring 1-Liter Stainless Steal Explosion Resistant Blender | Waring | E8520 |
References
- Schnaar, R. L. The Biology of Gangliosides. Advances in Carbohydrate Chemistry and Biochemistry. 76, 113-148 (2019).
- DeMarco, M. L., Woods, R. J. Atomic-resolution conformational analysis of the GM3 ganglioside in a lipid bilayer and its implications for ganglioside-protein recognition at membrane surfaces. Glycobiology. 19 (4), 344-355 (2009).
- Schnaar, R. L. Gangliosides of the vertebrate nervous system. Journal of Molecular Biology. 428, 3325-3336 (2016).
- Klenk, E. Über die Ganglioside, eine neue Gruppe von zuckerhaltigen Gehirnlipoiden [About gangliosides, a new group of sugar-containing brain lipids]. Hoppe-Seyler’s Zeitschrift für Physiologische Chemie. 273, 76-86 (1942).
- Uemura, S., Go, S., Shishido, F., Inokuchi, J. Expression machinery of GM4: the excess amounts of GM3/GM4S synthase (ST3GAL5) are necessary for GM4 synthesis in mammalian cells. Glycoconjugate Journal. 31 (2), 101-108 (2014).
- Nimrichter, L., et al. E-selectin receptors on human leukocytes. Blood. 112 (9), 3744-3752 (2008).
- Saito, M., Kitamura, H., Sugiyama, K. A novel heptasialosyl c-series ganglioside in embryonic chicken brain: its structure and stage-specific expression. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 1571 (1), 18-26 (2002).
- Todeschini, A. R., Hakomori, S. I. Functional role of glycosphingolipids and gangliosides in control of cell adhesion, motility, and growth, through glycosynaptic microdomains. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 1780 (3), 421-433 (2008).
- Sturgill, E. R., et al. Biosynthesis of the major brain gangliosides GD1a and GT1b. Glycobiology. 22, 1289-1301 (2012).
- Cavdarli, S., Delannoy, P., Groux-Degroote, S. O-Acetylated gangliosides as targets for cancer immunotherapy. Cells. 9 (3), (2020).
- Varki, A., et al. Symbol nomenclature for graphical representations of glycans. Glycobiology. 25 (12), 1323-1324 (2015).
- Schnaar, R. L. Isolation of glycosphingolipids. Methods in Enzymology. 230, 348-370 (1994).
- Svennerholm, L., Fredman, P. A procedure for the quantitative isolation of brain gangliosides. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 617, 97-109 (1980).
- Tettamanti, G., Bonali, F., Marchesini, S., Zambotti, V. A new procedure for the extraction, purification and fractionation of brain gangliosides. Biochimica et Biophysica Acta (BBA) – Bioenergetics. 296, 160-170 (1973).
- Gazzotti, G., Sonnino, S., Ghidoni, R. Normal-phase high-performance liquid chromatographic separation of non-derivatized ganglioside mixtures. Journal of Chromatography. 348, 371-378 (1985).
- Schnaar, R. L., Needham, L. K. Thin-layer chromatography of glycosphingolipids. Methods in Enzymology. 230, 371-389 (1994).
- Ledeen, R. W., Yu, R. K. Gangliosides: structure, isolation, and analysis. Methods in Enzymology. 83, 139-191 (1982).
- Lopez, P. H., et al. Mice lacking sialyltransferase ST3Gal-II develop late-onset obesity and insulin resistance. Glycobiology. 27 (2), 129-139 (2017).

