Ядерная миграция в ооците дрозофилы
Summary
При дрозофилеядро ооцита подвергается микротрубочезависимой миграции во время оогенеза. Здесь мы описываем протокол, который был разработан для отслеживания миграции путем выполнения живой визуализации на камерах яиц ex-vivo. Наша процедура поддерживает яйцеклетки живыми в течение 12 часов для получения многопозиционных 3D-покадровых фильмов с использованием конфокальной микроскопии с вращающимся диском.
Abstract
Визуализация живых клеток особенно необходима для понимания клеточных и молекулярных механизмов, которые регулируют движения органелл, перестройки цитоскелетов или паттерны полярности внутри клеток. При изучении позиционирования ядра ооцита методы визуализации в реальном времени необходимы для захвата динамических событий этого процесса. Яичная камера дрозофилы представляет собой многоклеточную структуру и отличную модельную систему для изучения этого явления из-за ее большого размера и наличия многочисленных генетических инструментов. Во время среднего оогенеза дрозофилы ядро мигрирует из центрального положения в ооците, чтобы принять асимметричное положение, опосредованное силами, генерируемыми микротрубочами. Такая миграция и позиционирование ядра необходимы для определения осей полярности эмбриона и последующей взрослой мухи. Одной из характеристик этой миграции является то, что она происходит в трех измерениях (3D), создавая необходимость для живой визуализации. Таким образом, для изучения механизмов, регулирующих ядерную миграцию, мы разработали протокол культивирования расчлененных яйцеклеток и выполнения живой визуализации в течение 12 ч путем покадровых приобретений с использованием конфокальной микроскопии со спиннинговым диском. В целом, наши условия позволяют нам сохранять яйцеклетки дрозофилы живыми в течение длительного периода времени, тем самым позволяя визуализировать завершение ядерной миграции в большом количестве образцов в 3D.
Introduction
В течение нескольких лет ооцит дрозофилы появился в качестве модельной системы для изучения ядерной миграции. Ооцит дрозофилы развивается в многоклеточной структуре, называемой камерой яйцеклетки. Яйцеклетки охватывают 16 половых клеток (15 клеток-кормилиц и яйцеклетку), окруженных эпителиальным слоем фолликулярных соматических клеток. Развитие яичной камеры было подразделено на 14 стадий(рисунок 1А),в ходе которых яйцеклетка будет расти и накапливать запасы, необходимые для раннего развития эмбриона. При развитии, при реорганизации микротрубочек и асимметричном переносе материнских детерминант, ооцит поляризуется по антеродорсальной и дорсо-вентральной осям. Эти оси определяют последующие оси полярности эмбриона и взрослого человека, возникающие в результате оплодотворения этой яйцеклетки1. Во время оогенеза ядро принимает асимметричное положение в ооците. На стадии 6 ядро центрируется в клетке. После еще не идентифицированного сигнала, излучаемого задними фолликулярными клетками, который принимается яйцеклеткой, ядро мигрирует к пересечению передней и боковой плазматических мембран на стадии 7(Рисунок 1B)2,3. Это асимметричное положение требуется для того, чтобы вызвать определение дорсо-вентральной оси.
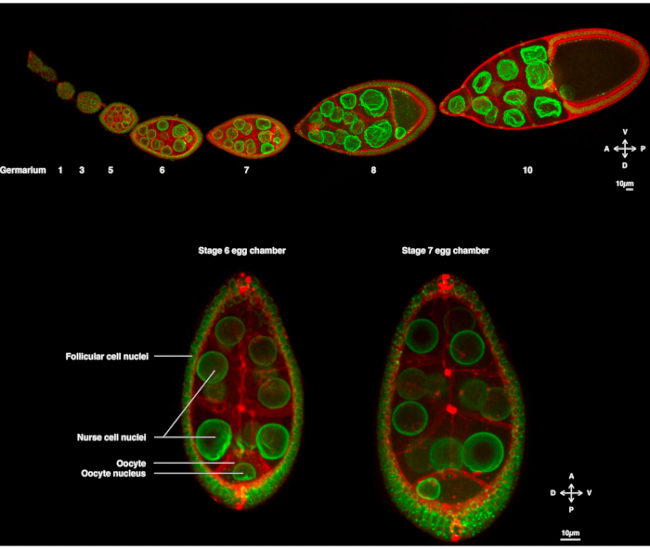
Рисунок 1:Камеры яиц Drosophila melanogaster. ( A )Фиксированныйовариол от трансгенных мух, экспрессивляющих Fs(2)Ket-GFP, который маркирует ядерные оболочки и ubi-PH-RFP, который маркирует плазматические мембраны. Овариол состоит из развивающихся яйцеклеток на разных стадиях. Созревание увеличивается вдоль передне-задней оси с гермарием на переднем кончике (слева), где находится зародышевая стволовая клетка, и более старой стадией на заднем кончике (справа). (B)Z-проекция живой яйцеклетки методом вращающейся дисковой конфокальной микроскопии на 6 стадии оогенеза (слева), при которой ядро центрируется в ооците. Ядро будет мигрировать, чтобы принять асимметричное положение на стадии 7 (справа) в контакте с передней плазматической мембраной (между яйцеклеткой и клеткой медсестры) и боковой плазматической мембраной (между яйцеклеткой и фолликулярными клетками). Это положение будет стимулировать определение дорсальной стороны и, таким образом, дорсо-вентральной оси яйцеклеточной камеры. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
В течение многих десятилетий эта ядерная миграция изучалась на фиксированных тканях путем иммуноокрашивания. Такой подход позволил, в частности, продемонстрировать, что этот процесс зависит от плотной сети микротрубочек4,5. Совсем недавно мы разработали протокол, предлагающий условия, совместимые с живой визуализацией ооцита в течение нескольких часов, что позволяет динамически изучать этот процесс6.
Следовательно, впервые мы смогли описать, что ядро имеет предпочтительные и характерные траектории во время своей миграции, одну вдоль передней плазматической мембраны (APM), а другую вдоль боковой плазматической мембраны (LPM) ооцита(Рисунок 2). Эти последние результаты подчеркивают важность протоколов визуализации в реальном времени при изучении динамических процессов, таких как ядерная миграция.
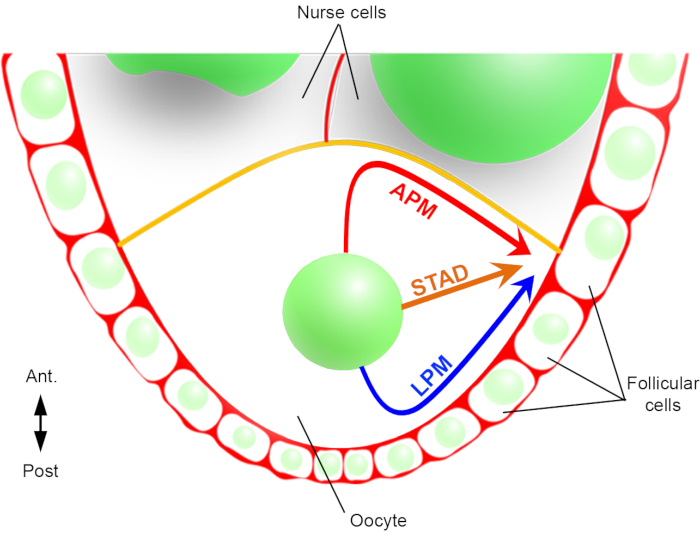
Рисунок 2:Схематическое представление различных путей миграции ядра. На 6 стадии оогенеза яйцеклетка представляет собой крупную клетку с центральным ядром. На этом этапе передне-задняя ось полярности устанавливается с задней/латеральной плазматической мембраной ооцита, контактиим с фолликулярными клетками, а передняя плазматическая мембрана (желтого цвета) контактирует с клетками медсестры2. Ранее мы сообщали, что ядро может мигрировать либо вдоль передней плазматической мембраны (APM), вдоль боковой плазматической мембраны (LPM), либо через цитоплазму (STAD, прямо в антеродоральную кору)6. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Миграция ядра ооцитов представляет собой явление около 3 ч6,и до сих пор событие, вызывающее начало фактической миграции, неизвестно. Начало миграции также может быть отложено белковыми мутантами, используемыми для изучения этого механизма. Эти неизвестные переменные мотивировали нас получать изображения в течение длительных периодов времени (10-12 ч). Поэтому важно обеспечить, чтобы ооциты оставались живыми. По мере развития яичной камеры она удлиняется вдоль антеро-задней оси от сферической до эллиптической формы. Это удлинение обусловлено вращением фолликулярных клеток, которое происходит от стадии 1 до стадии 8, перпендикулярной антеро-задней оси7. Кроме того, трубчатая оболочка мышц с пульсирующим свойством окружает яйцеклетки камеры. Его физиологическая функция заключается в том, чтобы подталкивать развивающиеся фолликулы к яйцеводу непрерывно8. Чтобы ограничить движения, которые вызывают колебания яичных камер после их рассечения, мы разработали наблюдательную микрокамеру высотой 150 мкм(рисунок 3А). Эта высота незначительно превышает размер фолликула на стадиях 10 и 11. Это значительно ограничивает вертикальные движения образца, сохраняя при этом вращение яйцеклеточной камеры, что приводит к ограниченным дефектам в развитии фолликулов. Затем мы выполняем живую визуализацию в течение 12 часов на расчлененных яйцеклетках с помощью многопозиционных покадровых захватов с использованием конфокального микроскопа со вращающимся диском. Здесь мы описываем наш протокол изучения миграции ядер ооцитов между стадиями 6 и 7.
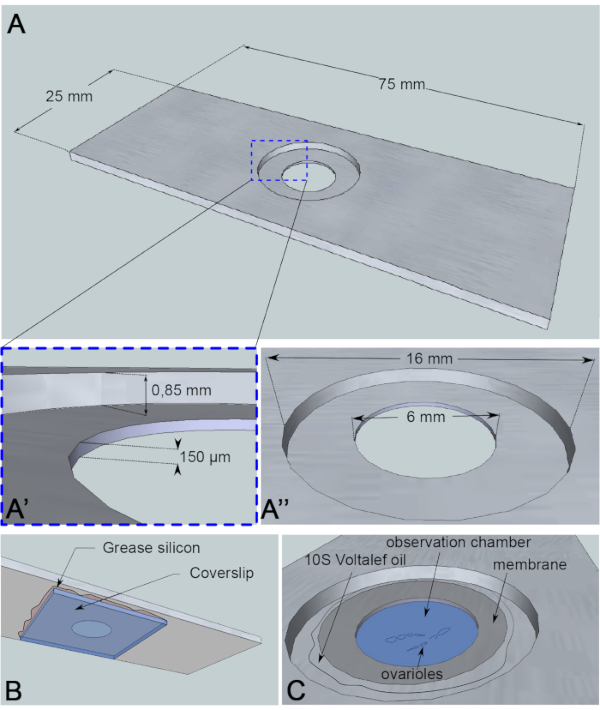
Рисунок 3:Схематическое изображение камеры наблюдения. (A) (Вид сверху) Точные размеры алюминиевой горки с высотой (A’) и окружностью (A”) скважины, пробуренной в середине слайда. (B) (Вид снизу) Крышка, блокирующая скважину, герметизирована к слайду силиконовой смазкой. (C)(Вид сверху) Рассеченные яриоли развиваются в среде визуализации, которая покрыта газопроницаемой мембраной. Галогенуглеродное масло используется для стабилизации мембраны. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Чтобы проследить за ядерной миграцией и точно оценить траектории в ооците, необходимы маркеры как для ядерной оболочки, так и для плазматической мембраны. С этой целью были выбраны два трансгена, которые имеют высокое соотношение сигнал/шум и не исчезают в ходе живой визуализации. Для маркировки плазматической мембраны рекомендуется использовать P[ubi-PH-RFP], который кодирует домен гомологии Плекстрина (PH) фосфолипазы человека C ∂1 (PLC∂1), слитой с RFP. Этот домен PH связывается с фосфоинозитидом PI(4,5)P2, распределенным вдоль плазматической мембраны ооцита9. Для ядерной оболочки штамм P[PPT-un1]Fs(2)Ket-GFP, где GFP вставлен в ген, кодирующий Drosophila ß-importin, отображает однородный и интенсивный сигнал10. Молодых мух (1-2 дня) помещают в свежие флаконы, содержащие сухие дрожжи, за 24-48 ч до рассечения яичники.
Для этого анализа в реальном времени кусок алюминия толщиной 1 мм, который не является реактивным для образца, был разрезан на размеры слайда микроскопии. Он имеет отверстие диаметром 16 мм в центре затвора, которое было уравнёно до 0,85 мм. Этот контрбор имеет дополнительное отверстие диаметром 6 мм глубиной 150 мкм(рисунок 3А). Крышка наклеивается силиконовой смазкой (инертной для образца) на дно алюминиевой камеры(рисунок 3B). После помещения образцов в заполненную средой скважину над средой помещают мембрану, проницаемую для обменаO2/CO2 и окружают галогенуглеродным маслом(рис. 3С).
Для рассечения рекомендуется использовать щипцы из нержавеющей стали с размером наконечника 0,05 х 0,02 мм и иглы диаметром 0,20 мм для разделения яриолов(рис. 4В,С). Мигрирующие ядра визуалируются на вращающийся диск конфокального инвертированного микроскопа CSU-X1, оснащенного камерой. Многопозиционные изображения были получены с помощью покадровой съемки каждые 15 минут при 24 °C. Интервал в 15 минут позволяет выполнять многопозиционные захваты с ограниченным фотоотбеливанием флуоресцентных белков и фототоксичностью для образцов. Кроме того, более короткий интервал не даст гораздо более информативных данных для отслеживания ядерных траекторий. Фильмы обрабатываются и анализируются с помощью программного обеспечения Fiji11.
Protocol
Representative Results
Discussion
Другие протоколы описывают, как подготовить и культивировать камеры яиц дрозофилы ex vivo для анализа живой визуализации12,13. Новизна этого протокола заключается в использовании камеры визуализации, построенной с использованием полого алюминиевого с?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Мы чрезвычайно благодарны Жану-Антуану Лепесанту и Николя Тиссо, которые первоначально разработали протокол и поделились с нами некоторыми графическими элементами рисунка 3. Мы благодарим Фанни Роланд-Госселин, которая сделала фотографии рисунка 4. Мы также благодарим других членов лаборатории за полезные обсуждения, которые способствовали улучшению этой техники, и Натаниэля Хеннемана за его комментарии, которые помогли улучшить эту рукопись. Мы выражаем признательность за базовую установку ImagoSeine Института Жака Моно, члена France-BioImaging (ANR-10-INBS-04). Маэли Ло поддерживается стипендией PhD от Министерства исследований Франции (MESRI). Антуан Гише и Фред Бернар были поддержаны ARC (Grant PJA20181208148), Ассоциацией предприятий против рака (Grant Gefluc 2020 #221366) и грантом Emergence от IdEx Université de Paris (ANR-18-IDEX-0001).
Materials
| Anesthetize CO2 pad | Dutscher | 789060 | Anesthetize flies |
| Coverslip (24×50 mm) | Knittel Glass | VD12450Y100A | Observation-chamber preparation |
| Forceps Dumont #5 | Carl Roth | K342.1 | Dissection |
| Stainless steel needles | Entosphinx | 20 | Dissection |
| Heat-inactivated fetal calf serum | SIGMA-ALDRICH | F7524 | Imaging medium |
| Insulin solution bovine pancreas | SIGMA-ALDRICH | 10516 – 5ml | Imaging medium |
| Penicilin/Streptomycin solution | SIGMA-ALDRICH | P0781 | Imaging medium |
| Permeable membrane | Leica | 11521746 | Observation-chamber preparation |
| Schneider Medium | Pan Biotech | P04-91500 | Imaging medium |
| Silicon grease | BECKMAN COULTER | 335148 | Observation-chamber preparation |
| Spinning disk confocal | Zeiss | CSU-X1 | Nuclear migration observation |
| Voltalef oil 10S | VWR | 24627 – 188 | Observation-chamber preparation |
References
- Merkle, J. A., Wittes, J., Schüpbach, T. Signaling between somatic follicle cells and the germline patterns the egg and embryo of Drosophila. Current Topics in Developmental Biology. 140, 55-86 (2020).
- Roth, S., Lynch, J. A. Symmetry breaking during drosophila oogenesis. Cold Spring Harbor Perspectives in Biology. 1 (2), 001891 (2009).
- Bernard, F., Lepesant, J. -. A., Guichet, A. Nucleus positioning within Drosophila egg chamber. Seminars in Cell and Developmental Biology. 82, 25-33 (2017).
- Koch, E. A., Spitzer, R. H. Multiple effects of colchicine on oogenesis in Drosophila: Induced sterility and switch of potential oocyte to nurse-cell developmental pathway. Cell and Tissue Research. 228 (1), 21-32 (1983).
- Januschke, J., et al. The centrosome-nucleus complex and microtubule organization in the Drosophila oocyte. Development. 133, 129-139 (2006).
- Tissot, N., et al. Distinct molecular cues ensure a robust microtubule-dependent nuclear positioning in the Drosophila oocyte. Nature Communications. 8, 15168 (2017).
- Cetera, M., Horne-Badovinac, S. Round and round gets you somewhere: collective cell migration and planar polarity in elongating Drosophila egg chambers. Current Opinion in Genetics & Development. 32, 10-15 (2015).
- Hudson, A. M., Petrella, L. N., Tanaka, A. J., Cooley, L. Mononuclear muscle cells in Drosophila ovaries revealed by GFP protein traps. Developmental Biology. 314, 329-340 (2008).
- Gervais, L., Claret, S., Januschke, J., Roth, S., Guichet, A. PIP5K-dependent production of PIP2 sustains microtubule organization to establish polarized transport in the Drosophila oocyte. Development. 135 (23), 3829-3838 (2008).
- Villányi, Z., Debec, A., Timinszky, G., Tirián, L., Szabad, J. Long persistence of importin- b explains extended survival of cells and zygotes that lack the encoding gene ‘ n Villa. Mechanisms of Development. 3-4 (125), 196-206 (2008).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Prasad, M., Jang, A. C. C., Starz-Gaiano, M., Melani, M., Montell, D. J. A protocol for culturing drosophila melanogaster stage 9 egg chambers for live imaging. Nature Protocols. 2 (10), 2467-2473 (2007).
- Weil, T. T., Parton, R. M., Davis, I. Preparing individual Drosophila egg chambers for live imaging. Journal of Visualized Experiments: JoVE. (60), (2012).
- Chanet, S., Huynh, J. R. Collective cell sorting requires contractile cortical waves in germline cells. Current Biology. 30 (21), 4213-4226 (2020).
- Zhao, T., Graham, O. S., Raposo, A., St Johnston, D. Growing microtubules push the oocyte nucleus to polarize the drosophila dorsal-ventral axis. Science. 336 (6084), 999-1003 (2012).
- Legent, K., Tissot, N., Guichet, A. Chapter 7 Oogenesis using fixed and live imaging. Drosophila Oogenesis: Methods and Protocols. 1328, 99-112 (2015).

