Et tarminskorgelkultursystem til analyse af værtsmikrobiotainteraktioner
Summary
Denne artikel præsenterer en unik metode til analyse af værtsmikrobie interaktioner ved hjælp af et nyt tarmorgankultursystem til ex vivo-eksperimenter.
Abstract
Tarmvævets struktur letter tætte og gensidige interaktioner mellem værten og tarmmikrobiotaen. Disse krydssamtaler er afgørende for at opretholde lokale og systemiske homøostase; ændringer i tarmmikrobiotasammensætningen (dysbiose), der er associeret med en lang række sygdomme hos mennesker. Metoder til dissekering af værtsmikrobiotainteraktioner omfatter en iboende afvejning blandt bevarelsen af fysiologisk vævsstruktur (ved anvendelse af in vivo-dyremodeller) og graden af kontrol over eksperimentfaktorerne (som i enkle in vitro-cellekultursystemer). For at løse dette kompromis udviklede Yissachar et al. for nylig et tarmorgankultursystem. Systemet bevarer en naiv tyktarmsvæv konstruktion og cellulære mekanismer, og det giver også mulighed for stram eksperimentel kontrol, lette eksperimenter, der ikke umiddelbart kan udføres in vivo. Det er optimalt til afhandling af kortsigtede reaktioner fra forskellige tarmkomponenter (såsom epitel-, immunologiske og neuronale elementer) til luminale rensninger (herunder anaerob eller aerob mikrober, hele mikrobiotaprøver fra mus eller mennesker, stoffer og metabolitter). Her præsenterer vi en detaljeret beskrivelse af en optimeret protokol for orgelkultur af flere tarmfragmenter ved hjælp af en skræddersyet tarmkulturenhed. Værtsresponser på luminale foranstaltninger kan visualiseres ved immunfluorescensfarvning af vævssektioner eller hele monteringsvævsfragmenter, fluorescens in-situ hybridisering (FISH) eller time-lapse-billeddannelse. Dette system understøtter en bred vifte af udlæsninger, herunder næste generations sekventering, flowcytometry og forskellige cellulære og biokemiske assays. Samlet set understøtter dette tredimensionelle organkultursystem kulturen i store, intakte tarmvæv og har brede applikationer til analyse og visualisering af værtsmikrobiotainteraktioner i det lokale tarmmiljø.
Introduction
Tarmen er et meget komplekst organ, der indeholder en bred vifte af celletyper (epitelceller, immunsystemceller, neuroner og mere) organiseret i en bestemt struktur, der gør det muligt for celler at interagere og kommunikere med hinanden og med det luminale indhold (mikrobiota, mad osv.) 1. I øjeblikket omfatter den forskningsværktøjskasse, der er tilgængelig til analyse af værtsmikrobiotainteraktioner, in vitro-cellekulturer og in vivo-dyremodeller 2. In vivo-dyremodeller giver en fysiologisk vævskonstruktion3, men med dårlig eksperimentel kontrol og begrænset evne til at manipulere forsøgsbetingelserne. In vitro kultursystemer, på den anden side, bruge primære celler eller cellelinjer, der kan suppleres med mikrober4, der tilbyder stram kontrol over eksperimentparametrene, men mangler den cellulære kompleksitet og vævsarkitekturen. Moderne in vitro-assays tillader avanceret anvendelse af sunde og patologiske humane vævsprøver, som epitelorganoider afledt af mus eller menneskelige kilder5, 6og prøver, der efterligner slimhindemikromiljøet7. Et andet eksempel er ‘tarmen på en chip’ assay, som omfatter den menneskelige colon epitelcellelinje (Caco2), ekstracellulær matrix og mikrofluidiske kanaler til at efterligne tarmens invariante fysiologiske tilstand8. Men så avancerede og innovative som in vitro prøver kan være, de ikke opretholde en normal væv arkitektur eller naiv cellulær sammensætning.
For at løse dette har Yissachar et al. for nylig udviklet et ex vivo-organkultursystem 9 ( figur1), der opretholder intakte tarmfragmenter ex vivo, der nyder godt af fordelene ved både in vivo- og in vitro-modeller. Dette ex vivo gut organ kultur system er baseret på en skræddersyet kultur enhed, der understøtter en multiplekseret kultur af seks kolon væv, der gør det muligt at undersøge eksperimentelle input under sammenlignelige forhold, mens kontrollere systemets input og output. Nyere værker har vist , at dette system er værdifuldt til analyse af tarmresponser på individuelle tarmbakterier9, hele humane mikrobiotaprøver10 og mikrobielle metabolitter11. Dette system gør det muligt for første gang at studere disse tidlige værtsmikrobiotainteraktioner med en høj grad af kontrol over værts-, mikrobielle og miljømæssige komponenter. Desuden giver det mulighed for at overvåge og manipulere systemet gennem hele eksperimentet i realtid.
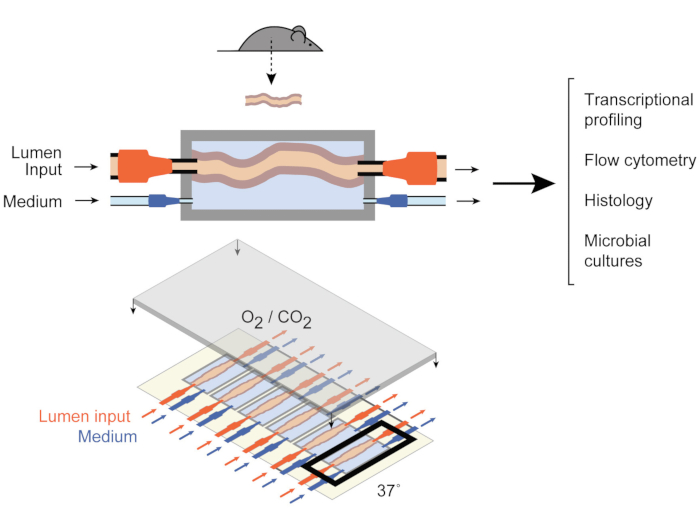
Figur 1: Skemaer over tarmkulturens enhed. Et helt tarmvævsfragment er fastgjort til kammerets udgangs- og indgangsporte (øverst), med pumper, der regulerer mediumstrømmen inde i lumen og i det eksterne mediumkammer. Hele enheden (nederst) indeholder 6 sådanne kamre. Dette tal er blevet ændret fra Yissachar et al. 2017. Klik her for at se en større version af dette tal.
Protocol
Representative Results
Discussion
Denne artikel beskriver en optimeret protokol for ex vivo gut organkulturer, som Yissachar et al. for nylig har udviklet (offentliggjort9 og ikke-offentliggjorte data). Tarmorgankultursystemet understøtter multiplekseret kultur af intakte tarmfragmenter, samtidig med at det opretholder lysgennemstrømningen. Det giver fuld kontrol over intra- og ekstra-luminal miljø (herunder stimulation dosis, eksponering tid og strømningshastighed) og bevarer den naive tarmvæv struktur og dens cellu…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Vi takker tidligere og nuværende medlemmer af Yissachar lab for deres værdifulde bidrag til optimering af tarmorgankultur systemprotokollen. Vi takker Yael Laure for kritisk redigering af manuskriptet. Dette arbejde blev støttet af Israel Science Foundation (tilskud Nr. 3114831), Israel Science Foundation – Broad Institute Joint Program (tilskud Nr. 8165162), og Gassner Fund for Medical Research, Israel.
Materials
| Device | |||
| 18 Gauge Blunt Needle | Mcmaster | 75165a754 | |
| 22 Gauge Blunt Needle | Mcmaster | 75165a758 | |
| All Purpose Adhesive Selant 100% Silicone | DAP | 688 | |
| Cubic Vacuum Desiccator VDC-21+ 2 Shelves | AAAD4021 | ||
| Glass Slide 1 mm Thick | Corning | 2947-75X50 | |
| Mini Incubator im-10 | AAH24315K | ||
| MPC 301E Vacuum PUMP | VI-412711 | ||
| Plastic Quick Turn Tube Coupling Plugs | Mcmaster | 51525k121 | |
| plastic Quick Turn Tube Coupling Sockets | Mcmaster | 52525k211 | |
| Sylgard 184 Silicone Elastomer | Dow | Polydimethylsiloxane, PDMS | |
| Tubing | Mcmaster | 6516t11 | |
| Zortrax M200 | Zortrax | Zortrax Z-SUITE, Autodesk Fusion 360 | |
| Zortrax M200 Materials: z-ultrat | Zortrax | ||
| Medium | |||
| B27 Supplement (50x), Serum Free | Thermo Fisher Scientific | 17504044 | |
| HEPES Buffer (1M) | Thermo Fisher Scientific | 15630056 | |
| Iscove's Mod Dulbecco's Medium With Phenol Red (1x) | Thermo Fisher Scientific | 12440061 | |
| Knock-Out Serum | Thermo Fisher Scientific | 10828028 | |
| N2 Supplement (100x) | Thermo Fisher Scientific | A1370701 | |
| Non Essential Amino Acid (100x) | Thermo Fisher Scientific | 11140035 | |
| Surgical Tools | |||
| Large Scissors | Aseltech | 11-00-10 | |
| Sharp Forceps | F.S.T | 11297-10 | |
| Silk Braided Surgical Thread | SMI | 8010G | |
| Straight Scissors | F.S.T | 14091-09 | |
| Thin Forceps | F.S.T | 11051-10 | |
| Organ System | |||
| 0.1 µm Filter | Life Gene | ||
| 0.22 µm Filter | Life Gene | ||
| 5 mL Luer Lock Syringe | B-D | 309649 | |
| Greenough Stereo Microscope | ZEISS | Stemi 305 | |
| Recirculating Precision Air Heater "CUBE" | CUBE-2-LIS | ||
| Syringe Pump | new era pump systems inc | nep-ne-1600-em |
References
- Mowat, A. M., Agace, W. W. Regional specialization within the intestinal immune system. Nature Reviews Immunology. 14 (10), 667-685 (2014).
- Pearce, S. C., et al. Intestinal in vitro and ex vivo Models to Study Host-Microbiome Interactions and Acute Stressors. Frontiers in Physiology. 9 (1584), (2018).
- Hooper, L. V., et al. Molecular analysis of commensal host-microbial relationships in the intestine. Science. 291 (5505), 881-884 (2001).
- Haller, D., et al. Non-pathogenic bacteria elicit a differential cytokine response by intestinal epithelial cell/leucocyte co-cultures. Gut. 47 (1), 79-87 (2000).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett’s epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Tsilingiri, K., et al. Probiotic and postbiotic activity in health and disease: comparison on a novel polarised ex-vivo organ culture model. Gut. 61 (7), 1007-1015 (2012).
- Gazzaniga, F. S., et al. Harnessing Colon Chip Technology to Identify Commensal Bacteria That Promote Host Tolerance to Infection. Frontiers in Cellular and Infection Microbiology. 11, 638014 (2021).
- Yissachar, N., et al. An Intestinal Organ Culture System Uncovers a Role for the Nervous System in Microbe-Immune Crosstalk. Cell. 168 (6), 1135-1148 (2017).
- Duscha, A., et al. Propionic Acid Shapes the Multiple Sclerosis Disease Course by an Immunomodulatory Mechanism. Cell. 180 (6), 1067-1080 (2020).
- Grosheva, I., et al. High-Throughput Screen Identifies Host and Microbiota Regulators of Intestinal Barrier Function. Gastroenterology. 159 (5), 1807-1823 (2020).
- Blaize, J. F., Corbo, C. P. Serial Dilutions and Plating: Microbial Enumeration. Journal of Visualized Experiments. , (2021).
- Ivanov, I. I., et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell. 139 (3), 485-498 (2009).
- Schnupf, P., et al. Growth and host interaction of mouse segmented filamentous bacteria in vitro. Nature. 520 (7545), 99-103 (2015).
- Chung, H., et al. Gut immune maturation depends on colonization with a host-specific microbiota. Cell. 149 (7), 1578-1593 (2012).
- Atarashi, K., et al. Th17 Cell Induction by Adhesion of Microbes to Intestinal Epithelial Cells. Cell. 163 (2), 367-380 (2015).

