Um sistema de cultura de órgãos intestinais para analisar interações hospedeira-microbiota
Summary
Este artigo apresenta um método único para analisar as interações hospedeiro-microbioma usando um novo sistema de cultura de órgãos intestinais para experimentos ex vivo.
Abstract
A estrutura do tecido intestinal facilita interações próximas e mutualísticas entre o hospedeiro e a microbiota intestinal. Essas conversas cruzadas são cruciais para a manutenção da homeostase local e sistêmica; alterações na composição da microbiota intestinal (disbiose) associam-se a uma ampla gama de doenças humanas. Os métodos de dissecar as interações hospedeira-microbiota englobam uma troca inerente entre a preservação da estrutura tecidual fisiológica (ao usar modelos animais in vivo) e o nível de controle sobre os fatores experimentais (como em sistemas simples de cultura celular in vitro). Para lidar com essa troca, Yissachar et al. desenvolveram recentemente um sistema de cultura de órgãos intestinais. O sistema preserva uma construção ingênua de tecido de cólon e mecanismos celulares e também permite um controle experimental rigoroso, facilitando experimentações que não podem ser prontamente realizadas in vivo. É ideal para dissecar respostas de curto prazo de vários componentes intestinais (como elementos epiteliais, imunológicos e neuronais) a perturbações luminais (incluindo micróbios anaeróbicos ou aeróbicos, amostras inteiras de microbiota de camundongos ou humanos, drogas e metabólitos). Aqui, apresentamos uma descrição detalhada de um protocolo otimizado para a cultura de órgãos de múltiplos fragmentos de intestino usando um dispositivo de cultura intestinal feito sob medida. As respostas do hospedeiro às perturbações luminais podem ser visualizadas pela coloração da imunofluorescência de seções de tecido ou fragmentos de tecido de montagem total, hibridização de fluorescência in-situ (FISH) ou imagens de lapso de tempo. Este sistema suporta uma ampla gama de leituras, incluindo sequenciamento de próxima geração, citometria de fluxo e vários ensaios celulares e bioquímicos. No geral, este sistema tridimensional de cultura de órgãos apoia a cultura de grandes tecidos intestinais intactos e possui amplas aplicações para análise de alta resolução e visualização de interações hospedeira-microbiota no ambiente intestinal local.
Introduction
O intestino é um órgão altamente complexo que contém uma ampla gama de tipos celulares (células epiteliais, células do sistema imunológico, neurônios e muito mais) organizado em uma estrutura particular que permite que as células interajam e se comuniquem entre si e com o conteúdo luminoso (microbiota, alimentos, etc.) 1. Atualmente, a caixa de ferramentas de pesquisa disponível para análise de interações host-microbiota inclui culturas in vitro células e modelos in vivo animais2. Os modelos in vivo animal fornecem uma construção fisiológica de tecido3, mas com baixo controle experimental e capacidade limitada de manipular as condições do experimento. Sistemas de cultura in vitro, por outro lado, usam células primárias ou linhas celulares que podem ser complementadas com micróbios4,oferecendo controle rigoroso sobre os parâmetros do experimento, mas não têm a complexidade celular e a arquitetura tecidual. Ensaios in vitro modernos permitem o uso avançado de amostras de tecido humano saudável e patológico, como organoides epiteliais derivados de fontes humanas ou camundongos5,6, e amostras que imitam o microambiente mucosal7. Outro exemplo é o ensaio “intestino em um chip”, que inclui a linha celular epitelial cólon humana (Caco2), matriz extracelular e canais microfluidos para imitar a condição fisiológica do intestino invariante8. No entanto, por mais avançados e inovadores que as amostras in vitro possam ser, elas não mantêm uma arquitetura de tecido normal ou uma composição celular ingênua.
Para lidar com isso, Yissachar et al. desenvolveram recentemente um sistema de cultura de órgãos ex vivo 9 (Figura 1) que mantém fragmentos intestinais intactos ex vivo,beneficiando-se das vantagens tanto dos modelos in vivo quanto in vitro. Este sistema de cultura de órgãos ex vivo gut é baseado em um dispositivo de cultura personalizado que suporta uma cultura multiplexada de seis tecidos de cólon, permitindo examinar entradas experimentais em condições comparáveis enquanto controla as entradas e saídas do sistema. Trabalhos recentes demonstraram que esse sistema é valioso para analisar respostas intestinais a bactérias intestinais individuais9, amostras inteiras de microbiota humana10 e metabólitos microbianos11. Este sistema permite, pela primeira vez, o estudo dessas interações entre hospedeiros e microbiotas precoces com alto nível de controle sobre os componentes hospedeiros, microbianos e ambientais. Além disso, permite monitorar e manipular o sistema durante todo o experimento, em tempo real.
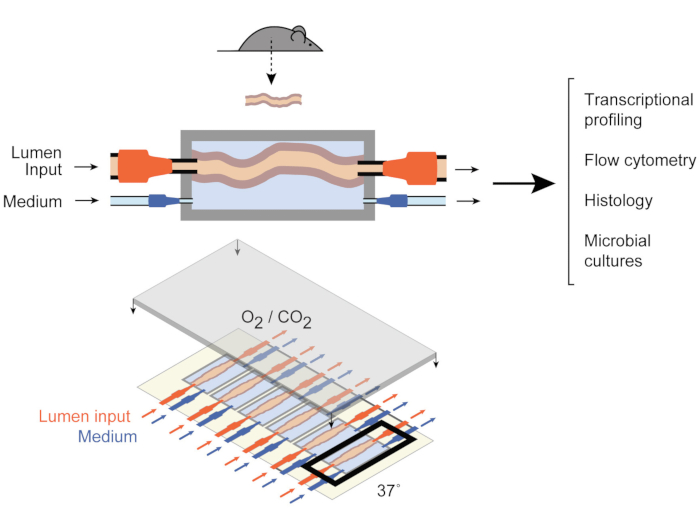
Figura 1: Esquemas do dispositivo de cultura intestinal. Todo um fragmento de tecido intestinal é anexado às portas de saída e entrada da câmara (superior), com bombas regulando o fluxo médio dentro do lúmen e na câmara média externa. Todo o dispositivo (inferior) contém 6 dessas câmaras. Este número foi modificado a partir de Yissachar et al. 2017. Clique aqui para ver uma versão maior desta figura.
Protocol
Representative Results
Discussion
Este artigo descreve um protocolo otimizado para culturas de órgãos ex vivo gut que Yissachar et al. desenvolveram recentemente (dados publicados9 e inéditos). O sistema de cultura de órgãos intestinais suporta a cultura multiplexada de fragmentos intestinais intactos, mantendo o fluxo luminal. Fornece controle total sobre o ambiente intra e extra-luminal (incluindo dose de estimulação, tempo de exposição e taxa de fluxo) e preserva a estrutura ingênua do tecido intestinal e sua…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Agradecemos aos membros do passado e presente do laboratório Yissachar por suas valiosas contribuições na otimização do protocolo do sistema de cultura de órgãos intestinais. Agradecemos a Yael Laure pela edição crítica do manuscrito. Este trabalho foi apoiado pela Israel Science Foundation (grant No. 3114831), pela Israel Science Foundation – Broad Institute Joint Program (grant No. 8165162) e pelo Fundo Gassner para Pesquisa Médica, Israel.
Materials
| Device | |||
| 18 Gauge Blunt Needle | Mcmaster | 75165a754 | |
| 22 Gauge Blunt Needle | Mcmaster | 75165a758 | |
| All Purpose Adhesive Selant 100% Silicone | DAP | 688 | |
| Cubic Vacuum Desiccator VDC-21+ 2 Shelves | AAAD4021 | ||
| Glass Slide 1 mm Thick | Corning | 2947-75X50 | |
| Mini Incubator im-10 | AAH24315K | ||
| MPC 301E Vacuum PUMP | VI-412711 | ||
| Plastic Quick Turn Tube Coupling Plugs | Mcmaster | 51525k121 | |
| plastic Quick Turn Tube Coupling Sockets | Mcmaster | 52525k211 | |
| Sylgard 184 Silicone Elastomer | Dow | Polydimethylsiloxane, PDMS | |
| Tubing | Mcmaster | 6516t11 | |
| Zortrax M200 | Zortrax | Zortrax Z-SUITE, Autodesk Fusion 360 | |
| Zortrax M200 Materials: z-ultrat | Zortrax | ||
| Medium | |||
| B27 Supplement (50x), Serum Free | Thermo Fisher Scientific | 17504044 | |
| HEPES Buffer (1M) | Thermo Fisher Scientific | 15630056 | |
| Iscove's Mod Dulbecco's Medium With Phenol Red (1x) | Thermo Fisher Scientific | 12440061 | |
| Knock-Out Serum | Thermo Fisher Scientific | 10828028 | |
| N2 Supplement (100x) | Thermo Fisher Scientific | A1370701 | |
| Non Essential Amino Acid (100x) | Thermo Fisher Scientific | 11140035 | |
| Surgical Tools | |||
| Large Scissors | Aseltech | 11-00-10 | |
| Sharp Forceps | F.S.T | 11297-10 | |
| Silk Braided Surgical Thread | SMI | 8010G | |
| Straight Scissors | F.S.T | 14091-09 | |
| Thin Forceps | F.S.T | 11051-10 | |
| Organ System | |||
| 0.1 µm Filter | Life Gene | ||
| 0.22 µm Filter | Life Gene | ||
| 5 mL Luer Lock Syringe | B-D | 309649 | |
| Greenough Stereo Microscope | ZEISS | Stemi 305 | |
| Recirculating Precision Air Heater "CUBE" | CUBE-2-LIS | ||
| Syringe Pump | new era pump systems inc | nep-ne-1600-em |
References
- Mowat, A. M., Agace, W. W. Regional specialization within the intestinal immune system. Nature Reviews Immunology. 14 (10), 667-685 (2014).
- Pearce, S. C., et al. Intestinal in vitro and ex vivo Models to Study Host-Microbiome Interactions and Acute Stressors. Frontiers in Physiology. 9 (1584), (2018).
- Hooper, L. V., et al. Molecular analysis of commensal host-microbial relationships in the intestine. Science. 291 (5505), 881-884 (2001).
- Haller, D., et al. Non-pathogenic bacteria elicit a differential cytokine response by intestinal epithelial cell/leucocyte co-cultures. Gut. 47 (1), 79-87 (2000).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett’s epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Tsilingiri, K., et al. Probiotic and postbiotic activity in health and disease: comparison on a novel polarised ex-vivo organ culture model. Gut. 61 (7), 1007-1015 (2012).
- Gazzaniga, F. S., et al. Harnessing Colon Chip Technology to Identify Commensal Bacteria That Promote Host Tolerance to Infection. Frontiers in Cellular and Infection Microbiology. 11, 638014 (2021).
- Yissachar, N., et al. An Intestinal Organ Culture System Uncovers a Role for the Nervous System in Microbe-Immune Crosstalk. Cell. 168 (6), 1135-1148 (2017).
- Duscha, A., et al. Propionic Acid Shapes the Multiple Sclerosis Disease Course by an Immunomodulatory Mechanism. Cell. 180 (6), 1067-1080 (2020).
- Grosheva, I., et al. High-Throughput Screen Identifies Host and Microbiota Regulators of Intestinal Barrier Function. Gastroenterology. 159 (5), 1807-1823 (2020).
- Blaize, J. F., Corbo, C. P. Serial Dilutions and Plating: Microbial Enumeration. Journal of Visualized Experiments. , (2021).
- Ivanov, I. I., et al. Induction of intestinal Th17 cells by segmented filamentous bacteria. Cell. 139 (3), 485-498 (2009).
- Schnupf, P., et al. Growth and host interaction of mouse segmented filamentous bacteria in vitro. Nature. 520 (7545), 99-103 (2015).
- Chung, H., et al. Gut immune maturation depends on colonization with a host-specific microbiota. Cell. 149 (7), 1578-1593 (2012).
- Atarashi, K., et al. Th17 Cell Induction by Adhesion of Microbes to Intestinal Epithelial Cells. Cell. 163 (2), 367-380 (2015).

