Ontwerp-tot-implementatiestudie voor ontwikkeling en patiëntvalidatie van op papier gebaseerde sleufschakelaardiagnostiek
Summary
Toegang tot gedecentraliseerde, goedkope en hoogwaardige diagnostiek die in de gemeenschap kan worden ingezet voor gedecentraliseerde tests is van cruciaal belang voor het bestrijden van wereldwijde gezondheidscrises. Dit manuscript beschrijft hoe op papier gebaseerde diagnostiek kan worden gebouwd voor virale RNA-sequenties die kunnen worden gedetecteerd met een draagbare optische lezer.
Abstract
Toegang tot moleculaire diagnostiek met lage belasting die in de gemeenschap kan worden ingezet om te testen, wordt steeds belangrijker en heeft betekenisvolle bredere implicaties voor het welzijn van samenlevingen en economische stabiliteit. De afgelopen jaren zijn er verschillende nieuwe isothermische diagnostische modaliteiten ontstaan om te voldoen aan de behoefte aan snelle, goedkope moleculaire diagnostiek. We hebben aan deze inspanning bijgedragen door de ontwikkeling en patiëntvalidatie van op toehold switch gebaseerde diagnostiek, inclusief diagnostiek voor de door muggen overgedragen Zika- en chikungunya-virussen, die prestaties leverden die vergelijkbaar waren met op goudstandaard reverse transcriptie-kwantitatieve polymerasekettingreactie (RT-qPCR) gebaseerde assays. Deze diagnostiek is goedkoop te ontwikkelen en te produceren en ze hebben het potentieel om diagnostische capaciteit te bieden aan omgevingen met weinig middelen. Hier biedt het protocol alle stappen die nodig zijn voor de ontwikkeling van een switch-gebaseerde test voor Zika-virusdetectie. Het artikel neemt lezers mee door het stapsgewijze diagnostische ontwikkelingsproces. Ten eerste dienen genomische sequenties van het Zika-virus als input voor het computationele ontwerp van kandidaat-switches met behulp van open-source software. Vervolgens wordt de assemblage van de sensoren voor empirische screening met synthetische RNA-sequenties en optimalisatie van diagnostische gevoeligheid getoond. Eenmaal voltooid, wordt validatie uitgevoerd met patiëntmonsters parallel met RT-qPCR en een speciaal gebouwde optische lezer, PLUM. Dit werk biedt een technische routekaart voor onderzoekers voor de ontwikkeling van goedkope op de koppeling gebaseerde sensoren voor toepassingen in de menselijke gezondheid, landbouw en milieumonitoring.
Introduction
RT-qPCR is de gouden standaardtechnologie voor klinische diagnostiek gebleven vanwege de uitstekende gevoeligheid en specificiteit. Hoewel zeer robuust, is de methode afhankelijk van dure, gespecialiseerde apparatuur en reagentia die temperatuurgecontroleerde distributie en opslag vereisen. Dit vormt aanzienlijke belemmeringen voor de toegankelijkheid van kwaliteitsdiagnostiek wereldwijd, met name in tijden van ziekte-uitbraken en in regio’s waar de toegang tot goed uitgeruste laboratoria beperkt is 1,2. Dit werd waargenomen tijdens de uitbraak van het Zika-virus in 2015/2016 in Brazilië. Met slechts vijf gecentraliseerde laboratoria beschikbaar om RT-qPCR-tests uit te voeren, ontstonden er aanzienlijke knelpunten, waardoor de toegang tot diagnostiek werd beperkt. Dit was vooral een uitdaging voor personen in peri-urbane omgevingen, die ernstiger werden getroffen door de uitbraak 3,4. In een poging om de toegang tot diagnostiek te verbeteren, toont het protocol een platform dat is ontwikkeld met het potentieel om gedecentraliseerde, goedkope en hoge capaciteitsdiagnostiek te bieden in instellingen met weinig middelen. Als onderdeel hiervan werd een diagnostische ontdekkingspijplijn opgezet, waarbij isothermische amplificatie en synthetische RNA-switchgebaseerde sensoren werden gekoppeld aan op papier gebaseerde celvrije expressiesystemen 5,6.
Celvrije eiwitsynthesesystemen (CFPS), in het bijzonder op E. coli gebaseerde celvrije systemen, zijn een aantrekkelijk platform voor een breed scala aan biosensingtoepassingen, van milieumonitoring 7,8 tot pathogene diagnostiek 5,6,9,10,11,12 . Cfps-systemen bestaan uit de componenten die nodig zijn voor transcriptie en vertaling en hebben aanzienlijke voordelen ten opzichte van biosensoren voor hele cellen. In het bijzonder wordt detectie niet beperkt door een celwand en zijn ze over het algemeen modulair van ontwerp, bioveilig, goedkoop en kunnen ze worden gevriesdroogd voor draagbaar gebruik. De mogelijkheid om op gencircuits gebaseerde reacties op substraten zoals papier of textiel te vriesdrogen, maakt transport mogelijk, langdurige opslag bij kamertemperatuur5 en zelfs integratie in draagbare technologie13.
Eerder werk heeft aangetoond dat E. coli celvrije systemen kunnen worden gebruikt om talrijke analyten te detecteren, bijvoorbeeld toxische metalen zoals kwik, antibiotica zoals tetracycline 7,14, hormoonontregelende chemicaliën 15,16, biomarkers zoals hippuurzuur17, pathogeen-geassocieerde quorumdetectiemoleculen 9,18 en illegale stoffen zoals cocaïne17 en gammahydroxybutyraat (GHB)19 . Voor de sequentiespecifieke detectie van nucleïnezuren zijn strategieën voor het grootste deel gebaseerd op het gebruik van switch-gebaseerde biosensoren gekoppeld aan isotherme amplificatietechnieken. Toehold-schakelaars zijn synthetische riboregulatoren (in de rest van de tekst ook wel gewoon ‘schakelaars’ genoemd) die een haarspeldstructuur bevatten die stroomafwaartse translatie blokkeert door de ribosomale bindingsplaats (RBS) en het startcodon te sekwestreren. Bij interactie met hun target trigger RNA wordt de haarspeldstructuur ontlast en wordt de daaropvolgende vertaling van een open leesframe van een reporter ingeschakeld20.
Isothermische amplificatie kan ook worden gebruikt als moleculaire diagnostiek21; deze methoden zijn echter gevoelig voor niet-specifieke versterking, waardoor de specificiteit en daarmee de nauwkeurigheid van de test kan worden teruggebracht tot onder die van RT-qPCR 22. In het hier gerapporteerde werk werd isotherme amplificatie stroomopwaarts van de switch-gebaseerde sensoren gebruikt om gecombineerde signaalversterking te bieden die klinisch relevante detectie van nucleïnezuren (femtomolaire tot attomolaire) mogelijk maakt. Deze koppeling van de twee methoden biedt ook twee sequentiespecifieke controlepunten die in combinatie een hoge mate van specificiteit bieden. Met behulp van deze aanpak heeft eerder werk de detectie aangetoond van virussen zoals Zika6, Ebola5, Norovirus10, evenals pathogene bacteriën zoals C. difficile23 en antibioticaresistente Tyfus12. Onlangs zijn celvrije toehold-schakelaars gedemonstreerd voor SARS-CoV-2-detectie in pogingen om toegankelijke diagnostiek te bieden voor de COVID-19-pandemie 11,12,13.
Het volgende protocol schetst de ontwikkeling en validatie van celvrije, op papier gebaseerde synthetische toehold switch assay voor Zika-virusdetectie, van in silico biosensorontwerp, via de assemblage- en optimalisatiestappen, tot veldvalidatie met patiëntmonsters. Het protocol begint met het in silico-ontwerp van RNA-sensoren en isothermische amplificatieprimers die specifiek zijn voor het Zika-virale RNA. Hoewel er tal van isotherme amplificatiemethoden bestaan, werd hier het gebruik van nucleïnezuursequentie-gebaseerde amplificatie (NASBA) aangetoond om de concentratie van het virale RNA-doelwit in de reactie te verhogen, waardoor klinisch significante gevoeligheid mogelijk werd. Praktisch gezien hebben isothermische versterkingsmethoden het voordeel dat ze bij een constante temperatuur werken, waardoor er geen gespecialiseerde apparatuur nodig is, zoals thermische cyclers, die over het algemeen beperkt zijn tot gecentraliseerde locaties.
Vervolgens wordt het proces beschreven van het assembleren van de synthetische toehold-schakelaarsensoren met reportercoderingssequenties door middel van overlapuitbreiding PCR en het screenen van de synthetische toehold-schakelaarsensoren voor optimale prestaties in celvrije systemen met synthetisch RNA. Voor deze set Zika-virussensoren hebben we het lacZ-gen geselecteerd dat codeert voor het β-galactosidase-enzym, dat in staat is om een colorimetrisch substraat, chlorofenol rood-β-D-galactopyranoside (CPRG), te splitsen om een gele naar paarse kleurverandering te produceren die met het oog of met een platenlezer kan worden gedetecteerd. Zodra de best presterende synthetische schakelaars zijn geïdentificeerd, wordt het proces beschreven voor het screenen van primers op basis van nucleïnezuursequentie gebaseerde isotherme amplificatie van de overeenkomstige doelsequentie met behulp van synthetisch RNA om sets te vinden die de beste gevoeligheid bieden.
Ten slotte worden de prestaties van het diagnostisch platform ter plaatse gevalideerd in Latijns-Amerika (figuur 1). Om de klinische diagnostische nauwkeurigheid te bepalen, wordt de op papier gebaseerde celvrije test uitgevoerd met behulp van Zika-virusmonsters van patiënten; parallel wordt een gouden standaard RT-qPCR-test uitgevoerd ter vergelijking. Om colorimetrische celvrije testen te monitoren, maken we on-site kwantificering van resultaten mogelijk in regio’s waar thermische cyclers niet beschikbaar zijn. De met de hand geassembleerde plaatlezer genaamd Portable, Low-Cost, User-friendly, Multimodal (PLUM; hierna draagbare plaatlezer genoemd) wordt hier ook geïntroduceerd24. Oorspronkelijk ontwikkeld als een begeleidend apparaat voor celvrije synthetische toehold-schakelaardiagnostiek, biedt de draagbare plaatlezer een toegankelijke manier om resultaten op een manier met hoge doorvoer te incuberen en te lezen, waardoor geïntegreerde, op computervisie gebaseerde softwareanalyse voor gebruikers wordt geboden.
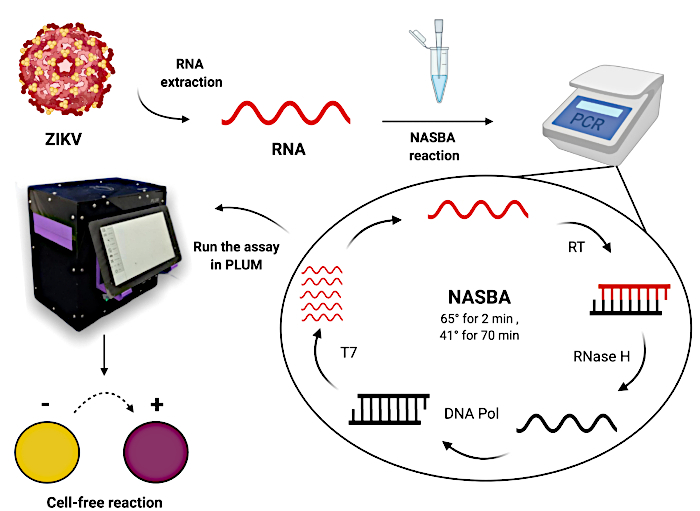
Figuur 1: Workflow voor het testen van patiëntmonsters met behulp van op papier gebaseerde celvrije toehold-switchreacties. Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
Het gecombineerde op papier gebaseerde systeem dat hier wordt beschreven, kan klinisch relevante moleculaire diagnostiek, met prestaties die functioneel vergelijkbaar zijn met RT-qPCR, naar het punt-van-behoefte brengen6. Belangrijk is dat voor externe instellingen de beschikbaarheid van diagnose op locatie de tijd tot resultaten kan verkorten van dagen tot uren. Om de programmeerbaarheid van deze aanpak te benadrukken, kan de beschreven pijplijn worden gebruikt om vrijwel elk pathogeendoel te detecteren. We hebben de moleculaire gereedschappen gekoppeld aan een speciaal gebouwde draagbare plaatlezer, die compact is en compatibel met batterijwerking (8-9 uur) en on-board data-analyse biedt om gedistribueerde toepassingen mogelijk te maken. In ander werk hebben we de gecombineerde hardware en het diagnostische platform voor het Zika-virus gevalideerd met 268 patiëntmonsters, parallel aan RT-qPCR, en een diagnostische nauwkeurigheid van 98,5% 24 gevonden. Alles bij elkaar genomen is ons doel om de technologieoverdracht van dit platform aan onderzoekers mogelijk te maken, zodat het door de gemeenschap kan worden hergebruikt en verbeterd om onvervulde diagnostische behoeften aan te pakken.
Het ontwerpproces van de in silico toehold switch is geïntegreerd en geautomatiseerd in een pijplijn die in drie fasen kan worden verdeeld. De eerste fase genereert een pool van toehold switch-ontwerpen die hybridiseren naar de doelsequentie in één nucleotide-stappen. De tweede fase onderzoekt de secundaire structuur en de beschikbaarheid van de sleufschakelaar en elimineert sensoren met in-frame voortijdige stopcodons. Een scoringsfunctie die rekening houdt met meerdere factoren (bijv. defectniveau van de toehold-switch, beschikbaarheid van toehold-switch en toegankelijkheid van de doellocatie) wordt vervolgens geïmplementeerd om top toehold-switchontwerpen te selecteren op basis van algemene scores. In de laatste fase wordt een lijst met sequenties gegenereerd voor de top toehold switch-ontwerpen en de bijbehorende doeltriggers. De bovenste sensorsequenties moeten worden gescreend op specificiteit tegen het menselijke transcriptoom en nauw verwante virale genomen met behulp van NCBI/Primer-BLAST25. Het is ook de beste praktijk om de sensordoellocaties te screenen op sequentiebehoud in het Zika-virale genoom om ervoor te zorgen dat de sensoren een brede en robuuste detectie bieden. Er zijn verschillende versies van de ontwerpsoftware voor de toehold-schakelaar ontwikkeld en het ontwerpalgoritme stelt gebruikers in staat om twee versies te genereren, ofwel serie A6 of serie B-sleufschakelaars6. In dit artikel ligt de focus op het serie B-staartschakelaarontwerp.
Na commerciële DNA-synthese kunnen de toehold-schakelaars snel worden geassembleerd en vervolgens worden getest door een eerste screening uit te voeren tegen een synthetische doeltriggersequentie die overeenkomt met korte regio’s (200-300 nt) van het doelgenoom. Voor het screenen van de prestaties van op toehold switch gebaseerde sensoren is het ideaal om de doelsequentie in de vorm van RNA toe te voegen. In dit artikel zijn de stappen beschreven die nodig zijn om in vitro getranscribeerd trigger-RNA toe te voegen. Indien beschikbaar, kunnen echter genoomsjablonen over de volledige lengte worden gebruikt, zoals gekwantificeerde virale RNA-extracten of commerciële synthetische RNA-genomen of -standaarden. Het gebruik van volledige RNA-genomen voor de eerste screening van de toehold-switch is gunstig omdat het kan informeren of aanvullende factoren, zoals de secundaire structuur van RNA, de sensorprestaties zullen beïnvloeden. Om de AAN/UIT-verhouding van kandidaatschakelaars te optimaliseren, kan het DNA van de grijpschakelaar worden getitreerd in de celvrije reactie. Deze stap kan ook dienen om goed presterende toehold-schakelaars te identificeren (vouwversterking of hoge AAN / UIT-ratio) en lekkende toehold-schakelaars (hoog signaal in afwezigheid van het doel-RNA) weg te laten uit downstream-karakteriseringsstappen.
Om de detectiegrens van de best presterende toehold switch-kandidaten te verbeteren, wordt NASBA gebruikt om klinisch relevante concentraties van doel-Zika viraal RNA te verhogen tot een niveau dat kan worden gedetecteerd door toehold switches6. Verschillende combinaties van voorwaartse en omgekeerde primersets worden gescreend om de beste NASBA-primer- en toehold-switchcombinaties te bepalen om detectie bij klinisch relevante concentraties mogelijk te maken. Zodra een ideale primer set en toehold switch combinatie is geïdentificeerd, wordt de assay verder gebracht naar klinische validatie. Het is belangrijk op te merken dat de teengreepschakelaar en NASBA-screeningsfasen arbeids- en resource-intensief kunnen zijn en daarom is testontwikkeling het meest geschikt voor goed uitgeruste onderzoekslocaties. Hoewel we geen procesautomatisering hebben toegepast, is het waarschijnlijk dat dit de iteratieve ontwerp-, bouw- en testcyclus32 kan versnellen. Gelukkig kan de doorlooptijd van sensorontwerp en testen tot implementatie opmerkelijk kort zijn (minder dan een week), waardoor deze strategie ideaal is voor tijdkritische situaties, zoals epidemische uitbraken6.
Zelfs nadat een biosensor met klinisch relevante gevoeligheid is ontwikkeld, zijn er technische uitdagingen die moeten worden aangepakt. Aangezien dit protocol handmatige bediening omvat en een procedure met meerdere stappen is, bestaat het risico op kruisbesmetting tussen monsters. We doen ons best om dit risico te verminderen door zorgvuldige laboratoriumpraktijken. In een recente klinische studie van 268 patiëntenmonsters ondervonden we geen besmettingsproblemen; het is echter een belangrijke overweging24. Met dit in gedachten blijft het protocol een laboratoriumtest en vereist het een bekwame gebruiker met de juiste moleculaire biologietechnieken. Een extra overweging voor de inzet is de RNA-isolatie van patiëntmonsters. Hier beschrijven we RNA-isolatie met behulp van kolomgebaseerde nucleïnezuurextractiekits. In ander werk hebben we echter een effectieve en eenvoudige kooklysemethode gedemonstreerd (95 °C gedurende 2 minuten) voor de verwerking van patiëntmonsters met lage belasting6. Deze strategie elimineert bijna de kosten die gepaard gaan met RNA-extractie en vermijdt het gebruik van kolomgebaseerde nucleïnezuurextractiekits, die een logistieke uitdaging kunnen vormen in omgevingen met weinig middelen of problemen met de toeleveringsketen tijdens crises, zoals de COVID-19-pandemie33.
Zoals we tijdens de COVID-19-pandemie hebben gezien, kunnen de instrumenten die worden gebruikt om RT-qPCR uit te voeren zelf als een knelpunt dienen en de toegang van patiënten tot testen beperken. Deze factor, die ook grotendeels financieel is, leidt tot een gecentraliseerde testmodus die de diagnostische toegang kan beperken. Tijdens de Zika-uitbraak van 2015/2016 waren bijvoorbeeld slechts vijf nationale referentielaboratoria beschikbaar in Brazilië, wat vertragingen veroorzaakte bij het testen van patiënten. Zonder rekening te houden met het potentiële voordeel van schaalvoordelen, zijn de huidige kosten van goederen voor de draagbare plaatlezer ~ $ 500 USD, die zelfs als deze vervijfvoudigd is om rekening te houden met arbeid en commerciële marge, nog steeds een betaalbaar instrument biedt. Dit is goed te vergelijken met RT-qPCR-instrumenten die variëren in kosten van $ 15.000 – $ 90.000 USD34. Bovendien zijn de geschatte kosten per test voor de celvrije test in Latijns-Amerika ongeveer $ 5,48 USD, terwijl de kosten per test van RT-qPCR in Brazilië ~ $ 10-11 USD waren ten tijde van de Zika-uitbraak36. Naast de kosten van apparatuur, heeft de draagbare plaatlezer een kleine voetafdruk (20 cm3), automatische analyse, gegevensupload naar de cloud via internet en kan deze op batterijvoeding worden uitgevoerd. Deze functies breiden de potentiële instellingen waar testen kan worden ingezet drastisch uit en breiden tegelijkertijd de patiëntenpopulatie uit die kan worden bediend.
Tot op heden zijn de meest voorkomende commerciële E. coli CFPS-platforms de S30- en PURE-systemen37; een belangrijke overweging bij het verbeteren van de toegang tot diagnostiek in lage- en middeninkomenslanden is echter de beperkte binnenlandse beschikbaarheid van deze reagentia. Een belangrijke stap in de richting van het oplossen van deze uitdaging is de ontwikkeling van lokale CFPS-productie. Het Federici-lab heeft onlangs aanzienlijke vooruitgang geboekt bij de ontwikkeling van een niet-commercieel platform om op lysaat gebaseerde sensoren te implementeren in op lysaat gebaseerde celvrije systemen, met een LOD van 2,7 fM met Zika-virus RNA14. Deze prestatie maakt het niet alleen mogelijk om de reagentia in het land van gebruik te maken, waardoor importtarieven en vertragingen worden vermeden, maar de arbeidskosten schalen ook naar lokale tarieven en dus kunnen de totale kosten aanzienlijk worden verlaagd. In het werk geschetst door de Federici-groep bedroegen de kosten voor het produceren van de CFPS-expressiereactie (5 μL) in Chili 6,9 cent (USD) 35,38, wat een dubbele stimulans (verbeterde logistiek en kosten) biedt voor het implementeren van op lysaat gebaseerde systemen35,38.
De plaatsing van RT-qPCR-vergelijkbare tests in gedistribueerde diagnostische netwerken kan aanzienlijke voordelen opleveren ten opzichte van de huidige praktijken die afhankelijk zijn van het transport van monsters naar gecentraliseerde RT-qPCR-faciliteiten. In peri-urbane omgevingen, waar Zika-gevallen geconcentreerd waren, vertraagt de fysieke afstand tussen een patiënt en de diagnostische faciliteit de diagnose en verhoogt het risico dat de resultaten de patiënt niet op een klinisch relevant moment bereiken. Het is onze hoop dat het hier gepresenteerde werk kan bijdragen aan het in staat stellen van de onderzoeksgemeenschap, door de overdracht van kennis, om gedecentraliseerde biotechnologie en draagbare hardware te creëren voor menselijke gezondheid, landbouw en milieumonitoring.
Disclosures
The authors have nothing to disclose.
Acknowledgements
De auteurs bedanken alle leden van de Green, Pardee en Pena labs, evenals alle co-auteurs van eerdere manuscripten met betrekking tot het werk dat in dit manuscript wordt onthuld. S.J.R.d.S. werd ondersteund door een PhD fellowship gesponsord door de Foundation for Science and Technology van Pernambuco (FACEPE), Brazilië, referentienummer IBPG-1321-2.12/18, en wordt momenteel ondersteund door een Postdoctoral Fellowship gesponsord door de Universiteit van Toronto, Canada. P.B. wordt ondersteund door de William Knapp Buckley Award van de Faculteit Farmacie, Universiteit van Toronto. M.K. werd ondersteund door het Precision Medicine Initiative (PRiME) aan het interne fellowshipnummer PRMF2019-002 van de Universiteit van Toronto. Dit werk werd ondersteund door fondsen aan K.P van het Canada Research Chairs Program (bestanden 950-231075 en 950-233107), het Major Research Project Management Fund van de Universiteit van Toronto, het CIHR Foundation Grant Program (201610FDN-375469), en aan L.P, A.A.G. en K.P via de CIHR / IDRC Team Grant: Canada-Latin / America-Caribbean Zika Virus Program (FRN: 149783), evenals door fondsen aan K.P. van het Canada’s International Development Research Centre (subsidie 109434-001) via de Canadese 2019 Novel Coronavirus (COVID-19) Rapid Research Funding Opportunity. Dit werk werd ook ondersteund door fondsen aan A.A.G. van een Arizona Biomedical Research Commission New Investigator Award (ADHS16-162400), de Gates Foundation (OPP1160667), een NIH Director’s New Innovator Award (1DP2GM126892), een NIH R21 award (1R21AI136571-01A1) aan K.P./A.A.G, en een Alfred P. Sloan Fellowship (FG-2017-9108). Figuur 1 is gemaakt met Biorender.com onder academische licentie voor K.P.
Materials
| 384 well plate covers – aluminum | Sarstedt | 95.1995 | Used to cover the 384-well plates before they are inserted into the PLUM reader |
| 384 well plate covers – transparent | Sarstedt | 95.1994 | Used to cover the 384-well plates before they are inserted into the BioTek plate reader |
| 384 well plates | VWR | CA11006-180 | 2 mm paper-based diagnostics are placed into the wells of these plates for quantification |
| Agarose | BioShop Canada | AGA001.500 | Gel electrophoresis |
| BSA | BioShop Canada | ALB001.500 | Blocking agent for the Whatman filter paper |
| Cell free reactions | New England Biolabs | E6800L | PURExpress |
| CPRG | Roche | 10884308001 | Chlorophenol red-b-D-galactopyranoside |
| Disposable Sterile Biopsy Punches | Integra Miltex | 23233-31 | Used to create 2 mm paper discs that fit into a 384-well plate |
| DNAse I | Thermo Scientific | K2981 | Digests template DNA following incubation of the in vitro transcription reaction |
| DNAse I Kit | Thermo Scientific | 74104 | DNase I Kit For removing template DNA from IVT RNA |
| dNTPs | New England Biolabs | N0446S | Used for PCRs |
| electrophoresis system | Bio-Rad | 1704487 | Used to run the agarose gels |
| Gel imaging station | Bio-Rad | 1708265 | ChemiDoc XRS+ Imaging System |
| IVT kit | New England Biolabs | E2040S | Used for in vitro transcribing template (trigger) RNA for switch screening |
| Nanodrop One | Thermo Scientific | ND-ONE-W | Used for determining nucleic acid concentrations |
| NASBA kit | Life Sciences Advanced Technologies | NWK-1 | Isothermal amplification reaction components |
| Nuclease free H20 | invitrogen | 10977015 | Added to reaction mixes |
| PAGE electrophoresis system | Biorad | 1658001FC | Used to cast and run polyacrylamide gels |
| pCOLADuet-LacZ DNA | Addgene | 75006 | https://www.addgene.org/75006/ |
| Phusion polymerase/reactioin buffer | New England Biolabs | M0530L | Used for PCRs |
| Plate reader | BioTek | BioTek NEO2 | Multi Mode Plate Reader, Synergy Neo2 |
| Primers | Integrated DNA Technologies | Custom oligo synthesis | |
| Q5 polymerase/reaction buffer | New England Biolabs | M0491L | Used for PCRs |
| Qiagen PCR Puriifcation Kit | QIAGEN | 27106 | QIAprep Spin Miniprep Kit |
| RNA loading dye | New England Biolabs | B0363S | 2X RNA loading dye |
| RNA Purification Kit | QIAGEN | EN0521 | QIAamp Viral RNA extraction kit |
| RNase inhibitor | New England Biolabs | M0314S | Used to prevent contamination of RNases A, B, and C |
| RT-qPCR kit | QIAGEN | 208352 | QuantiNova Probe RT-PCR Kit |
| SYBR Gold | Invitrogen S11494 | S11494 | PAGE gel stain for nucleic acids |
| TAE Buffer | BioShop Canada | TAE222.4 | Gel electrophoresis buffer |
| Thermal Cycler | Applied Biosystems | 4484073 | Used for temperature cycling and incubating reactions |
| Whatman 42 filter paper | GE Healthcare | 1442-042 | Used to imbed molecular components for paper-based diagnostics |
References
- Urdea, M., et al. Requirements for high impact diagnostics in the developing world. Nature. 444, 73-79 (2006).
- Yager, P., Domingo, G. J., Gerdes, J. Point-of-care diagnostics for global health. Annual Review of Biomedical Engineering. 10, 107-144 (2008).
- Faria, N. R., et al. Mobile real-time surveillance of Zika virus in Brazil. Genome Medicine. 8 (1), 97 (2016).
- Faria, N. R., et al. Zika virus in the Americas: Early epidemiological and genetic findings. Science. 352 (6283), 345-349 (2016).
- Pardee, K., et al. Paper-based synthetic gene networks. Cell. 159 (4), 940-954 (2014).
- Pardee, K., et al. Rapid, low-cost detection of Zika virus using programmable biomolecular components. Cell. 165 (5), 1255-1266 (2016).
- Duyen, T. T. M., et al. Paper-based colorimetric biosensor for antibiotics inhibiting bacterial protein synthesis. Journal of Bioscience and Bioengineering. 123 (1), 96-100 (2017).
- Jung, J. K., et al. Cell-free biosensors for rapid detection of water contaminants. Nature Biotechnology. 38 (12), 1451-1459 (2020).
- Yang, Y. H., et al. Cell-free Escherichia coli-based system to screen for quorum-sensing molecules interacting with quorum receptor proteins of streptomyces coelicolor. Applied and Environmental Microbiology. 75 (19), 6367 (2009).
- Ma, D., Shen, L., Wu, K., Diehnelt, C. W., Green, A. A. Low-cost detection of norovirus using paper-based cell-free systems and synbody-based viral enrichment. Synthetic Biology. 3 (1), (2018).
- Park, S., Lee, J. W. Detection of coronaviruses using RNA toehold switch sensors. International Journal of Molecular Sciences. 22 (4), 1-13 (2021).
- Amalfitano, E., et al. A glucose meter interface for point-of-care gene circuit-based diagnostics. Nature Communications. 12 (1), 1-10 (2021).
- Nguyen, P. Q., et al. Wearable materials with embedded synthetic biology sensors for biomolecule detection. Nature Biotechnology. 39 (11), 1366-1374 (2021).
- Pellinen, T., Huovinen, T., Karp, M. A cell-free biosensor for the detection of transcriptional inducers using firefly luciferase as a reporter. Analytical Biochemistry. 330 (1), 52-57 (2004).
- Salehi, A. S. M., et al. Cell-free protein synthesis approach to biosensing hTRβ-specific endocrine disruptors. Analytical Chemistry. 89 (6), 3395-3401 (2017).
- Salehi, A. S. M., et al. Biosensing estrogenic endocrine disruptors in human blood and urine: A RAPID cell-free protein synthesis approach. Toxicology and Applied Pharmacology. 345, 19-25 (2018).
- Voyvodic, P. L., et al. Plug-and-play metabolic transducers expand the chemical detection space of cell-free biosensors. Nature Communications. 10 (1), 1-8 (2019).
- Yang, W. C., Patel, K. G., Wong, H. E., Swartz, J. R. Simplifying and streamlining Escherichia coli-based cell-free protein synthesis. Biotechnology Progress. 28 (2), 413-420 (2012).
- Gräwe, A., et al. A paper-based, cell-free biosensor system for the detection of heavy metals and date rape drugs. PLOS One. 14 (3), 0210940 (2019).
- Green, A. A., Silver, P. A., Collins, J. J., Yin, P. Toehold Switches: De-Novo-Designed Regulators of Gene Expression. Cell. 159 (4), 925-939 (2014).
- Craw, P., Balachandran, W. Isothermal nucleic acid amplification technologies for point-of-care diagnostics: a critical review. Lab on a Chip. 12 (14), 2469-2486 (2012).
- Zyrina, N. V., Antipova, V. N. Nonspecific Synthesis in the Reactions of Isothermal Nucleic Acid Amplification. Biochemistry (Moscow). 86 (7), 887-897 (2021).
- Takahashi, M. K., et al. A low-cost paper-based synthetic biology platform for analyzing gut microbiota and host biomarkers. Nature Communications. 9 (1), 1-12 (2018).
- Karlikow, M., et al. Field validation of the performance of paper-based tests for the detection of the Zika and chikungunya viruses in serum samples. Nature Biomedical Engineering. 6 (3), 246-256 (2022).
- Agarwala, R., et al. Database resources of the National Center for Biotechnology Information. Nucleic Acids Research. 44 (1), 7-19 (2016).
- . BLAST: Basic Local Alignment Search Tool Available from: https://blast.ncbi.nlm.nih.gov/Blast.cgi (2022)
- Deiman, B., Van Aarle, P., Sillekens, P. Characteristics and applications of nucleic acid sequence-based amplification (NASBA). Molecular Biotechnology. 20 (2), 163-179 (2002).
- Zadeh, J. N., Wolfe, B. R., Pierce, N. A. Nucleic acid sequence design via efficient ensemble defect optimization. Journal of Computational Chemistry. 32 (3), 439-452 (2011).
- JoVE Science Education Database. Basic Methods in Cellular and Molecular Biology. DNA Gel Electrophoresis. Journal of Visualized Experiments: JoVE. , (2021).
- Lanciotti, R. S., et al. Genetic and serologic properties of Zika virus associated with an epidemic, Yap State, Micronesia, 2007. Emerging Infectious Diseases. 14 (8), 1232 (2008).
- Walsh, D. I., et al. Standardizing automated DNA assembly: Best practices, metrics, and protocols using robots. SLAS Technology. 24 (3), 282 (2019).
- Silva, S. J. R., de Magalhães, J. J. F., de Pena, L. Simultaneous circulation of DENV, CHIKV, ZIKV and SARS-CoV-2 in Brazil: An inconvenient truth. One Health. 12, 100205 (2021).
- Kimura, S., Fujinaga, K., Sekiya, T. PCR machine. Tanpakushitsu kakusan koso. Protein, Nucleic Acid, Enzyme. 41 (5), 514-517 (1996).
- Arce, A., et al. Decentralizing cell-free RNA sensing with the use of low-cost cell extracts. Frontiers in Bioengineering and Biotechnology. 9, 727584 (2021).
- Silva, S. J. R., Pardee, K., Balasuriya, U. B. R., Pena, L. Development and validation of a one-step reverse transcription loop-mediated isothermal amplification (RT-LAMP) for rapid detection of ZIKV in patient samples from Brazil. Scientific Reports. 11 (1), 1-13 (2021).
- Shimizu, Y. Cell-free translation reconstituted with purified components. Nature Biotechnology. 19 (8), 751-755 (2001).
- Lavickova, B., Maerkl, S. J. A simple, robust, and low-cost method to produce the PURE cell-free system. ACS Synthetic Biology. 8 (2), 455-462 (2019).

