Estandarización y mantenimiento de cultivos de organoides hepáticos e intestinales caninos en 3D para su uso en investigación biomédica
Summary
Se describen métodos experimentales para cosechar células madre adultas de tejidos intestinales y hepáticos caninos para establecer cultivos de organoides en 3D. Además, se discuten las técnicas de laboratorio para garantizar un crecimiento constante y proporcionar procedimientos operativos estándar para cosechar, biobancar y revivir cultivos de organoides intestinales y hepáticos caninos.
Abstract
Los perros desarrollan enfermedades multifactoriales complejas análogas a los humanos, incluidas las enfermedades inflamatorias, las enfermedades metabólicas y el cáncer. Por lo tanto, representan modelos animales grandes relevantes con el potencial de traslación a la medicina humana. Los organoides son estructuras 3-dimensionales (3D), autoensambladas derivadas de células madre que imitan la microanatomía y la fisiología de su órgano de origen. Estos modelos traslacionales in vitro se pueden utilizar para aplicaciones de permeabilidad y descubrimiento de fármacos, evaluación toxicológica y para proporcionar una comprensión mecanicista de la fisiopatología de las enfermedades crónicas multifactoriales. Además, los organoides caninos pueden mejorar la vida de los perros de compañía, proporcionando información en diversas áreas de la investigación veterinaria y facilitando aplicaciones de tratamiento personalizado en medicina veterinaria. Un pequeño grupo de donantes puede crear un biobanco de muestras de organoides, reduciendo la necesidad de una recolección continua de tejido, ya que las líneas celulares organoides se pueden subcultivar indefinidamente. A continuación, se presentan tres protocolos que se centran en el cultivo de organoides caninos intestinales y hepáticos derivados de células madre adultas. El Protocolo de Aislamiento de Organoides Caninos describe métodos para procesar el tejido y la incrustación del aislado celular en una matriz de soporte (matriz de membrana extracelular solubilizada). El Protocolo de Mantenimiento de Organoides Caninos describe el crecimiento y mantenimiento de organoides, incluida la limpieza y el paso junto con el momento adecuado para la expansión. El Protocolo de Sustracción y Biobanco de Organoides describe formas de extraer, congelar y preservar organoides para su posterior análisis.
Introduction
Los roedores son el modelo animal más utilizado para la investigación biomédica y traslacional1. Son excepcionalmente útiles para investigar la patogénesis molecular básica de las enfermedades, aunque recientemente se ha cuestionado su relevancia clínica para las enfermedades multifactoriales crónicas2. El modelo canino exhibe varias ventajas en comparación con los roedores3,4. Perros y humanos comparten similitudes en metabolómica y microbioma intestinal que se desarrolló debido al consumo de dieta humana a lo largo de varios períodos de su domesticación5,6,7. Las similitudes entre la anatomía y fisiología gastrointestinal canina y humana es otro de los ejemplos8.
Además, los perros a menudo comparten entornos y estilos de vida similares con sus dueños9. La mayor esperanza de vida de los perros en comparación con los roedores permite el desarrollo natural de numerosas afecciones crónicas10. La enfermedad inflamatoria intestinal o el síndrome metabólico son ejemplos de enfermedades crónicas multifactoriales que comparten importantes similitudes entre humanos y perros11,12. Los ensayos preclínicos caninos que involucran a perros con enfermedades naturales pueden generar datos más confiables que los obtenidos de modelos de roedores13. Sin embargo, para minimizar el uso de la investigación con animales vivos y cumplir con los principios de las 3R (Reduce, Refine, Replace)14, han surgido alternativas a las pruebas in vivo utilizando organoides caninos 3D in vitro15.
Los organoides son estructuras derivadas de células madre 3D autoensambladas que recapitulan la fisiología y la microanatomía de sus órganos originales16,17. Esta tecnología fue descrita por primera vez por Sato et al. en 200917 y permitió realizar más estudios in vitro traducibles en líneas celulares epiteliales de lo que era posible anteriormente utilizando cultivos de células cancerosas 2D18,19,20. Los organoides son modelos in vitro útiles en muchas disciplinas biomédicas como en estudios toxicológicos preclínicos21,22,23, de absorción o metabolismo24,25,26,27,28, así como en enfoques médicos personalizados29,30,31 . El cultivo exitoso de organoides intestinales caninos se ha descrito por primera vez en 201912, mientras que los organoides hepáticos derivados de un perro fueron reportados por primera vez por Nantasanti et al. en 201532. Desde entonces, los organoides caninos se han utilizado con éxito en estudios que investigan enteropatías crónicas caninas, tumores del estroma gastrointestinal, adenocarcinoma colorrectal12 y enfermedad de Wilson33,34.
Si bien las células madre adultas se pueden cosechar a través de necropsias, la tecnología organoide no siempre requiere el sacrificio de los animales. Las biopsias endoscópicas y laparoscópicas, o incluso los aspirados con aguja fina de órganos35, son una fuente viable de células madre adultas para el aislamiento de organoides epiteliales12. El uso generalizado de estas técnicas no invasivas en la práctica veterinaria facilita las opciones para la investigación traslacional inversa (traducción de la información de la práctica clínica veterinaria a la práctica clínica humana y viceversa)15. Se puede garantizar un mayor avance de la tecnología de organoides mediante la estandarización de los métodos de cultivo y mantenimiento de organoides. El protocolo organoide presentado aquí se basa parcialmente en el trabajo publicado previamente de Saxena et al. de 201536, y los métodos se adaptaron para adaptarse a los detalles del cultivo de organoides intestinales y hepáticos caninos. El flujo de trabajo general de los protocolos de organoides caninos se representa en la Figura 1.
El Protocolo de Aislamiento de Organoides Caninos introduce métodos para obtener muestras de biopsias endoscópicas, laparoscópicas y quirúrgicas, así como necropsias. Describe el pretratamiento inicial de las muestras de tejido y las metodologías utilizadas para el transporte al laboratorio. Los materiales y reactivos necesarios para el aislamiento de organoides se resumen en la sección “Preparación para el aislamiento”. El proceso de aislamiento de células madre adultas a partir de muestras de tejido se describe con más detalle. Finalmente, se discute el proceso de recubrimiento de organoides en estructuras en forma de cúpula utilizando una matriz de membrana extracelular solubilizada.
El segundo protocolo, el Protocolo de Mantenimiento de Organoides Caninos, describe los métodos de documentación y cultivo de organoides. Los cambios en los medios y su frecuencia se analizan en esta sección. Además, se describen los procedimientos de laboratorio como el pasaje y la limpieza de los cultivos celulares, que son esenciales para garantizar el mantenimiento exitoso de los organoides caninos 3D. El paso apropiado es un paso crítico del protocolo, y los posibles ajustes y la solución de problemas de este paso se discuten más a fondo en el manuscrito.
El último protocolo es el Protocolo de Sustracción y Biobanco de Organoides Caninos que contiene métodos para preparar organoides adultos para la incrustación de parafina y la preservación del ARN. Los métodos de biobanco de muestras de organoides en el almacenamiento de nitrógeno líquido también se describen aquí. Finalmente, se discuten las formas de descongelar las muestras congeladas y apoyar su crecimiento.
En conclusión, este artículo tiene como objetivo proporcionar procedimientos consistentes de cultivo de organoides caninos a través de la estandarización de protocolos entre laboratorios. Al hacerlo, el manuscrito tiene como objetivo facilitar la reproducibilidad de los datos derivados de modelos organoides caninos para aumentar su relevancia en la investigación biomédica traslacional.
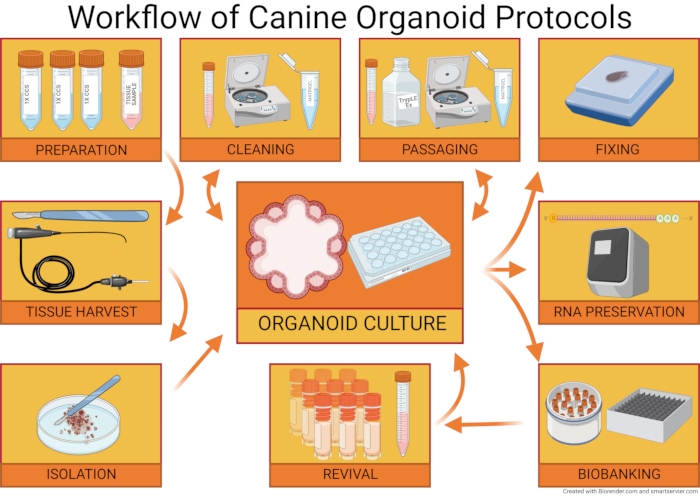
Figura 1: Flujo de trabajo de protocolos organoides caninos. El Protocolo de Aislamiento de Organoides Caninos describe la preparación de los materiales necesarios para el aislamiento de organoides, la recolección de una muestra de tejido (a través de necropsias, biopsias endoscópicas, laparoscópicas y quirúrgicas) y la orientación sobre la disociación celular y el recubrimiento de la población celular. El Protocolo de Mantenimiento de Organoides Caninos discute la limpieza y el pasaje del cultivo de organoides. El Protocolo de Sustracción y Biobanco de Organoides discute la preparación de muestras de organoides para la incrustación de parafina y la caracterización adicional de organoides. También se discuten los métodos para biobancar cultivos de organoides y revivirlos del almacenamiento en nitrógeno líquido. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
Actualmente hay una falta de protocolos estandarizados disponibles para el aislamiento y mantenimiento de organoides hepáticos e intestinales caninos. Se justifica el establecimiento de procedimientos operativos estándar para cultivos de organoides para que este modelo sea aplicable en diferentes entornos de laboratorio. Específicamente, proporcionar protocolos operativos estandarizados para el cultivo de estos modelos organoides caninos es clave para caracterizar el crecimiento normal de los organoides durante el cultivo y el pasaje para derivar puntos de tiempo óptimos para la expansión y el mantenimiento. Los organoides intestinales caninos cultivados mediante el protocolo han sido previamente caracterizados por Chandra et al.12.
Uno de los pasos más críticos del protocolo es la transmisión de organoides. Se determinó que el momento óptimo para el primer paso de los esferoides hepáticos era el día 7 después del aislamiento en función de las mediciones de esferoides hepáticos. El volumen máximo de esferoides se alcanzó en el día 7, y al mismo tiempo, los esferoides comenzaron a brotar y formaron organoides hepáticos. El aumento en el volumen total de organoides desde el día 2-7 después del aislamiento fue de más de 365 veces, lo que sugiere que el tiempo de paso óptimo es más largo que el cultivo de organoides intestinales caninos. Después de 7 días en cultivo, no se observaron signos gruesos de apoptosis celular en el esferoide hepático, incluso sin limpieza ni paso (Figura 7). Pasar los organoides intestinales y hepáticos puede ser un desafío, ya que el procedimiento puede conducir a la pérdida de células y la viabilidad alterada. Los resultados indican que la incubación prolongada de organoides hepáticos con proteasa similar a la tripsina (hasta 12 min) no influye negativamente en el subcultivo. La incubación de los organoides en proteasa similar a la tripsina durante más de 24 minutos puede ser perjudicial para el subcultivo posterior de los organoides.
En caso de rotura subóptima en los grupos celulares con el paso organoide, la disociación mecánica en lugar de la incubación prolongada con proteasa similar a la tripsina podría ser más beneficiosa. Si se encuentran problemas con la disociación adecuada de los organoides, se puede intentar un breve vórtice de las muestras para mejorar el rendimiento del pasaje. Por otro lado, el vórtice tiene el potencial de arruinar un cultivo y dañar las células, por lo que solo debe usarse cuando otros procedimientos han fallado repetidamente. La ruptura de organoides hepáticos en células individuales reduce la tasa de crecimiento de los organoides, mientras que dividirlos en grupos de células puede mejorar en gran medida su viabilidad. Se eligieron diez minutos como tiempo de incubación para el protocolo de organoides. Se consideró que un punto de tiempo de incubación de 12 minutos no era citotóxico en comparación con una incubación de 24 minutos en el experimento de proteasa similar a la tripsina.
El experimento de supervivencia confirmó que los organoides hepáticos caninos podrían sobrevivir hasta 19,5 días en condiciones desfavorables (agotamiento estructural y nutricional). Los organoides que sobrevivieron a estas condiciones por más tiempo se cultivaron con medios CMGF +. Esta observación podría haber sido causada por el crecimiento más lento de organoides hepáticos en medios no suplementados con inhibidor de Rock y GSK3β. Los cultivos de organoides con CMGF+ R/G crecieron más rápido y pueden haber agotado sus recursos más rápido. Este experimento abre posibilidades de miniaturizar el cultivo de organoides caninos para lograr una conversión del sistema de alto rendimiento. Tal tecnología muestra el potencial de facilitar el descubrimiento de fármacos o estudios toxicológicos a un costo sustancialmente reducido.
Algunos problemas comunes que se encuentran durante el mantenimiento del cultivo de organoides caninos son la solidificación inadecuada de la muestra durante el revestimiento, la contaminación del cultivo y el establecimiento de la densidad y el tamaño adecuados de los organoides. Si el ECM solubilizado se solidifica prematuramente durante el recubrimiento, colóquelo inmediatamente en hielo durante 10 min. Si la ECM solubilizada no forma estructuras en forma de cúpula, es probable que no se hayan eliminado suficientes medios de la muestra. Si este es el caso, diluya la muestra con un ECM más solubilizado hasta que se formen cúpulas.
Cuando se encuentra contaminación fúngica o bacteriana en una placa entera (ver Figura 4), la mejor solución es desechar la placa. Se puede intentar el tratamiento con medicamentos antimicóticos o antibióticos, pero el éxito de tal intento es extremadamente bajo. Si un solo pozo está contaminado en una placa, los pozos viables y no afectados pueden limpiarse (siga los pasos 4.1 a 4.5) en una placa nueva y monitorearse de cerca. Si la muestra ya ha sido congelada de emergencia, es aconsejable desechar toda la muestra, ya que la descongelación de la muestra expone a la incubadora a un riesgo de contaminación adicional.
El cultivo de organoides sanos debe estar al menos en la categoría de tamaño mediano y densidad media o mayor. La densidad óptima es crucial para el crecimiento del cultivo de organoides. La densidad más baja debe corregirse limpiando los organoides a densidad media. Si se produce la situación de densidad extrema (hacinamiento), los organoides deben ampliarse a más pozos. Los signos gruesos de apoptosis celular a menudo acompañan tanto al hacinamiento como a la baja densidad del cultivo de organoides. Si estos problemas no se corrigen a tiempo, todo el cultivo de organoides se volverá apoptótico en cuestión de días. Si los organoides alcanzan un tamaño extra grande o una densidad muy alta, el cultivo debe usarse para un experimento, congelación o fijación.
El medio organoide actualmente contiene 17 componentes, y la adición de factores de crecimiento necesarios para el mantenimiento y la expansión de los organoides puede ser costosa. Este problema se puede resolver mediante el cultivo de cultivos celulares 2D que sintetizan los factores de crecimiento para producir CMGF+ condicionado. El cultivo celular L-WRN produce factores de crecimiento Wnt-3a, R-Spondin-3 y Noggin37. La colonia celular utiliza un 90% de DMEM/F12 y un 10% de medios de cultivo FBS. Cuando el cultivo alcanza el 90 por ciento de confluencia, los medios se cosechan todos los días durante 1 semana. El medio cosechado se mezcla con 2x CMGF + (sin estos factores de crecimiento). Si bien los cultivos 2D pueden producir los factores de crecimiento necesarios a una fracción del costo, se debe esperar el tiempo y la preparación adicionales para producir los medios. Las concentraciones de factores de crecimiento entre lotes de medios condicionados también pueden diferir37,38.
Los cultivos de organoides derivados de células madre adultas caninas son un modelo biomédico único que puede ayudar a alcanzar los objetivos de la Iniciativa Una Salud39. La tecnología organoide se puede utilizar en muchas áreas de investigación básica y biomédica, que abarcan desde la biología del desarrollo, la fisiopatología, el descubrimiento y las pruebas de fármacos, la toxicología hasta el estudio de las enfermedades infecciosas y la medicina regenerativa40. La investigación traslacional y la traslacional inversa son áreas en las que los organoides caninos son aplicables15. Los perros se han utilizado durante siglos en entornos experimentales traslacionales, y su condición de animales de compañía también ha facilitado su posición como una de las especies más exploradas en medicina veterinaria.
En conclusión, este manuscrito proporciona protocolos operativos estandarizados para el aislamiento, mantenimiento, recolección y biobanco de organoides hepáticos e intestinales caninos para facilitar la aplicación de este modelo en diversos campos biomédicos. Este modelo es especialmente adecuado para promover la investigación traslacional inversa como herramienta de la Iniciativa Una Salud para promover el intercambio inter e intradisciplinar de conocimientos.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Los autores quieren expresar su gratitud a los empleados del Laboratorio de Diagnóstico Veterinario de la Universidad Estatal de Iowa, a saber, Haley M. Lambert, Emily Rahe, Rosalyn M. Branaman, Victoria J. Green y Jennifer M. Groeltz-Thrush, por el procesamiento oportuno de las muestras proporcionadas. Los autores desean agradecer el apoyo de la Startup de la Facultad, el Premio ISU VPR Miller, el Premio ISU VPR Miller y el subpremio NSF SBIR a ISU # 1912948.
Materials
| Chelating solution | |||
| D-Sorbitol | Fisher Chemical | BP439-500 | |
| DTT | Promega | V3151 | |
| KCl | Fisher Chemical | P217-500 | |
| KH2PO4 | Sigma | P5655-100G | |
| Na2HPO4-2H2O | Sigma | S5136-100G | |
| NaCl | Fisher Chemical | S271-500 | |
| Pen Strep | Gibco | 15140-122 | |
| Sucrose | Fisher Chemical | S5-500 | |
| Organoid media | |||
| [Leu15]-Gastrin I human | Sigma | G9145-.5MG | |
| A-83-01 | PeproTech | 9094360 | |
| Advanced DMEM/F12 | Gibco | 12634-010 | |
| B27 supplement | Gibco | 17504-044 | |
| FBS | Corning | 35-010-CV | |
| Glutamax | Gibco | 35050-061 | |
| HEPES | VWR Life Science | J848-500ML | |
| Human R-Spondin-1 | PeproTech | 120-38-500UG | |
| Murine EGF | PeproTech | 315-09-1MG | |
| Murine Noggin | PeproTech | 250-38-250UG | |
| Murine Wnt-3a | PeproTech | 315-20-10UG | |
| N2 supplement | Gibco | 17502-048 | |
| N-Acetyl-L-cysteine | Sigma | A9165-25G | |
| Nicotinamide | Sigma | N0636-100G | |
| Primocin | InvivoGen | ant-pm-1 | |
| ROCK inhibitor (Y-27632) | EMD Millipore Corp. | SCM 075 | |
| SB202190 (P38 inhibitor) | Sigma | S7067-25MG | |
| Stemolecule CHIR99021 (GSK3β) | Reprocell | 04-0004-base | |
| Trimethoprim | Sigma | T7883-5G | |
| Sulfamethoxazole | Sigma-Aldrich | S7507-10G | |
| Reagents | |||
| Acetic Acid, Glacial | Fisher Chemical | A38-500 | |
| Dimethyl Sulfoxide (DMSO) | Fisher Chemicals | D128-500 | |
| EDTA, pH 8.0, 0.5 M | Invitrogen | 15575-038 | |
| Formaldehyde (37%) | Fisher Chemical | F79P-4 | |
| Glutaraldehyde solution | Sigma | G5882 | |
| Matrigel Matrix For Organoid Culture | Corning | 356255 | Extracellular Membrane Matrix |
| Paraformaldehyde, 97% | Alfa Aesar | A11313 | |
| PBS, 1X (Phosphate-Buffered Saline) | Corning | 21-040-CM | |
| PBS, 1X (Phosphate-Buffered Saline) | Corning | 21-040-CM | |
| RNAlater Soln. | Invitrogen | AM7021 | RNA Storage Reagent |
| TrypLE Express | Gibco | 12604-021 | Trypsin-like Protease |
| Other | |||
| 6 Well Cell Culture Plate | Corning | 3516 | |
| ACD Hybez II Hybridization System | ACD a biotechne brand | 321710 | |
| Centrifuge Tube, 15 mL | Corning | 430766 | |
| CoolCell LX | Corning | BCS-405MC | |
| Cryogenic Vials | Corning | 430488 | |
| Disposable Centrifuge Tube (50 mL) | Fisherbrand | 05-539-13 | |
| GyroMini Nutating mixer (Rocker) | Labnet | S0500-230V-EU | |
| Heat Bath | Lab-Line Instruments | 3000 | |
| Mr. Frosty Freezing Container | ThermoFisher Scientific | 5100-0001 | |
| NanoDrop 2000 | ThermoFisher Scientific | ND2000CLAPTOP | SpectrophotometerAnalysis |
| Panasonic incubator | Panasonic | MCO-170ML-PA | |
| Parafilm M Wrapping Film | Bemis Company Inc | PM996/EMD | Laboratory Flexible Film Tape |
| Protected Disposable Scalpels | Bard-Parker | 239844 | |
| RNAscope 2.5 HD Assay – RED | ACD a biotechne brand | 322350 | |
| RNAscope H2O2 & Protease Plus Reagents | ACD a biotechne brand | 322330 | |
| RNAscope Target Retrieval Reagents | ACD a biotechne brand | 322000 | |
| RNAscope Wash Buffer Reagents | ACD a biotechne brand | 310091 | |
| Tissue Culture Dish | Dot Scientific | 6676621 | |
| Tissue Culture Plate 24 wells | Fisherbrand | FB012929 |
References
- Hickman, D. L., Johnson, J., Vemulapalli, T. H., Crisler, J. R., Shepherd, R. Commonly used animal models. Principles of Animal Research for Graduate and Undergraduate Students. , 117-175 (2017).
- De Jong, M., Maina, T. Of mice and humans: Are they the same? – Implications in cancer translational research. Journal of Nuclear Medicine. 51 (4), 501-504 (2010).
- Cannarozzi, G., Schneider, A., Gonnet, G. A phylogenomic study of human, dog, and mouse. PLoS Computational Biology. 3 (1), 0009-0014 (2007).
- Jacob, J. A. Researchers turn to canine clinical trials to advance cancer therapies. JAMA – Journal of the American Medical Association. 315 (15), 1550-1552 (2016).
- Ziegler, A., Gonzalez, L., Blikslager, A. Large animal models: The key to translational discovery in digestive disease research. Cellular and Molecular Gastroenterology and Hepatology. 2 (6), 716-724 (2016).
- Swanson, K. S., et al. Phylogenetic and gene-centric metagenomics of the canine intestinal microbiome reveals similarities with humans and mice. ISME Journal. 5 (4), 639-649 (2011).
- Coelho, L. P., et al. Similarity of the dog and human gut microbiomes in gene content and response to diet. Microbiome. 6 (1), 72 (2018).
- Nguyen, T. L. A., Vieira-Silva, S., Liston, A., Raes, J. How informative is the mouse for human gut microbiota research. DMM Disease Models and Mechanisms. 8 (1), 1-16 (2015).
- Bontempo, V. Nutrition and health of dogs and cats: Evolution of petfood. Veterinary Research Communications. 29, 45-50 (2005).
- Allenspach, K., Gaschen, F. Canine chronic enteropathies: A review. Schweizer Archiv fur Tierheilkunde. 145 (5), 209-222 (2003).
- Tribuddharatana, T., Kongpiromchean, Y., Sribhen, K., Sribhen, C. Biochemical alterations and their relationships with the metabolic syndrome components in canine obesity. Kasetsart Journal – Natural Science. 45 (4), 622-628 (2011).
- Chandra, L., et al. Derivation of adult canine intestinal organoids for translational research in gastroenterology. BMC Biology. 17 (1), 33 (2019).
- Schaefer, K., Rensing, S., Hillen, H., Burkhardt, J. E., Germann, P. G. Is Science the only driver in species selection? An internal study to evaluate compound requirements in the minipig compared to the dog in preclinical studies. Toxicologic Pathology. 44 (3), 474-479 (2016).
- MacArthur Clark, J. The 3Rs in research: A contemporary approach to replacement, reduction and refinement. British Journal of Nutrition. 120, 1-7 (2018).
- Schneider, B., et al. Model-based reverse translation between veterinary and human medicine: The one health initiative. CPT: Pharmacometrics and Systems Pharmacology. 7 (2), 65-68 (2018).
- Lehmann, R., et al. Human organoids: A new dimension in cell biology. Molecular Biology of the Cell. 30 (10), 1129-1137 (2019).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Kim, J., Koo, B. K., Knoblich, J. A. Human organoids: model systems for human biology and medicine. Nature Reviews Molecular Cell Biology. 21 (10), 571-584 (2020).
- Jensen, C., Teng, Y. Is it time to start transitioning from 2D to 3D cell culture. Frontiers in Molecular Biosciences. 7, 33 (2020).
- Ho, B. X., Pek, N. M. Q., Soh, B. S. Disease modeling using 3D organoids derived from human induced pluripotent stem cells. International Journal of Molecular Sciences. 19 (4), 936 (2018).
- Truskey, G. A. Human microphysiological systems and organoids as in vitro models for toxicological studies. Frontiers in Public Health. 6, 185 (2018).
- Caipa Garcia, A. L., Arlt, V. M., Phillips, D. H. Organoids for toxicology and genetic toxicology: applications with drugs and prospects for environmental carcinogenesis. Mutagenesis. , (2021).
- Augustyniak, J., et al. Organoids are promising tools for species-specific in vitro toxicological studies. Journal of Applied Toxicology. 39 (12), 1610-1622 (2019).
- Zietek, T., et al. Organoids to study intestinal nutrient transport, drug uptake and metabolism – Update to the human model and expansion of applications. Frontiers in Bioengineering and Biotechnology. 8, 577656 (2020).
- Zietek, T., Rath, E., Haller, D., Daniel, H. Intestinal organoids for assessing nutrient transport, sensing and incretin secretion. Scientific Reports. 5 (1), 1-10 (2015).
- Kar, S. K., et al. Organoids: a promising new in vitro platform in livestock and veterinary research. Veterinary Research. 52 (1), 1-17 (2021).
- Borcherding, D. C., et al. Sa1976 polyphenols reverse the pathologic effects of palmitic acid and high fat diet in canine enteroids. Gastroenterology. 158 (6), 486 (2020).
- Ambrosini, Y. M., et al. Recapitulation of the accessible interface of biopsy-derived canine intestinal organoids to study epithelial-luminal interactions. PLoS ONE. 15 (4), 0231423 (2020).
- Zdyrski, C., et al. Su124 homology directed repair in canine duodenal enteroids to mimic the wild-type P-glycoprotein mutation. Gastroenterology. 160 (6), 625 (2021).
- Li, Y., Tang, P., Cai, S., Peng, J., Hua, G. Organoid based personalized medicine: from bench to bedside. Cell Regeneration. 9 (1), 21 (2020).
- Kurr, L. A., Allenspach, K., Jergens, A., Mochel, J. P. Harnessing the biology of intestinal organoids to accelerate drug discovery in inflammatory bowel disease: A one health approach. The FASEB Journal. 34, 1 (2020).
- Nantasanti, S., et al. Disease modeling and gene therapy of copper storage disease in canine hepatic organoids. Stem Cell Reports. 5 (5), 895-907 (2015).
- Favier, R. P., et al. COMMD1-Deficient dogs accumulate copper in hepatocytes and provide a good model for chronic hepatitis and fibrosis. PLoS ONE. 7 (8), 42158 (2012).
- Kruitwagen, H. S., et al. Long-term survival of transplanted autologous canine liver organoids in a COMMD1-deficient dog model of metabolic liver disease. Cells. 9 (2), 410 (2020).
- Vilgelm, A. E., et al. Fine-needle aspiration-based patient-derived cancer organoids. iScience. 23 (8), 101408 (2020).
- Saxena, K., et al. Human intestinal enteroids: A new model to study human rotavirus infection, host restriction, and pathophysiology. Journal of Virology. 90 (1), 43-56 (2016).
- VanDussen, K. L., Sonnek, N. M., Stappenbeck, T. S. L-WRN conditioned medium for gastrointestinal epithelial stem cell culture shows replicable batch-to-batch activity levels across multiple research teams. Stem Cell Research. 37, 101430 (2019).
- Powell, R. H., Behnke, M. S. WRN conditioned media is sufficient for in vitro propagation of intestinal organoids from large farm and small companion animals. Biology Open. 6 (5), 698-705 (2017).
- Mackenzie, J. S., Jeggo, M. The one health approach-why is it so important. Tropical Medicine and Infectious Disease. 4 (2), 88 (2019).
- Artegiani, B., Clevers, H. Use and application of 3D-organoid technology. Human Molecular Genetics. 27 (2), 99-107 (2018).

