Bioimpresión omnidireccional cerámica en suspensiones cargadas de células para la generación de análogos óseos
Summary
Este protocolo describe una técnica de impresión 3D para fabricar estructuras similares a huesos depositando una tinta de fosfato de calcio en un soporte granular a base de gelatina. Los análogos óseos impresos se depositan en forma libre, con flexibilidad para la recolección directa de la impresión o la reticulación dentro de una matriz de células vivas para construcciones multifásicas.
Abstract
Estructuralmente, el tejido óseo es un compuesto inorgánico-orgánico que contiene células metabólicamente activas incrustadas dentro de una matriz jerárquica altamente mineralizada. Esta organización es difícil de replicar debido al entorno heterogéneo del hueso. La bioimpresión omnidireccional cerámica en suspensiones celulares (COBICS) es una técnica de bioimpresión basada en microgeles que replica de forma única la estructura mineral y celular del hueso. COBICS imprime construcciones complejas y biológicamente relevantes sin la necesidad de materiales de soporte de sacrificio o pasos de posprocesamiento severos (por ejemplo, radiación y sinterización a alta temperatura), que son dos de los mayores desafíos en la fabricación aditiva de construcciones miméticas óseas. Esta técnica se habilita a través de la extrusión de forma libre de una nueva tinta a base de fosfato de calcio dentro de una suspensión de microgel a base de gelatina. Las propiedades de límite elástico de la suspensión permiten la deposición y soportan la estructura ósea impresa. La reticulación UV y la nanoprecipitación luego lo “bloquean” en su lugar. La capacidad de imprimir cerámicas nanoestructuradas miméticas óseas dentro de biomateriales cargados de células proporciona control espaciotemporal sobre la macro y microarquitectura y facilita la fabricación en tiempo real de construcciones óseas complejas en entornos clínicos.
Introduction
El hueso tiene notables capacidades de regeneración como una de las pocas estructuras en el cuerpo que puede sanar recreando su composición celular normal, orientación y resistencia mecánica hasta un tamaño de defecto crítico, cuando la capacidad de curación endógena se ve comprometida1. El hueso, junto con el cartílago y el ligamento, apoya y facilita el movimiento del cuerpo, al tiempo que almacena minerales y grasas y produce células sanguíneas. Como tejido conectivo duro y denso, el hueso está compuesto principalmente de una fase inorgánica, agua y material orgánico compuesto principalmente de fibras de colágeno2. Las células están incrustadas dentro de esta matriz altamente mineralizada de fibras de colágeno I y cristales de hidroxiapatita (HA), formando una estructura jerárquica3.
La compleja organización de este tejido hace que la fabricación de alternativas sintéticas para replicar los micro y nanoambientes óseos heterogéneossea excepcionalmente desafiante 3. Para este propósito, se han propuesto una variedad de materiales, incluyendo biocerámicas, hidrogeles cargados de células y materiales sintéticos como soluciones para crear matrices óseas. Entre las técnicas de fabricación de andamios, las técnicas basadas en la impresión 3D han surgido recientemente y han recibido mucha atención de la comunidad de ingeniería de tejidos debido a su notable capacidad para permitir la fabricación de estructuras altamente sofisticadas y precisas con una gran promesa de tratamiento específico para el paciente 4,5,6 . Los hidrogeles han sido la opción más popular de imitadores de matrices y biotintas, ya que pueden imprimirse junto con células y moléculas bioactivas, generando construcciones funcionales6. Sin embargo, los hidrogeles carecen de las propiedades funcionales del hueso, como la resistencia mecánica y una fase inorgánica altamente calcificada que contiene células metabólicamente activas.
Los andamios cerámicos impresos en 3D generalmente requieren pasos de posprocesamiento, incluida la sinterización, los tratamientos a alta temperatura o el uso de productos químicos agresivos que deben lavarse a fondo antes de las aplicaciones in vitro o in vivo 5. Para abordar estas limitaciones, Lode et al.7 desarrollaron recientemente una pasta a base de fosfato α-tricálcico formada por hidroxiapatita, que puede imprimirse y fijarse en condiciones fisiológicas. Sin embargo, este material todavía no se puede imprimir junto con células vivas, ya que requiere un tratamiento posterior en un ambiente húmedo y una posterior inmersión en solución acuosa durante un largo período.
Alternativamente, se han propuesto hidrogeles cargados de células con partículas inorgánicas incorporadas como reemplazo de la matriz ósea 3D 8,9. A pesar de su gran capacidad para apoyar la viabilidad celular, no son capaces de recapitular el entorno de tejido óseo densamente mineralizado. Thrivikarman et al.10 adoptaron un enfoque biomimético en el que se utilizó un medio sobresaturado de calcio y fosfato con un análogo de proteína no colágena para imitar mejor la deposición de apatita a nanoescala. Sin embargo, sus construcciones aún no pueden generar construcciones 3D rígidas con una arquitectura a micro y macroescala que se asemeje al hueso.
El presente estudio aborda estas deficiencias a través del desarrollo de una estrategia de impresión para fabricar construcciones que imitan los huesos, en fases inorgánicas y orgánicas, que son capaces de integrar tanto células como factores de crecimiento11. COBICS recapitula de manera única la estructura mineral y celular del hueso utilizando una técnica de bioimpresión basada en microgeles. El protocolo aquí describe el proceso de síntesis de la tinta de hueso cerámico y los microgeles a base de gelatina y luego la combinación de células que permiten COBICS. El proceso comienza con la síntesis del principal material precursor de la tinta de hueso. El hidrogel reticulado se sintetiza y se forma en microgeles. Por último, la tinta ósea se deposita omnidireccionalmente en un baño de soporte de los microgeles cargados de células (Figura 1).
La tinta de hueso puede imprimirse en cualquier suspensión de microgeles que tengan las características apropiadas de tensión de fluencia, es decir, la capacidad de fluidificar a una velocidad de cizallamiento específica y posteriormente soportar la estructura depositada. Se han demostrado dos enfoques flexibles: una suspensión que consiste en microgeles de gelatina y una suspensión que consiste en microgeles de metacrilato de gelatina (GelMA). La primera suspensión se disuelve cuando la temperatura se eleva a 37 °C, la técnica de incrustación reversible de hidrogeles suspendidos (FRESH) de forma libre12, mientras que la segunda puede ser reticulada después de la impresión, “cosiendo” efectivamente los microgeles juntos y bloqueando la tinta de hueso impresa en su lugar. El presente estudio se centra en el uso de GelMA como matriz, ya que proporciona la ventaja única de poder apoyar el crecimiento celular con la impresión in situ de estructuras miméticas óseas complejas. En última instancia, este enfoque permite la generación de modelos de tejidos complejos con altos niveles de biomímesis y amplias implicaciones para el modelado de enfermedades, el descubrimiento de fármacos y la ingeniería regenerativa.
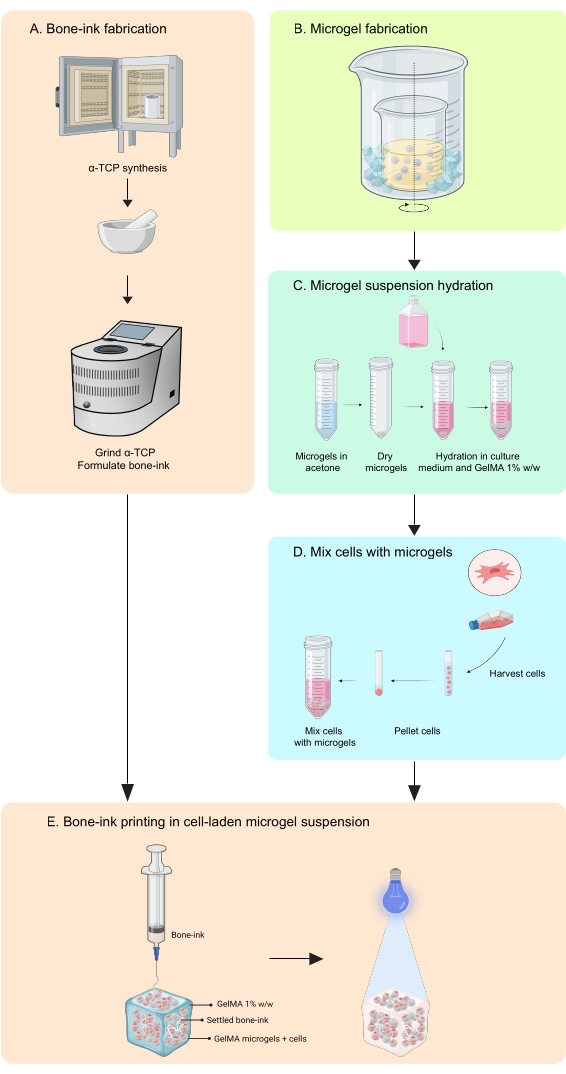
Figura 1: Esquema del flujo de trabajo . (A) La tinta ósea se sintetiza a partir de la síntesis de fosfato α-tricálcico y su posterior combinación con glicerol, polisorbato 80 y fosfato de amonio dibásico. (B) Los microgeles GelMA se fabrican mediante el método de emulsión de agua en aceite. Los microgeles obtenidos son entonces (C) hidratados y (D) combinados con células. Los compuestos de microgel celular se utilizan como un baño granular en el que se deposita la tinta ósea. (E) Todo el constructo se reticula a los rayos UV y se transfiere a la incubadora para su cultivo. Abreviaturas: α-TCP = fosfato α-tricálcico; GelMA = metacrilato de gelatina. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
La técnica de impresión 3D COBICS se desarrolló para permitir la fabricación de estructuras óseas mineralizadas mediante extrusión en una suspensión de microgel reticulable que contiene células vivas. La técnica ha sido aplicada a una suspensión de microgel degradable, y las células muestran buena viabilidad, diseminación y capacidad de diferenciación osteogénica dentro del sistema11. Un determinante clave del éxito de las construcciones creadas utilizando esta técnica es la sínte…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Los autores desean reconocer al Consejo Nacional de Salud e Investigación Médica (Grant no. GNT1111694 y GNT1141602) y al Consejo Australiano de Investigación (Grant no. FT180100417, FL150100060 y CE14100036). Los autores desean reconocer el Centro de Imágenes Biomédicas de la Universidad de Nueva Gales del Sur. Las figuras se crearon con Biorender.com, Adobe Photoshop y Adobe Illustrator y se han exportado bajo una suscripción paga.
Materials
| 3D Printer Extruder | Hyrel3D | EMO-25 | |
| 50 mL centrifuge tubes | Falcon | BDAA352070 | |
| Absolute Ethanol 100% Denatured | Chem-Supply | ||
| Acetone | Chem-Supply | 154871 | |
| Alumina crucible | Coors | ||
| Ammonium phosphate dibasic (NaHPO4) | Sigma | A5764 | |
| Autodesk Fusion 360 | Autodesk | ||
| Biosafety cabinet level 2 | |||
| Calcium carbonate | Sigma | 239216 | |
| Calcium hydrogen phosphate (CaHPO4) | Sigma | C7263 | |
| Cell culture flasks | Corning | various volumes used | |
| Cellulose Dialysis Tubes, 14 kDa cut-off | Sigma | D9777 | |
| Centrifuge | Eppendorf | 5430R | |
| Centrifuge | Sigma | 3-16KL | |
| Dispensing Tip, 23 G | Nordson | 7018302 | |
| DMEM, low glucose, pyruvate | Thermo FIsher | 11885084 | |
| DPBS, no calcium, no magnesium | Thermo FIsher | 14190144 | |
| Elevator furnace | Labec | ||
| Engine HR Multihead Printer | Hyrel3D | ||
| Fetal Bovine Serum | Bovogen | ||
| Gelatin type A, from porcine skin | Sigma | G2500 | |
| General Purpose Stainless Steel Tips | Nordson EF | ||
| Glycerol | Sigma | G9012 | |
| Human adipose derived stem cells | ATCC | PCS-500-011 | |
| LSM 800 Confocal Microscope | ZEISS | ||
| Lyophilizer (Alpha 1-4 LDplus) | Christ | 101541 | |
| Magnetic hot plate and stirrer | |||
| Methacrylic anhydride | Sigma | 276685 | |
| Mini 2 Desktop 3D Printer | LulzBot | ||
| Parafilm sealing film | Parafilm | PM996 | |
| Penicillin-Streptomycin | Thermo FIsher | 15140122 | |
| Planetary ball mill | |||
| Planetary ball mill jar | |||
| Polyoxyethylenesorbitan monooleate Tween-80 | Sigma | P6224 | |
| Scanning electron microscope | FEI Nova NanoSEM 450 FE-SEM | ||
| Science Kimwipes Delicate Task Wipers | Kimtech | 18813156 | |
| Stainless steel standard test sieve | |||
| Sunflower Oil | Community Co | ||
| Trypsin-EDTA 0.25% phenol red | Thermo FIsher | 25200056 | |
| ZEN Microscope Software | ZEISS | ||
| Live/Dead viability/ cytotoxicity kit for mammalian cells | Invitrogen | L3224 | |
| DMEM, low glucose, no phenol red | Thermo Fisher | 11054020 |
References
- Bates, P., Ramachandran, M. Bone injury, healing and grafting. Basic Orthopaedic Sciences. The Stanmore Guide. , 123-134 (2007).
- Lin, X., et al. The bone extracellular matrix in bone formation and regeneration. Frontiers in Pharmacology. 11, 757 (2020).
- Reznikov, N., et al. A materials science vision of extracellular matrix mineralization. Nature Reviews Materials. 1, 16041 (2016).
- Kang, H. W., et al. A 3D bioprinting system to produce human-scale tissue constructs with structural integrity. Nature Biotechnology. 34 (3), 312-319 (2016).
- Lin, K., et al. 3D printing of bioceramic scaffolds-Barriers to the clinical translation: From promise to reality, and future perspectives. Materials. 12 (17), 2660 (2019).
- Qu, M., et al. Multi-dimensional printing for bone tissue engineering. Advanced Healthcare Materials. 10 (11), 2001986 (2021).
- Lode, A., et al. Fabrication of porous scaffolds by three-dimensional plotting of a pasty calcium phosphate bone cement under mild conditions. Journal of Tissue Engineering and Regenerative Medicine. 8 (9), 682-693 (2014).
- Bernal, P. N., et al. Volumetric bioprinting of complex living-tissue constructs within seconds. Advanced Materials. 31 (42), 1904209 (2019).
- Diloksumpan, P., et al. Combining multi-scale 3D printing technologies to engineer reinforced hydrogel-ceramic interfaces. Biofabrication. 12 (2), 025014 (2020).
- Thrivikraman, G., et al. Rapid fabrication of vascularized and innervated cell-laden bone models with biomimetic intrafibrillar collagen mineralization. Nature Communications. 10 (1), 3520 (2019).
- Romanazzo, S., et al. Synthetic bone-like structures through omnidirectional ceramic bioprinting in cell suspensions. Advanced Functional Materials. 31 (13), 2008216 (2021).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), 1500758 (2015).
- Phromsopha, T., Baimark, Y. Preparation of starch/gelatin blend microparticles by a water-in-oil emulsion method for controlled release drug delivery. International Journal of Biomaterials. 2014, 829490 (2014).
- Moreno, D., et al. Solid-state synthesis of alpha tricalcium phosphate for cements used in biomedical applications. Boletín de la Sociedad Española de Cerámica y Vidrio. 59 (5), 193-200 (2020).

