항체 의존성 세포 독성 변형 화합물의 식별을 위한 High-content screening assay
Summary
이 프로토콜은 치료용 항-HER-2 항체가 있는 상태에서 자연 살해 세포 매개 유방암 세포 사멸을 조절하는 화합물을 식별하기 위한 자동화된 이미지 기반 고처리량 기술을 제시합니다.
Abstract
항원 특이 항체 또는 면역 관문 억제제를 사용한 면역 요법은 유방암 치료에 혁명을 일으켰습니다. 표피 성장 인자 수용체 HER2를 발현하는 유방암 세포는 항-HER-2 항체 트라스투주맙에 의해 표적화될 수 있다. 항체 의존성 세포성 세포독성(ADCC)은 HER-2의 항종양 작용에 연루된 중요한 기전이다. 암세포에 결합된 트라스투주맙은 ADCC 이펙터 세포(예: 자연 살해(NK) 세포, 대식세포 및 과립구)의 Fc 수용체에 의해 인식되어 암세포 사멸을 유도하는 이러한 면역 세포의 세포독성 활성을 유발할 수 있습니다. 우리는 high-content screening을 통해 새로운 ADCC 조절제 화합물을 식별하기 위해 ADCC의 정량화를 위한 이미지 기반 분석을 개발하기 시작했습니다. 분석에서 JIMT-1 유방암 세포를 과발현하는 HER2는 트라스투주맙의 존재 하에 NK-92 세포와 공동 배양되고 표적 세포 사멸은 자동 현미경 및 정량적 이미지 분석에 의해 정량화됩니다. 표적 세포는 EGFP 형광에 따라 이펙터 세포와 구별됩니다. 우리는 ADCC 조절제 약물을 식별하기 위해 분석에서 화합물 라이브러리를 테스트할 수 있는 방법을 보여줍니다. 이를 위해 실험실 선반에서 무작위로 선택된 정밀 화학 물질을 사용하여 화합물 라이브러리 테스트 플레이트를 설정했습니다. NK 세포 이동 및 탈과립을 방해할 것으로 예상되는 3가지 미세소관 불안정화 화합물(콜히친, 빈크리스틴, 포도필로톡신)도 테스트 라이브러리에 포함되었습니다. 테스트 스크린은 세 가지 양성 대조 화합물을 모두 적중으로 식별하여 화학 라이브러리에서 ADCC 변형 약물을 식별하는 방법의 적합성을 입증했습니다. 이 분석을 통해 화합물 라이브러리 스크리닝을 수행하여 항암 면역 요법을 받는 환자의 치료를 위한 보조 치료제로 사용할 수 있는 ADCC 강화 화합물을 확인할 수 있습니다. 또한, 상기 방법은 또한 상이한 적응증에 대해 암 환자에 의해 복용되는 치료 약물의 임의의 바람직하지 않은 ADCC-억제 부작용을 확인하는데 사용될 수 있다.
Introduction
항암 항체, 면역 체크포인트 억제제 또는 키메라 항원 수용체 발현 T(CAR-T) 세포를 사용한 면역요법은 암 치료에 대한 강력한 접근법을 나타낸다 1,2,3. 트라스투주맙은 HER-2 양성 초기 단계 또는 전이성 유방암뿐만 아니라 HER-2 양성 전이성 위암치료에 사용되는 인간화 단클론 항-HER-2(인간 표피 성장 인자 수용체 2) 항체입니다 4,5,6. 이는 주로 표피성장인자4의 증식 자극 효과를 억제함으로써 작용한다. 그러나 트라스투주맙은 암세포가 HER-2 자극에 대한 반응성을 상실하더라도 암세포 사멸을 효율적으로 유발하는 것으로 보고되었다7. 항체의 이러한 역설적 효과는 항체 의존성 세포 매개 세포 독성 (ADCC) 때문입니다.7. ADCC는 ADCC8,9의 이펙터 세포로 통칭되는 자연 살해(NK) 세포, 과립구 및 대식세포에 의해 매개될 수 있습니다. 트라스투주맙과 같은 항체가 종양 세포에 결합하는 경우, 이들 이펙터 세포는 Fc 수용체를 사용하여 항체의 불변(Fc) 영역에 결합합니다. 항체는 종양 세포와 Fc 수용체 보유 이펙터 세포를 연결하여 세포독성 매개체의 방출을 유발합니다10. 자연 살해 세포는 퍼포린을 함유한 과립의 세포독성 화물을 방출하여 표적 세포막과 그랜자임(세포 사멸 신호 전달 경로 유발)에 기공을 생성하여 면역 시냅스로 들어가 암세포의 세포자멸사를 유도합니다(그림 1 참조).
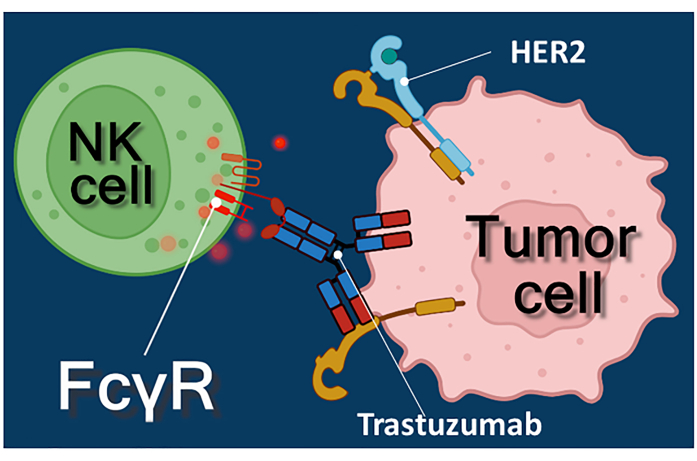
그림 1: ADCC의 이펙터 및 표적 세포 상호작용. 이펙터 NK 세포의 세포 표면 Fcγ 수용체는 종양 세포의 표면 상에서 발현되는 HER2 분자에 특이적인 항-HER2 트라스투주맙 항체의 Fc 영역을 인식한다. 따라서, 소위 면역 학적 시냅스가 두 세포 사이에 확립되어 이펙터 세포의 세포 독성 과립의 유도 된 엑소 사이토 시스를 유도한다. 방출된 퍼포린 및 그랜자임 분자는 결국 표적 세포의 세포자멸사를 초래합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
ADCC를 포함한 세포 독성을 정량화하기 위해 여러 분석법이 이전에 개발되었습니다. 황금 표준은 방사성 크롬 방출 방법으로, 표적 세포는 방사성 51Cr 동위 원소로 표지되고 ADCC는 용해 된 표적 세포11의 상청액에서 방사능을 측정하여 정량화됩니다. 방사성 약전 및 폐기물의 취급, 저장 및 폐기를 엄격하게 규제하기 때문에 명백한 문제로 인해 이 방법은 생명 과학자들 사이에서 점점 더 인기가 없게 되었습니다. 또한 처리량이 많은 응용 프로그램에도 적합하지 않습니다. 사멸된 표적 세포로부터 방출된 효소(예를 들어, 젖산-탈수소효소)의 활성을 측정하는 것은 51Cr분석에 대한 비방사성 대안을 제공할 수 있다(12). 그러나 이러한 분석은 표적 세포 사멸과 이펙터 세포 사멸을 구별하지 못합니다. ECIS(Electric Cell-substrate Impedance Sensing)는 ADCC13의 정량화에 적합한 것으로 입증되었지만 ECIS 장비는 대부분의 실험실에서 사용할 수 없으며 이 기술은 고처리량 애플리케이션/스크리닝과 호환되지 않습니다. 형광 표지된 세포는 많은 세포 생물학 분석에서 인기 있는 대안을 나타내며 유세포 분석 또는 플레이트 리더 기반 응용 분야에서 자주 사용됩니다14,15,16. 그러나 이러한 분석에는 종종 세척 단계가 포함되거나 고처리량 응용 분야(예: 유세포 분석 기반 기술)와 호환되지 않습니다. 이론적으로 ADCC 정량화에 적합해야 하는 일부 인기 있는 세포독성 분석은 ADCC 효율을 신뢰성 있게 결정하지 못한다13. 최근 형광 컨포칼 현미경의 보급으로 생명 과학의 다양한 영역에서 이미지 기반 고함량 분석이 점점 인기를 얻고 있습니다17. 한편으로, 세포 이미징 장비는 이제 다소 유비쿼터스적인 반면, 다른 한편으로는 획득 된 이미지에서 사실상 끝없는 형태 학적 매개 변수를 수집 할 수 있습니다. 따라서 우리는 high-content screening compatible ADCC assay를 개발하고 화합물 라이브러리 스크리닝에 대한 적합성을 입증하기 시작했습니다.
여기에서는 이미지 기반 ADCC 분석을 제시하고 이 분석을 HCS(High-Content Screening)에 사용하여 ADCC 조절 화합물을 식별하는 방법을 보여줍니다. 이 모델은 JIMT-1 유방암 표적 세포, CD16.176V.NK-92 이펙터 세포 및 인간화 단클론 항-HER2 항체 트라스투주맙을 기반으로 합니다. 이 방법을 통해 NK 세포의 종양 사멸 작용을 향상시킬 수 있는 약물을 식별하거나 ADCC를 방해하는 소분자를 식별하여 NK 세포 매개 ADCC의 메커니즘에 대한 통찰력을 얻을 수 있습니다. 우리는 ADCC와 관련하여 세포 매개 세포 독성을 정량화하는 것을 목표로 하는 생명 과학자들이 발견 과학 또는 약물 개발을 위해 이 분석을 사용하는 것이 도움이 될 수 있다고 제안합니다. 이 분석은 실험실에서 형광 이미징 및 정량적 이미지 분석에 접근할 수 있고 경험이 있는 경우 대안이 될 수 있습니다.
Protocol
Representative Results
Discussion
ADCC 반응은 비교적 오래 전에 기술되어왔다. 이 과정의 주요 분자 사건 또한 기술되었다19. ADCC를 측정하는 방법은 황금 표준 방사성 크롬 방출 분석, 세포질 효소 방출 분석에서 여러 형광 기반 유세포 분석 또는 마이크로플레이트 분석에 이르기까지 다양하다20. 그러나 이러한 분석의 일반적인 한계는 고처리량 응용 분야에 적합하지 않다는 것입니다. 이전에 ?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
LV는 국가 연구, 개발 및 혁신 사무소 보조금 GINOP-2.3.2-15-2016-00010 TUMORDNS”, GINOP-2.3.2-15-2016-00048-STAYALIVE 및 OTKA K132193, K147482로부터 자금을 받았습니다. CD16.176V.NK-92 세포는 Brink Biologics, lnc. San Diego, CA)는 전 세계적으로 특허로 보호되며 Nantkwest, lnc의 라이선스를 받았습니다. 저자는 NK-92 세포주 사용에 대한 도움과 기술적 조언을 해준 György Vereb와 Árpád Szöőr에게 감사를 표합니다.
Materials
| 5-fluorouracil | Applichem | A7686 | in compound library |
| 96-well Cell Carrier Ultra plate | PerkinElmer | LLC 6055302 | |
| Betulin | Sigma | B9757 | in compound library |
| CD16.176V.NK92 cells | Nankwest Inc. | ||
| Cerulenin | ChemCruz | sc-396822 | in compound library |
| Cisplatin | Santa Cruz Biotechnology | sc-200896 | in compound library |
| Colchicine | Sigma | C9754 | in compound library |
| Concanavalin-A | Calbiochem | 234567 | in compound library |
| Dexamethasone | Sigma | D4902 | in compound library |
| DMEM/F-12 medium | Sigma | D8437 | in JIMT-1 EGFP medium |
| DMSO | Sigma | D2650 | in compound library |
| Etoposide | Sigma | E1383 | E1383 |
| Fetal bovine serum (FBS) | Biosera | FB-1090/500 | JIMT-1 EGFP and NK medium |
| Fisetin | Sigma | F4043 | in compound library |
| Freedom EVO liquid handling robot | TECAN | ||
| Gallotannin | Fluka Chemical Corp. | 16201 | in compound library |
| Glutamine | Gibco | 35,050–061 | in NK medium |
| Harmony software | PerkinElmer | ||
| Humanized anti-HER2 monoclonal antibody (Herzuma) | EGIS Pharmaceuticals, Budapest Hungary | N/A | |
| Humulin R (insulin) | Eli Lilly | HI0219 | JIMT-1 EGFP medium |
| IL-2 | Novartis Hungária Kft. | PHC0026 | in NK medium |
| Isatin | Sigma | 114618 | in compound library |
| MEM Non-essential Amino Acids (MEM-NEAA) | Gibco | 11,140–050 | in NK medium |
| Na-pyruvate | Lonza | BE13-115E | in NK medium |
| Naringenin | Sigma | N5893 | in compound library |
| NQDI-1 | Sigma | SML0185 | in compound library |
| Opera Phenix High-Content Analysis equipment | PerkinElmer | ||
| Penicillin–streptomycin | Biosera | LM-A4118 | JIMT-1 EGFP and NK medium |
| Pentoxyfilline | Sigma | P1784 | in compound library |
| Phosphate buffered saline (PBS) | Lonza | BE17-517Q | to wash the cells |
| Podophyllotoxin | Sigma | P4405 | in compound library |
| Quercetin | Sigma | Q4951 | in compound library |
| Tannic acid | Sigma | T8406 | in compound library |
| Temozolomide | Sigma | T2577 | in compound library |
| Trypan blue 0.4% solution | Sigma | T8154 | for cell counting |
| Vincristine sulfate | Sigma | V0400000 | in compound library |
| α-MEM | Sigma | M8042 | in NK medium |
References
- Gupta, S. L., Basu, S., Soni, V., Jaiswal, R. K. Immunotherapy: an alternative promising therapeutic approach against cancers. Molecular Biology Reports. 49 (10), 9903-9913 (2022).
- Moretti, A., et al. The past, present, and future of non-viral CAR T cells. Frontiers in Immunology. 13, 867013 (2022).
- June, C. H., O’Connor, R. S., Kawalekar, O. U., Ghassemi, S., Milone, M. C. CAR T cell immunotherapy for human cancer. Science. 359 (6382), 1361-1365 (2018).
- Ross, J. S., et al. The HER-2 receptor and breast cancer: ten years of targeted anti-HER-2 therapy and personalized medicine. Oncologist. 14 (4), 320-368 (2009).
- Shitara, K., et al. Discovery and development of trastuzumab deruxtecan and safety management for patients with HER2-positive gastric cancer. Gastric Cancer. 24 (4), 780-789 (2021).
- Gianni, L., et al. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial. Lancet Oncology. 13 (1), 25-32 (2012).
- Barok, M., et al. Trastuzumab causes antibody-dependent cellular cytotoxicity-mediated growth inhibition of submacroscopic JIMT-1 breast cancer xenografts despite intrinsic drug resistance. Molecular and Cancer Therapy. 6 (7), 2065-2072 (2007).
- Gauthier, M., Laroye, C., Bensoussan, D., Boura, C., Decot, V. Natural Killer cells and monoclonal antibodies: Two partners for successful antibody dependent cytotoxicity against tumor cells. Crit Rev Oncol Hematol. 160, 103261 (2021).
- Gruijs, M., Sewnath, C. A. N., van Egmond, M. Therapeutic exploitation of neutrophils to fight cancer. Semin Immunol. 57, 101581 (2021).
- Mando, P., Rivero, S. G., Rizzo, M. M., Pinkasz, M., Levy, E. M. Targeting ADCC: A different approach to HER2 breast cancer in the immunotherapy era. Breast. 60, 15-25 (2021).
- van der Haar Avila, I., Marmol, P., Kiessling, R., Pico de Coana, Y. Evaluating antibody-dependent cell-mediated cytotoxicity by chromium release assay. Methods in Molecular Biology. 1913, 167-179 (2019).
- Broussas, M., Broyer, L., Goetsch, L. Evaluation of antibody-dependent cell cytotoxicity using lactate dehydrogenase (LDH) measurement. Methods in Molecular Biology. 988, 305-317 (2013).
- Toth, G., Szollosi, J., Vereb, G. Quantitating ADCC against adherent cells: Impedance-based detection is superior to release, membrane permeability, or caspase activation assays in resolving antibody dose response. Cytometry A. 91 (10), 1021-1029 (2017).
- Chung, S., Nguyen, V., Lin, Y. L., Kamen, L., Song, A. Thaw-and-use target cells pre-labeled with calcein AM for antibody-dependent cell-mediated cytotoxicity assays. Journal of Immunological Methods. 447, 37-46 (2017).
- Lee-MacAry, A. E., et al. Development of a novel flow cytometric cell-mediated cytotoxicity assay using the fluorophores PKH-26 and TO-PRO-3 iodide. Journal of Immunological Methods. 252 (1-2), 83-92 (2001).
- Tanito, K., et al. Comparative evaluation of natural killer cell-mediated cell killing assay based on the leakage of an endogenous enzyme or a pre-loaded fluorophore. Analytical Science. 37 (11), 1571-1575 (2021).
- Lin, S., Schorpp, K., Rothenaigner, I., Hadian, K. Image-based high-content screening in drug discovery. Drug Discovery Today. 25 (8), 1348-1361 (2020).
- Guti, E., et al. The multitargeted receptor tyrosine kinase inhibitor sunitinib induces resistance of HER2 positive breast cancer cells to trastuzumab-mediated ADCC. Cancer Immunology, Immunotherapy. 71 (9), 2151-2168 (2022).
- Li, F., Liu, S. Focusing on NK cells and ADCC: A promising immunotherapy approach in targeted therapy for HER2-positive breast cancer. Frontiers in Immunology. 13, 1083462 (2022).
- Perussia, B., Loza, M. J. Assays for antibody-dependent cell-mediated cytotoxicity (ADCC) and reverse ADCC (redirected cytotoxicity) in human natural killer cells. Methods in Molecular Biology. 121, 179-192 (2000).
- Garcia-Alonso, S., Ocana, A., Pandiella, A. Trastuzumab emtansine: Mechanisms of action and resistance, clinical progress, and beyond. Trends in Cancer. 6 (2), 130-146 (2020).

